糖尿病大鼠尿道舒张功能观察及尿道组织NGF、p75NTR表达变化
张冰,纪洪,张兆存,陈守臻,史本康(滨州医学院附属医院,山东滨州56600;山东大学齐鲁医院)
糖尿病是严重威胁着人类健康的常见疾病,糖尿病神经源性膀胱尿道功能障碍(NVUDD)是糖尿病引起的泌尿系统并发症,40%~85%的糖尿病患者可并发此症[1]。除了因糖尿病引发的膀胱逼尿肌收缩无力之外,可能存在糖尿病引发的尿道舒张机制的异常,从而加剧了NVUDD病变进程。神经生长因子(NGF)是一种多肽物质,是维持周围神经正常功能的重要的细胞因子,在因各种疾病导致的神经系统变性与修复过程中起重要作用[2]。研究发现,NGF在糖尿病膀胱病变中起重要作用[3]。p75神经营养素受体(p75NTR)是NGF受体,能介导施旺细胞对神经生长因子的功能性反应,在人类及大鼠膀胱中存在阳性表达[4,5]。研究发现,p75NTR在糖尿病感觉神经病变乃至尿道病变的发病机理中起重要作用[6]。2014年7~12月,我们观察了糖尿病模型大鼠的尿道舒张功能障碍情况,探讨NGF及其受体p75NTR在糖尿病尿道舒张功能病变中的作用。
1 材料与方法
1.1 实验动物及分组 健康成年雌性SPF级Wistar大鼠24只(体质量250~300 g),由上海斯莱克实验动物有限责任公司提供,均饲养于山东大学实验动物中心SPF实验室。大鼠随机分为2组,对照组、糖尿病组各12只。
1.2 糖尿病大鼠模型制备 糖尿病组大鼠按65 mg/kg(溶解在0.1 mol/L枸橼酸缓冲液中,pH 4.5)单剂量腹腔注射链脲佐菌素(STZ)制备糖尿病模型,对照组大鼠腹腔注射等量枸橼酸缓冲液。48~72 h后尾静脉采血,用血糖仪测定全血血糖。以血糖≥300 mg/dL为糖尿病模型建立。
1.3 尿道压(UPP)、等容膀胱压检测 造模8周后,经颈静脉插管注射乌拉坦麻醉;腹部正中切口,清理降结肠内污物,于降结肠近心端行松解结扎术;切断双侧输尿管,使输尿管远端表面化。于膀胱顶部插入膀胱导尿管和双腔尿道导管(后者包括尿道内的PE-50管子用于UPP测定,PE-160管子用于注入生理盐水),用于导管尖端的锥形塞子被置于膀胱颈。逐层关闭腹腔。使用生理盐水通过尿道导管的外腔,以0.075 mL/min的速度注入尿道,通过尿道导管的内腔记录UPP。逐渐注入生理盐水,直至诱导出等容膀胱节律收缩并记录。于耻骨联合高度放置压力传感器,使用POWERLAB进行数据采集。在稳定的膀胱基础活性的条件下(≥30 min),对UPP基线值、UPP最低值及诱发尿道舒张的膀胱压阈值进行检测。
1.4 大鼠尿道组织NGF、p75NTR mRNA检测 UPP及等容膀胱压检测后,断颈处死大鼠,完整切取尿道组织,采用实时定量RT-PCR法检测尿道组织NGF、p75NTR mRNA表达。以常规TRIzol 法提取尿道总RNA,用紫外分光光度计在波长260 nm处测量所提取RNA浓度。两步法试剂盒反转录为cDNA,条件为42 ℃ 50 min、85 ℃ 10 min。所用引物由北京奥科生物技术公司负责合成。NGF上游引物5′-AACAGGACTCACAGGAGCAA-3′,下游引物5′-CTTCCTGCTGAGCACACACA-3′;p75NTR上游引物5′-GAGGGCACATACTCAGACGAAGCG-3′,下游引物5′-GTCTATATGTTCAGGCTGGTAACC-3′。
1.5 大鼠尿道组织NGF、p75NTR蛋白检测 采用Western blotting法。取大鼠尿道组织,常规提取总蛋白,BCA法检测蛋白浓度;蛋白变性后SDS-PAGE电泳分离,电转至硝酸纤维素膜;5%脱脂牛奶室温封闭2 h,分别加入相应的一抗(1∶500)封闭过夜;TBST洗膜3次,加入辣根过氧化物酶标记二抗(1∶4 000羊抗鼠多抗),室温孵育2 h;常规洗膜3次,化学发光法显像;用凝胶图像处理系统分析免疫印迹条带进行光密度测定,以目的蛋白与Actin光密度比值表示蛋白表达量。
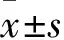
2 结果
2.1 各组UPP及诱发尿道舒张的膀胱压阈值比较 糖尿病组UPP最低值及诱发尿道舒张的膀胱压阈值均高于对照组(P<0.01)。两组UPP基线值差异无统计学意义。见表1。
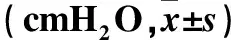
表1 两组UPP及诱发尿道舒张的膀胱压阈值比较
注:与对照组比较,*P<0.01。
2.2 各组尿道组织NGF、p75NTR mRNA及蛋白表达比较 糖尿病组尿道组织NGF、p75NTR mRNA及蛋白表达均低于对照组(P均<0.01)。见表2。
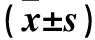
表2 各组尿道组织NGF、p75NTR mRNA及蛋白表达比较
注:与对照组比较,*P<0.01。
3 讨论
糖尿病是临床常见的内分泌疾病,其对膀胱、尿道功能的损伤受到越来越多的关注。目前对NVUDD的研究主要集中在膀胱本身的病变,对尿道病变的研究很少。对于由糖尿病引发的下尿路功能障碍,单纯的糖尿病膀胱病变不能完全或很好地解释。近年研究发现,尿道结构和功能异常在NVUDD发生发展过程中发挥重要作用[7]。Ueda等[8]研究发现,糖尿病可诱发多种神经病变,包括影响感觉神经和自主神经。因此,我们推测糖尿病诱导的多神经病变也可能影响尿道的舒张功能。
尿道肌肉包括尿道平滑肌和尿道横纹肌。正常储尿和排尿过程需要膀胱和尿道平滑肌及尿道外括约肌中的横纹肌之间精确协调,储尿期尿道处于收缩状态,抑制尿液排出,而排尿期尿道处于舒张状态,促进尿液排出。尿道平滑肌是由交感、副交感神经支配,而尿道外括约肌由躯体神经支配,尿道横纹肌主要是由躯体神经(阴部神经)支配。膀胱和尿道的神经、肌肉相互协调配合,完成正常的储尿和排尿生理。若神经支配方面受到损害,势必导致尿道收缩或舒张功能受损。在糖尿病的情况下,尿道的结构和功能发生病变,进而导致NVUDD的发生和发展。有研究证实,糖尿病大鼠尿道的全层厚度、肌层厚度及结缔组织区域与肌肉区域的比值均显著大于正常大鼠[9],说明糖尿病大鼠尿道可能发生了肌肉萎缩以及纤维化。虽然其具体机制尚不明确,但推测糖尿病尿道形态学改变与长期的慢性炎症密切相关。Yang等[10]通过检测糖尿病大鼠膀胱等容测压、尿道灌注压以及尿道外括约肌肌电图,发现糖尿病大鼠膀胱逼尿肌与尿道括约肌协同障碍,且尿道括约肌舒张减弱、对NO反应减弱、对α受体激动剂反应增强,这些改变使尿道阻力增加,从而造成排尿障碍。本研究发现,糖尿病组UPP最低点及诱发尿道舒张的膀胱压阈值均高于对照组,提示糖尿病大鼠膀胱收缩时尿道肌肉舒张功能发生异常。
NGF是一种多肽物质,其作用有以下几方面:①维持交感神经和感觉神经的生长发育及功能;②诱导轴突发芽、决定轴突的伸长时间,并可稳定神经结构、调节微丝蛋白的合成;③促进细胞分化及创伤愈合;④对神经细胞的凋亡有抑制作用[11]。高血糖状态下,NGF的表达降低,促进了糖尿病膀胱尿道病变进程[12]。研究发现,糖尿病同样损伤尿道的去神经化,直接损伤尿道括约肌及平滑肌[13],提示在糖尿病尿道病变过程中同样可能涉及到NGF作用障碍。p75NTR是NGF的低亲和力受体,属肿瘤坏死因子受体(TNFR)超家族成员,其通过不同的信号转导通路诱导以神经细胞为主的细胞增殖、迁移、分化、生存、凋亡、突触的建立和神经的形成,发挥多重生物学效应。p75NTR在神经细胞的早期发育过程中与NGF结合,介导了神经细胞的存活[14]。p75NTR主要在尿道的感觉神经纤维中表达,NGF和p75NTR的结合可诱导神经末梢向神经细胞传到神经营养信号,对于神经细胞的存活至关重要[15]。如果NGF和p75NTR的表达下调,这种神经营养效应就会显著的降低,进而引起神经细胞的生长抑制和凋亡。本研究发现,糖尿病组尿道组织NGF、p75NTR mRNA及蛋白表达均低于对照组,提示糖尿病大鼠尿道组织中NGF和p75NTR mRNA及蛋白表达显著下降,表明高血糖导致了尿道神经细胞中NGF产生的减少和p75NTR表达的下降。
综上所述,糖尿病引起的尿道舒张功能障碍是NVUDD的重要组成部分,在大鼠尿道组织中NGF和p75NTR的mRNA及蛋白表达显著下调,从而导致神经营养效应的错乱,神经细胞的凋亡。这种尿道去神经化是糖尿病尿道功能障碍的重要原因。
:
[1] Ong KL, Cheung BM, Wong LY, et al.Prevalence, treatment, and control of diagnosed diabetes in the US national health and nutrition examination survey 1999-2004[J]. Ann Epidemiol, 2008,18(3):222-229.
[2] Smith PG, Warn JD, Steinle JJ, et al. Modulation of parasympathetic neuron phenotype and function by sympa-thetic innervation[J]. Auton Neurosci, 2002,96(1):33-42.
[3] Tong YC, Cheng JT. Changes in bladder nerve-growth factor and p75NTR genetic expression in streptozotocin-induced diabetic rats[J]. BJU Int, 2005,96(9):1392-1396.
[4] Lee R, Kermani P, Teng KK, et al. Regulation of cell survival by secreted pro-neurotrophins[J]. Science, 2001,294(5548):1945-1948.
[5] Lebrun JF, Bertrand MJ, De Backer O, et al. ProNGF induces TNFalpha-depen-dent death of retinal ganglion cells througha p75NTR non-cell-autonomous signaling pathway[J]. Proc Natl Acad Sci USA, 2010, 107(8): 3817-3822.
[6] Delcroix JD, Tomlinson DR, Fernyhough P. Diabetes and axotomy-induced deficits in retrograde axonal transport of nerve growth factor correlate with decrease levels of p75NTR protein in lumbar dorsal root ganglia[J]. Brain Res Mol Brain Res, 1997, 51(1-2): 82-90.
[7] Chen S, Zhu Y, Feng X, et al.Changes in alpha1-adrenoceptor and NGF/proNGF pathway: a possible mechanism in diabetic urethral dysfunction[J]. Urol Int, 2014, 93(3):344-351.
[8] Ueda T, Yoshimura N, Yoshida O. Diabetic cystopathy: relationship to autonomic neuropathy detected by sympathetic skin response[J]. J Urol, 1997, 157(2): 580-584.
[9] Rodrigues AA Jr, Suaid HJ,Fazan VP, et al. Histologic study of urethral extracellular matrix and collagen from aging and long-term alloxan-induced diabetic male rats[J]. Urology, 2011,77(2): 6-11.
[10] Yang ZG,Dolber PC,Fraser MO.Diabetic urethropathy compounds the effects of diabetic cystopathy[J]. J Urol, 2007, 178 (11):2213-2219.
[11] Steers WD, Tuttle JB. Mechanisms of disease: the role of nerve growth factor in the pathophysilogy of bladder disorders[J]. Nat Clin Pract Urol, 2006, 3(2):101-110.
[12] Wehrman T, He X, Raab B, et al. Structural and mechanistic insights into nerve growth factor interactions with the TrkA and p75 receptors[J]. Neuron, 2007, 53(1):25-38.
[13] Torimoto K, Hirao Y, Matsuyoshi H, et al. Alpha1-adrenergic mechanism in diabetic urethral dysfunction in rats[J]. J Urol, 2005, 173(3):1027-1032.
[14] Dobrowsky RT, Werner MH, Castellino AM, et al. Activation of sphingomyelin cycle through the lowaffinity neurotrophin receptor[J]. Science, 1994,265(5178): 1596-1599.
[15] Bronfman FC, Tcherpakov M, Jovin TM, et al. Ligand-induced internalization of the p75 neurotrophin receptor: a slow route to the signaling endosome[J]. J Neurosci, 2003,23(8):3209-3220.

