西格列汀对高糖培养条件下系膜细胞增殖及细胞外基质产生的影响
赵晋晋,皮银珍,欧阳俊,杨腾舜,刘罗坤(长沙市第一医院,长沙410000)
作为糖尿病最重要的微血管并发症之一,糖尿病肾病(DN)的发病率逐年升高,且因其致残致死率高日益受到重视。但DN的发病机制复杂,目前尚未完全明确,缺乏有效的防治手段,是目前内分泌学领域研究的重点。肾小球系膜细胞的增殖及细胞外基质(ECM)的产生是糖尿病肾病发生、发展的中心环节[1]。二肽基肽酶-4(DPP-4)抑制剂西格列汀具有降低血糖、减轻胰岛素抵抗、保护胰岛功能的作用,自临床应用以来,其对DN患者的肾脏保护作用备受重视,但机制尚不明确。本课题组前期研究发现,西格列汀可以减少早期DN患者肾脏组织ECM的产生[2]。2016年1月~2017年1月,我们观察了西格列汀对高糖条件下肾小球系膜细胞增殖及ECM相关蛋白表达的影响,探讨西格列汀肾脏保护作用的分子机制。
1 材料与方法
1.1 细胞与材料 人肾小球系膜细胞株(HMCs)(湘雅医学院干细胞研究所馈赠,来源于ADCC细胞库)。西格列汀原药(Sigma公司);DMEM培养基(GIBCO公司);ECM相关蛋白纤维连接蛋白(FN)、Ⅳ型胶原(ColⅣ)多克隆抗体(Santa Cruz公司);FITC标记的荧光二抗(Santa Cruz公司); MTT细胞增殖及细胞毒性检测试剂盒(Beytime公司);二氧化碳细胞培养箱(Binder公司);培养瓶、培养板(Corning公司);超净工作台(苏州净化集团泰安公司);凝胶成像系统、紫外分光光度剂(Beckman公司)。
1.2 细胞培养 复苏系膜细胞HMCs细胞株,加入低糖DMEM培养液(D-葡萄糖5.5 mmol/L),在37 ℃、5% CO2培养箱中静置培养,每2天更换1次培养液。将处于对数生长期的细胞接种于6孔培养板中,密度为 4×105/孔,达90%融合时更换无血清的DMEM培养液同步化12 h,用于后续分组处理。
1.3 系膜细胞FN、ColⅣ分泌最佳培养时间点及葡萄糖最佳干预浓度的确定 系膜细胞分别在正常浓度(D-葡萄糖5.5 mmol/L)、高糖浓度(D-葡萄糖终浓度分别为10、20、30 mmol/L)培养基中培养,并按照观察时间长短分为6、12、24、48 h四个时间点。ELISA法检测各浓度及各时间点细胞上清液中FN、ColⅣ蛋白含量,以FN、ColⅣ蛋白含量最高的时间点为最佳时间点,FN、ColⅣ蛋白含量最高的葡萄糖浓度为葡萄糖最佳干预浓度。最终确定最佳干预时间为24 h,葡萄糖最佳干预浓度为30 mmol/L。
1.4 系膜细胞分组与干预 将系膜细胞分为正常对照组、高糖组、高糖+西格列汀低剂量组、高糖+西格列汀中剂量组、高糖+西格列汀高剂量组。正常对照组在D-葡萄糖终浓度5.5 mmol/L的培养基中培养;高糖组在D-葡萄糖终浓度为30 mmol/L的培养基中培养;高糖+西格列汀低、中、高剂量组在D-葡萄糖终浓度为30 mmol/L,西格列汀终浓度分别为0.1、1、10 μmol/L的培养基中培养。各组均培养24 h。
1.5 系膜细胞增殖能力观察 采用MTT法。取各组细胞,调整细胞密度至5×104/mL;每孔100 μL接种于96孔板中,放入细胞培养箱培养24 h贴壁后,加入干预药物,培养24 h。每孔加50 μL 1×MTT,在37 ℃孵育4 h后吸出上清液;每孔加150 μL DMSO,用平板摇床摇匀,酶标仪在570 nm波长处检测每孔的光密度。先将各测试孔的OD值减去本底OD值(完全培养基加MTT,无细胞),得出各受试孔OD值。
1.6 系膜细胞ECM相关蛋白ColⅣ、FN蛋白表达检测 采用Western blotting法。收集各组细胞,细胞裂解提取总蛋白,将各样本蛋白浓度调整至一致后点样,SDS-PAGE电泳分离后4 ℃ 300 mA转膜70 min;5%脱脂牛奶封闭37 ℃ 2 h。加入稀释后的一抗(鼠抗人ColⅣ一抗1∶800,鼠抗人FN一抗1∶400)4 ℃孵育过夜,弃去一抗,用PBST在脱色摇床下洗膜10 min×4次,加HRP标记羊抗鼠IgG(稀释度1∶80 000)室温下孵育1 h后,弃去二抗,洗膜4次后,加入ECL化学发光显示剂显影曝光,Gel pro4.0凝胶光密度分析软件分析蛋白条带IOD值。
2 结果
2.1 各组系膜细胞增殖能力比较 与正常对照组比较,高糖组系膜细胞增殖能力增强(P<0.05)。高糖+西格列汀中、高剂量组系膜细胞增殖能力均低于高糖组(P均<0.05)。见表1。
2.2 各组系膜细胞Fn、ColⅣ蛋白表达比较 与正常对照组比较,高糖组系膜细胞 FN及ColⅣ蛋白表达增加(P均<0.05)。高糖+西格列汀中剂量组、高糖+西格列汀高剂量组系膜细胞 FN及ColⅣ蛋白表达均低于高糖组,且高糖+西格列汀高剂量组低于高糖+西格列汀中剂量组(P均<0.05)。见图1、表1。
注:与正常对照组比较,*P<0.05;与高糖组比较,△P<0.05;与高糖+西格列汀中剂量组比较,#P<0.05。
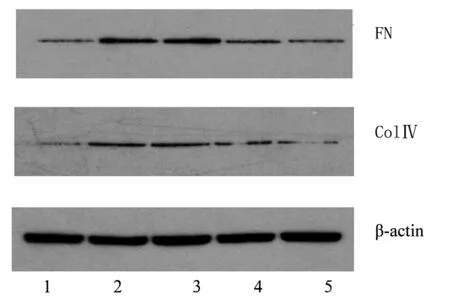
注:1为正常对照组;2为高糖组;3为高糖+西格列汀低剂量组;4为高糖+西格列汀中剂量组;5为高糖+西格列汀高剂量组。
图1各组系膜细胞FN、ColⅣ蛋白表达情况(Westernblotting法)
3 讨论
DN的发病过程伴随着肾小球肥大、肾小球和肾小管基底膜增厚以及系膜区ECM堆积,最终导致肾小球硬化[3]。肾小球系膜细胞是肾小球中功能最活跃的细胞,是肾小球硬化发生发展的主要参与者[4,5]。正常情况下,肾小球系膜细胞的数量、形态和位置保持相对稳定。而在糖尿病代谢紊乱,如高糖的病理情况下,肾小球系膜细胞可以出现表型转化——系膜细胞增殖、肥大、凋亡增加[6,7];表型转化后的肾小球系膜细胞可使分泌ECM增加,导致肾小球硬化,参与DN的发生发展。
FN是一种血浆糖蛋白,在肾脏可以通过结合纤维蛋白、纤维蛋白原,使其他胶原沉积于肾小球和肾小管基底膜。研究发现,在肾脏疾病的早期即有FN的升高,随着病程的延长,其增加更为明显,是导致肾脏纤维化的重要因素[8]。ColⅣ是构成肾小球基底膜胶原蛋白的最主要成分,正常情况下含量极微,但在病理情况下,其合成增多及降解减少致ECM积聚,是许多肾脏疾病发生、终至肾小球硬化的主要原因或重要参与因素之一[9]。本研究发现,与正常对照组比较,高糖组系膜细胞增殖能力增强,系膜细胞 FN及ColⅣ蛋白表达增加。提示高糖培养条件下,系膜细胞增殖指数增高,细胞外基质重要成分FN、ColⅣ表达合成增加。表明高糖能诱导系膜细胞出现异常增殖,合成和分泌大量基质成分,最终导致肾小球硬化。
DPP-4抑制剂西格列汀自2006年获得FDA批准上市以来,其安全性、有效性得到了临床证实,其在临床指南中的地位也逐渐提高。大量的临床及基础研究证实,西格列汀在2型糖尿病患者中应用可以有效地降低血糖,而且有不增加体质量、减轻胰岛素抵抗、保护胰岛功能的优点[10]。随着西格列汀临床的广泛应用,临床中发现西格列汀对糖尿病大血管及微血管病变也有一定保护作用[11]。Penno等[12]采用Meta分析发现,西格列汀可以降低2型糖尿病患者尿微量白蛋白水平,且此作用不依赖于患者糖化血红蛋白水平的降低。Mori等[13]研究发现,西格列汀可以降低2型糖尿病患者尿微量白蛋白水平,且此作用不依赖于患者血糖水平的降低。国内的很多临床及动物实验也发现,西格列汀具有独立于降糖作用之外的肾脏保护作用[14]。但其肾脏保护作用的具体机制尚不明确。动物实验发现,西格列汀可以通过下调糖尿病大鼠肾脏组织中的8-羟基脱氧鸟苷(8-OHdG)的表达,上调超氧化物歧化酶(SOD)的表达,改善氧化应激水平,发挥对糖尿病大鼠肾脏的保护作用[15]。本研究发现,高糖+西格列汀中、高剂量组系膜细胞增殖能力均低于高糖组,高糖+西格列汀中剂量组、高糖+西格列汀高剂量组系膜细胞 FN及ColⅣ蛋白表达均低于高糖组,且高糖+西格列汀高剂量组低于高糖+西格列汀中剂量组。提示西格列汀干预能显著抑制系膜细胞增殖,下调系膜细胞FN、ColⅣ蛋白表达,且西格列汀含量较高时的抑制作用越强。表明西格列汀能够通过抑制系膜细胞增殖,下调FN和ColⅣ的表达,进而减少ECM在肾脏的进行性堆积,这可能是其保护肾脏的重要作用机制之一。
综上所述,高糖能促进系膜细胞增殖、促进系膜细胞ECM的产生,西格列汀可抑制系膜细胞增殖,减少系膜细胞FN、ColⅣ的表达,这可能是其发挥肾脏保护作用的机制之一。目前本研究结果仅限于体外实验,下一步将继续开展动物实验进一步证实相关研究发现。
:
[1] Brosius FC, Khoury CC, Buller CL, et al. Abnormalities in signaling pathways in diabetic nephropathy[J]. Expert Rev Endocrinol Metab, 2010, 5(1):51-64.
[2] 赵晋晋,皮银珍,欧阳俊,等.西格列汀对早期糖尿病肾病患者纤维蛋白的影响[J].航空军医,2017,45(4):160-161.
[3] 袁静,沈燕,谢莹,等.胸腺素β4对肾小管间质纤维化大鼠转化生长因子β/结缔组织生长因子的影响[J].中华肾脏病杂志,2016,32(3):206-211.
[4] Kolset SO, Reinholt FP, Jenssen T. Diabetic nephropathy and extracellular matrix[J]. J Histochem Cytochem, 2012,60(12):976-986.
[5] 于小函,邸波.肾小球系膜细胞与糖尿病肾病[J].医学研究杂志,2015,44(9):7-9.
[6] Tervaert TW, Mooyaart AL, Amann K, et al. Pathologic classification of diabetic nephropathy[J]. J Am Soc Nephrol, 2010, 21(4):556-563.
[7] Ni WJ, Tang LQ, Wei W. Research progress in singnalling pathway in diabetic nephropathy[J]. Diabetes Metab Res Rev, 2015,31(3):221-233.
[8] Hu C, Sun L, Xiao L, et al. Insights into the mechanisms involved in the expression and regulation of extracellular matrix proteins in diabetic nephropathy[J].Curr Med Chem, 2015, 22(24):2858-2870.
[9] Marchant V, Droguett A, Valderrama G, et al. Tubular overexpression of Gremlin in transgenic mice aggravates renal damage in diabetic nephropathy[J]. Am J Physiol Renal Physiol, 2015, 309(6):559-568.
[10] Dobs AS, Goldstein BJ, Aschner P, et al. Efficacy and safety of sitagliptin added to ongoing metformin and rosiglitazone combination therapy in a randomized placebo-controlled 54-week trial in patients with type 2 diabetes[J]. J Diabetes, 2013, 5(1): 68-79.
[11] Park SH, Nam JY, Han E, et al. Efficacy of different dipeptidyl peptidase-4 (DPP-4) inhibitors on metabolic parameters in patients with type 2 diabetes undergoing dialysis[J]. Medicine, 2016, 95(32):e4543.
[12] Penno G, Garofolo M, Prato SD. Dipeptidyl peptidase-4 inhibition in chronic kidney disease and potential for protection against diabetes-related renal injury[J]. Nutr Metab Cardiovasc Dis, 2016, 26(5):361-373.
[13] Mori H, Okada Y, Arao T, et al. Sitagliptin improves albuminuria in patients with type 2 diabetes mellitus[J]. J Diabetes Inves, 2014,5(3):313-319.
[14] Hocher B, Reichetzeder C, Alter ML. Renal and cardiac effects of DPP4 inhibitors from preclinical development to clinical research.[J]. Kidney Blood Press Res, 2012,36(1):65-84.
[15] 陈洋,王建平,付婷,等.糖尿病大鼠肾脏8-羟基脱氧鸟苷和超氧化物歧化酶表达的变化及西格列汀对其影响的研究[J].中国糖尿病杂志,2015,23(1):75-78.

