米诺环素-锌纳米缓释凝胶治疗大鼠实验性牙周炎效果观察
王冬梅,王永学,杨熙晨,赵迎迎(新乡医学院第三附属医院,河南新乡453003;新乡医学院生命科学技术学院)
牙周炎是细菌性感染引起的常见口腔疾病,致病菌以革兰阴性厌氧菌为主,致病菌形成菌落并以菌斑形式沉积在牙间、牙面和修复体的表面,侵犯牙龈及牙周组织而导致慢性炎症发生[1,2]。抑制并清除牙周组织致病菌落是治疗牙周炎的重要途径,机械清除被认为是最有效的治疗方法[3]。但是牙周组织解剖形态复杂,存在一些器械难以到达的部位,操作死区较多,并且机械治疗对牙周组织破坏严重,容易引起继发性损伤[4]。米诺环素属于四环素家族成员,是治疗牙周的常用药物,具有广谱抗菌作用,能对抗牙周组织局部严重、抑制胶原酶活性及促进牙周组织再生[5]。盐酸米诺环素软膏(派力奥)由于作用面积、作用时间的局限性,不能在牙周组织发挥较好的抗菌作用,临床应用效果不满意。2016年3~10月,我们以盐酸米诺环素为原料药,融合微量杀菌功能元素锌以及具有良好生物相容性的纳米材料,制备持久、缓释、高黏附的米诺环素-锌纳米缓释凝胶,观察其对大鼠实验性牙周炎的治疗效果。
1 材料与方法
1.1 动物与材料 6月龄SD雄性大鼠30只,体质量(248±27)g,由北京维通利华实验动物技术有限公司提供。牙龈卟啉单胞菌ATCC33277购自四川大学口腔疾病研究国家重点实验室。派力奥购自Sunstar INC公司(日本)。
1.2 米诺环素-锌纳米缓释凝胶制备 2%壳聚糖乙酸溶液和0.02 mmol/L硫酸锌溶液等体积60~70 ℃水浴回流4 h,自然冷却至室温,获得壳聚糖-锌络合物溶液。该溶液中加入适量米诺环素水溶液,搅拌均匀。持续搅拌下缓慢滴加三聚磷酸钠(TPP),体积比为7∶1,至溶液呈现乳白色终止滴加。无水乙醇沉淀微球,洗涤,冷冻干燥得含米诺环素的壳聚糖-锌微球。预冷2%壳聚糖溶液和58%β-GP(4∶1)混合,调pH 7.0,然后添加含米诺环素的壳聚糖-锌微球,搅拌均匀即可,终溶液中米诺环素浓度2%,锌浓度1.25 μg/mL。4 ℃保存备用。上述混合液置于37 ℃水浴约3 min可形成凝胶。
1.3 大鼠实验性牙周炎模型构建 30只大鼠均给予1%戊巴比妥钠40 mg/kg行腹腔注射麻醉。采用0.3 mm正畸钢丝,在左上颌第一磨牙近牙龈根方处行牙颈部结扎,持续1周。牙龈卟啉单胞菌ATCC33277溶于生理盐水,均匀涂布至牙龈龈沟内,1次/周,持续6周。6周后可观察到磨牙牙龈充血、红肿,探诊有血液溢出、牙周袋形成、牙龈沟液增加;取大鼠磨牙龈下菌斑进行细菌厌氧培养,可见菌落密集形成,认为牙周炎模型构建成功。
1.4 分组与干预方法 将模型大鼠随机分为对照组、派力奥组、米诺环素凝胶组各10只。派力奥组以派力奥软膏注入牙周袋内,至充满为止;米诺环素凝胶组以米诺环素-锌纳米缓释凝胶注入牙周袋内,至充满为止;对照组以等体积生理盐水注入牙周袋内,至充满为止。每周用药1次,连续4周。
1.5 观察指标
1.5.1 治疗前后牙龈菌落数 于治疗前及完成治疗后,用生理盐水对大鼠炎症磨牙冲洗30 s,使用无菌刮治器在牙龈3个位置取菌斑,厌氧环境下培养6 d。取黑色菌落,ImagePro-pus5.0计数牙菌斑总菌数、牙龈卟啉单胞菌数。
1.5.2 治疗前后牙龈出血指数(SBI)、牙菌斑指数(PLI) ①SBI:治疗前及治疗后,将大鼠头部固定,暴露大鼠患牙,探针探入牙龈沟内10 s,观察牙龈沟出血情况。评分标准:探诊无出血为0分;探诊后点状出血,牙龈无颜色改变,无水肿为1分;探诊出血,牙龈出现颜色改变,无水肿为2分;探诊出血,牙龈出现颜色改变,轻度水肿为3分;探诊出血,牙龈出现颜色改变,水肿明显为4分;自发性牙龈出血为5分。②PLI:治疗前及治疗后,在大鼠患牙牙面均匀涂抹2%碱性品红溶液,生理盐水冲洗3次,牙龈表面紫红色即为菌斑位置。评分标准:牙龈无牙菌斑存在为0分,存在薄牙菌斑为1分,存在中等量牙菌斑为2分,存在大量牙菌斑为3分。
1.5.3 治疗后牙齿松动度(TM)、牙槽骨丧失(ABL) ①TM:以治疗后患牙向颊舌向松动为1分,患牙向颊舌向及近中远中向均松动为2分,患牙向颊舌向及近中远中向、垂直向均松动为3分。②ABL:治疗后处死大鼠,除去上颌骨软组织,于1 mol/L氢氧化钠浸泡5~10 min,甲基蓝染色以显色釉牙骨质界,在20倍放大镜下采用千分尺测量患牙釉牙骨质界与牙槽嵴顶的距离,取近颊点、颊点、远颊点、近舌点、舌点和远舌点6个测量值,以均值描述牙槽骨丧失值。
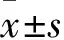
2 结果
2.1 三组牙龈菌落数比较 治疗后米诺环素凝胶组与派力奥组牙菌斑总菌数均下降(P均<0.05),米诺环素凝胶组牙菌斑总菌数、牙龈卟啉单胞菌数均低于派力奥组和对照组(P均<0.05)。见表1。
2.2 三组治疗前后SBI、PLI比较 治疗后派力奥组、米诺环素凝胶组SBI、PLI均下降,米诺环素凝胶组SBI、PLI低于派力奥组和对照组(P均<0.05)。见表2。
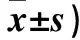
表1 三组牙龈菌落数比较(个,
注:与同组治疗前比较,*P<0.05;与对照组同期比较,﹟P<0.05;与派力奥组同期比较,△P<0.05。
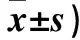
表2 三组治疗前后SBI、PLI比较(分,
注:与同组治疗前比较,*P<0.05;与对照组同期比较,﹟P<0.05;与派力奥组同期比较,△P<0.05。
2.3 三组治疗后TM、ABL比较 治疗后米诺环素凝胶组、派力奥组TM、ABL均低于对照组(P均<0.05)。米诺环素凝胶组TM、ABL均低于派力奥组(P均<0.05)。见表3。
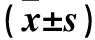
表3 三组治疗后TM、ABL比较
注:与对照组比较,*P<0.05;与派力奥组比较,﹟P<0.05。
3 讨论
牙周炎的致病菌以革兰阴性厌氧菌为主,细菌表面物质、分泌的毒素、体内酶等不仅可直接或间接损伤牙周组织,而且还能激发宿主炎性免疫反应,引起组织细胞变性坏死、牙周膜纤维破坏、牙槽骨吸收等一系列损害,导致牙龈出血、牙周溢脓、牙齿过敏、牙齿松动甚至脱落等一系列症状[6]。牙周炎的治疗主要包括机械和非机械性治疗。机械治疗是牙周炎主要治疗方式[3],但是由于牙周组织解剖形态复杂、操作难度大,严重影响机械治疗的效果。抗菌药物目前被广泛用于口腔炎性疾病的治疗,取得了一定效果[7]。但是抗菌药物治疗牙周炎存在用药方式选择的难题,全身用药时只有一小部分药物运送到牙周组织,治疗浓度相对较低,难以最大限度发挥抗菌作用;而大剂量、长时间使用抗菌药物又易引起不良反应,同时可导致菌群失调或耐药菌株的产生[8];如果采用含漱、冲洗、涂布等局部用药方式,则药物作用面积有限,并且在牙周停留时间较短,药物渗透性差,影响抗菌效果[4]。
缓释剂能够使药物缓慢、有控制地释放到病变局部组织,可持续有效地作用于病变部位。由于药物在局部缓慢释放,从而避免了全身用药所引起的细菌耐药和不良反应。缓释剂在保持牙周部有效抗菌药物浓度的同时,还可以减少给药次数,从而提高患者的依从性[9]。米诺环素在牙周炎过程中主要发挥抗菌作用,其对中间普氏菌、牙龈卟啉单胞菌、伴放线聚集杆菌等主要牙周致病菌均有抑制作用[10]。米诺环素是脂溶性抗菌药物,渗透性强,除了能直接穿透细菌细胞壁与tRNA结合,达到抑菌效果还能外,还能抑制胶原酶活性、促进成纤维细胞附着,抑制骨吸收等作用[11]。盐酸米诺环素的高效性和长效性,适宜制备缓释剂用于牙周炎等局部炎性疾病的治疗。锌作为人体内所必需的元素,具有广泛的生物学效应,局部高浓度的锌对细菌具有直接杀灭作用[12]。锌可与细菌内核酸、蛋白质中的巯基(-SH)、氨基(-NH2)等含硫、氨官能团发生反应来阻断蛋白表达,以达到杀灭细菌作用。此外,锌参与机体内多种酶的合成与激活,加速组织细胞生长发育及创伤后组织修复[13],促进牙周膜细胞的增殖和分化[14],在一定程度上具有保护牙体组织和抗菌、促愈的双重功效。在米诺环素、锌之外,我们采用生物可降解聚合物纳米材料作为载体,其具有良好的生物相容性,能够高效富集到靶组织,使装载药物最大限度发挥靶向治疗作用,并且可在体内降解,不会对人体造成损害。
清除细菌是治疗牙周炎最重要的手段。盐酸米诺环素软膏的有效成分是2%含量的盐酸米诺环素,与我们自制米诺环素-锌纳米缓释凝胶中米诺环素浓度相同。本研究结果显示,治疗后米诺环素凝胶组牙菌斑总菌数、牙龈卟啉单胞菌数均低于派力奥组和对照组,提示采用自制米诺环素-锌纳米缓释凝胶治疗的大鼠无论是牙菌斑总菌数还是牙龈卟啉单胞菌数均低于盐酸米诺环素软膏治疗,表明米诺环素-锌纳米缓释凝胶较盐酸米诺环素软膏有更好的抑菌效果;米诺环素凝胶组SBI、PLI低于派力奥组,提示米诺环素-锌纳米缓释凝胶有较为肯定的抑菌作用;米诺环素凝胶组TM、ABL低于派力奥组,提示米诺环素凝胶治疗后的牙齿松动度、牙槽骨丧失情况优于盐酸米诺环素,表明米诺环素-锌纳米缓释凝胶可以有效改善牙周炎的临床体征。
综上所述,米诺环素-锌纳米缓释凝胶能够有效治疗大鼠实验性牙周炎,可以抑制牙龈致病菌落生长、炎症蛋白表达,减轻炎症导致的牙龈出血、牙龈松动等临床症状,具有临床应用价值。
:
[1] Tobón-Arroyave SI, Isaza-Guzmán DM, Pineda-Trujillo N, et al. Association study of vitamin d receptor (vdr) - related genetic polymorphisms and their haplotypes with chronic periodontitis in colombian population[J]. J Clin Diagn Res, 2017, 11(2):60-66.
[2] Usin MM, Tabares SM, Menso J, et al. Generalized aggressive periodontitis: microbiological composition and clinical parameters in non-surgical therapy[J]. Acta Odontol Latinoam, 2016,29(3):255-261.
[3] Martande S, Kumari M, Pradeep AR, et al. Comparative evaluation of efficacy of subgingivally delivered 1.2% Atorvastatin and 1.2% Simvastatin in the treatment of intrabony defects in chronic periodontitis: a randomized controlled trial[J]. J Dent Res Dent Clin Dent Prospects, 2017,11(1):18-25.
[4] 孟焕新. 牙周病学[M]. 4版.北京:人民卫生出版社,2013:25.
[5] Perayil J, Menon KS, Biswas R, et al. Comparison of the efficacy of subgingival irrigation with 2% povidone-iodine and tetracycline HCl in subjects with chronic moderate periodontitis: A clinico microbiological study[J]. Dent Res J (Isfahan), 2016,13(2):98-109.
[6] Koneru B, Shi Y, Wang YC, et al. Tetracycline-containing MCM-41 mesoporous silica nanoparticles for the treatment of escherichia coli[J]. Molecules, 2015,20(11):19690-19698.
[7] Chhina S, Rathore AS, Juneja S. Alpha-2-Macroglobulin levels in gingival crevicular fluid pre- and post-scaling and root planing with adjunctive tetracycline fibers in chronic periodontitis: a randomized controlled trial[J]. J Contemp Dent Pract, 2015,16(6):474-478.
[8] Yadav SK, Khan G, Mishra B. Advances in patents related to intrapocket technology for the management of periodontitis[J]. Recent Pat Drug Deliv Formul, 2015,9(2):129-145.
[9] 王姹,徐燕员,李全利,等.米诺环素凝胶辅助治疗牙周炎的临床研究[J].安徽医科大学学报,2012,47(1):63-66.
[10] Madhumathi K, Sampath KT. Regenerative potential and anti-bacterial activity of tetracycline loaded apatitic nanocarriers for the treatment of periodontitis[J]. Biomed Mater, 2014,9(3):035002.
[11] Jhinger NK, Jain R. Comparison of periochip (chlorhexidine gluconate 2.5 mg) and arestin (minocycline hydrochloride 1mg) in the management of chronic periodontitis[J]. Indian J Dent, 2015,6(1):20-26.
[12] 杨旸,唐子圣.锌与龋病关系的研究进展[J].牙体牙髓牙周病学杂志,2012,22(9):543-546.
[13] Banerji A, Panzov V, Young M, et al. Hospital admissions for lower respiratory tract infections among infants in the Canadian Arctic: a cohort study[J]. CMAJ Open, 2016,4(4):615-622.
[14] 罗立伟.锌对人牙周膜细胞增殖分化的影响研究分析[J].吉林医学,2009,30(23):28-30.

