雷公藤多苷对糖尿病大鼠肝脏损伤的影响及机制
白钰,刘应生,马晓丽(新疆医科大学附属中医医院,乌鲁木齐830000;新疆医科大学)
糖尿病是一种常见的内分泌疾病,主要是指胰岛素分泌或作用存在缺陷而引起的以慢性(长期)高血糖为主要特征的代谢异常综合征,常见于中老年人[1,2]。糖尿病可引起多种慢性并发症,可涉及肝、肾、肺、骨骼肌、神经系统、视网膜、血管及皮肤等组织器官,严重影响患者的生活质量[3,4]。糖尿病肝脏病变相对轻微、隐匿,临床上常常会忽视,但其却是引起慢性肝病和肝脏酶谱异常的主要原因,且缺乏有效的治疗手段。因而,寻找新的治疗策略对于提高糖尿病肝脏损伤的防治水平至关重要[5,6]。雷公藤多苷是从雷公藤系卫矛科植物中提取的活性成分,具有良好的抗炎和免疫抑制作用,能延缓糖尿病肾病进展,但其对糖尿病肝病的效果仍需作进一步的深入研究[7,8]。2017年1月~10月,我们对糖尿病大鼠模型给予雷公藤多苷进行干预,探讨雷公藤多苷对糖尿病大鼠肝损伤的影响及可能的机制。
1 材料与方法
1.1 实验动物及分组 选取SPF级健康、雄性Wistar大鼠60只,体质量170~210 g,购于新疆维吾尔自治区实验动物研究中心。采用随机数字表法随机选取12只大鼠作为对照组,其余48只建立糖尿病大鼠模型,成模大鼠随机分为模型组、低剂量组、中剂量组和高剂量组,每组12只。
1.2 实验方法
1.2.1 糖尿病大鼠模型建立 参照文献[9]中的方法将模型组、低剂量组、中剂量组和高剂量组大鼠制备糖尿病模型,具体方法如下:大鼠均腹腔注射含65 mg/kg链尿佐菌素(STZ)的柠檬酸钠缓冲液,注射3 d后采尾部静脉血测血糖,当血糖浓度达到16.7~22.2 mmol/L即为造模成功。对照组大鼠注射等体积的柠檬酸钠缓冲液。两组大鼠饲养条件完全相同,每日观察各组大鼠的一般情况,并记录各组大鼠的体质量和血糖水平。
1.2.2 干预方法 造模成功后,低剂量组、中剂量组和高剂量组分别给予1、3、6 mg/(kg·d)雷公藤多苷灌胃,对照组和模型组给予同等体积的蒸馏水进行灌胃。连续给药8周,干预期间不给予任何降糖治疗。
1.2.3 血清NF-κB和TNF-α水平检测 采用ELISA法。干预 8周后取动脉血,以3 500 r/min离心10 min,取上清液,采用酶联免疫吸附法测定血清NF-κB和TNF-α水平。各检测试剂盒均购自北京中杉金桥生物有限公司,具体检测步骤严格按照试剂盒说明书进行操作。
1.2.4 肝组织形态观察 各组大鼠取血后处死,取出肝脏,以冰PBS反复灌注冲洗后用滤纸吸去多余水分。取部分肝组织以10%多聚甲醛固定,常规石蜡包埋后做连续切片;行HE和Masson染色,显微镜下大鼠肝脏组织形态学变化。
1.2.5 肝组织Toll样受体4(TLR4)、NF-κB mRNA表达检测 采用RT-PCR法。取部分肝组织,采用RNA提取试剂盒提取总RNA,利用逆转录试剂盒逆转录为DNA,在聚合酶的作用下进行扩增。RNA提取试剂盒、逆转录试剂盒以及RT-PCR试剂盒均购自美国Thermo公司。TLR4上游引物5′-GTTCATCTGCTTTCTGCTG-3′,下游引物5′-TGATTCTGCCTGATGTTGC-3′;NF-κB上游引物5′-AAAAACG-CATCCCAAGGTGC-3′,下游引物5′-AAGCTCAAGCCACCATACCC-3′。扩增条件:95 ℃ 5 min,95 ℃ 15 s、60 ℃ 60 s,72 ℃ 330 s,共进行40个循环。电泳后得到目的条带的光密度值,然后与对照组的光密度值进行比较,最终得出TLR4、NF-κB mRNA的表达水平,具体检测步骤严格按照试剂盒说明书进行。以目标mRNA灰度值/β-actin灰度值表示。
1.2.6 肝组织TLR4、NF-κB蛋白表达检测 采用Western blotting法。取大鼠肝组织制备蛋白样,并取约75 μg以10%十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶进行电泳。TLR4小鼠单克隆抗体、NF-κB p65兔多克隆抗体均购自英国Abcam公司。电泳分离后转移至孔径为0.45 μm的聚偏二氟乙烯(PVDF)膜,置于5%脱脂奶粉中封闭2 h;加入一抗(TLR4、NF-κB)后4 ℃孵育过夜,以0.5%TBS-T溶液洗膜3次后再加入HRP标记的二抗进行反应;以0.5%TBS-T溶液洗膜3次用化学发光法进行显色,并采用软件进行灰度值分析,计算各目标蛋白与β-actin的灰度比值。
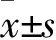
2 结果
2.1 各组大鼠肝脏形态观察 HE染色显示,对照组大鼠肝小叶结构清晰,肝索排列规则,肝细胞绕中央静脉呈放射状排列,细胞大小均匀,胞核呈圆形;模型组肝小叶结构消失,肝细胞形态不规则,细胞肿胀呈弥漫性大泡样脂肪变性;低剂量组、中剂量和高剂量组肝损伤较模型组有不同程度减轻,其中高剂量组改善最为明显。见图1。Masson染色显示,与对照组比较,模型组肝组织可见大量粗大蓝色胶原纤维,而低剂量组、中剂量和高剂量组蓝色胶原纤维均有所减少,其中高剂量组仅见少量蓝色纤维。见图2。

注:A为对照组;B为模型组;C为低剂量组;D为中剂量组;E为高剂量组。图1 各组肝组织形态表现(HE染色,×40)

注:A为对照组;B为模型组;C为低剂量组;D为中剂量组;E为高剂量组。图2 各组肝组织形态表现(Masson染色,×40)
2.2 各组血清NF-κB、TNF-α水平比较 模型组血清NF-κB和TNF-α水平均高于对照组(P均<0.05)。低剂量组、中剂量组和高剂量组血清NF-κB和TNF-α水平均低于模型组(P均<0.05)。中剂量组和高剂量组血清NF-κB和TNF-α水平均低于低剂量组,高剂量组血清NF-κB和TNF-α水平均低于中剂量组(P均<0.05)。见表1。
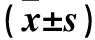
表1 各组血清NF-κB及TNF-α水平比较
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05;与低剂量组比较,﹟P<0.05;与中剂量组比较,▲P<0.05。
2.3 各组肝组织TLR-4、NF-κB mRNA和蛋白表达比较 模型组TLR-4、NF-κB mRNA和蛋白表达均高于对照组(P均<0.05)。低剂量组、中剂量组和高剂量组TLR4、NF-κB mRNA和蛋白表达均低于模型组(P均<0.05)。中剂量组和高剂量组TLR4、NF-κB mRNA和蛋白表达均低于低剂量组,高剂量组TLR4、NF-κB mRNA和蛋白表达均低于中剂量组(P均<0.05)。见表2、图3。
3 讨论
糖尿病是一组以高血糖为特征的代谢性疾病,主要是由于胰岛素分泌缺陷或其生物作用受损,或两者兼有引起,其发病率较高,现已成为危害人类健康的主要疾病之一[10]。糖尿病可引起多种慢性疾病的发生,其不但可引起肾脏、心脏、视网膜、神经等组织器官的损害,亦可导致各种类型的肝脏损伤[11]。研究表明,糖尿病患者可发生非特异性肝酶学异常,其微血管病变及微循环障碍可累及机体各脏器缺血缺氧,而缺血可引起肝细胞内二氧化碳蓄积、酸中毒、氧供减少、氧消耗增加,使肝脏转氨酶活性增加,胆红素代谢紊乱,重者可引起肝细胞坏死,尤其是当合并糖尿病酮症酸中毒时更易发生肝脏损害[12]。糖尿病与脂肪肝的关系也较为密切,在引起脂肪肝的所有病因中,糖尿病占第三位,仅次于肥胖与饮酒。另外,糖尿病患者易患病毒性肝炎,其患病率约为正常人的2~4倍,其原因可能是糖尿病患者对病毒的易感性增强,但目前对于糖尿病性肝脏损伤的发病机制仍不完全清楚,现有治疗手段的效果也不甚理想。中药雷公藤多苷是近些年研究的热点之一,是一种新型的免疫抑制剂,主要是从雷公藤中提取分离而得。其具有较高的抗炎和免疫抑制活性,现已开始应用于类风湿关节炎的临床治疗[13]。也有研究表明,雷公藤多苷对于延缓糖尿病肾病的发展有一定的作用[14]。但对于其是否能治疗糖尿病肝脏损伤,仍需作进一步的研究。
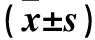
表2 各组大鼠肝组织TLR-4、NF-κB mRNA和蛋白表达比较
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05;与低剂量组比较,﹟P<0.05;与中剂量组比较,▲P<0.05。
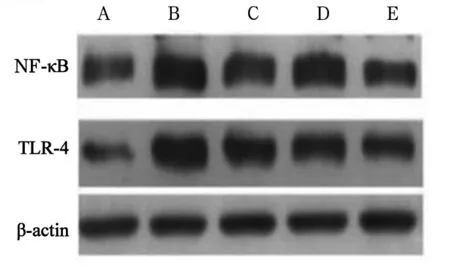
注:A为对照组;B为模型组;C为低剂量组;D为中剂量组;E为高剂量组。
图3各组肝组织TLR-4、NF-κB蛋白表达情况(Westernblotting法)
糖尿病性肝损伤绝大部分表现为肝脏脂肪浸润导致的非酒精性脂肪性肝病,这也是导致各种慢性肝病和肝脏酶谱异常的主要原因之一。本研究发现,模型组肝小叶结构消失,肝细胞形态不规则,细胞肿胀呈弥漫性大泡样脂肪变性,提示糖尿病大鼠肝脏发生了一定程度的病理性改变。低剂量组、中剂量和高剂量组肝损伤有不同程度减轻,其中高剂量组改善最为明显;提示雷公藤多苷对于糖尿病大鼠的肝脏损伤有一定的改善作用,且随着雷公藤多苷的剂量增加,改善效果更加明显。
TLR4是TLRs的亚型之一,在肝实质细胞和非实质细胞均广泛表达,而TLR4信号通路是多种刺激因子的共同通路,可有效调控肝脏免疫、炎症反应等相关基因的表达。NF-κB是TLR4信号通路中最关键的转录调控因子,在免疫和炎症反应过程起着重要的作用。研究表明,NF-κB的激活可启动或增强多种与炎症、免疫相关的基因转录、翻译,进而导致炎性介质大量释放,并能引起粒细胞、巨噬细胞等杀伤细胞的趋化和聚集,炎性细胞浸润,与肝脏损伤有着密切的关系。本研究发现,模型组TLR-4、NF-κB mRNA和蛋白表达均高于对照组,提示TLR-4、NF-κB mRNA和蛋白表达可能与肝脏损伤有着密切的关系;而高剂量组TLR-4、NF-κB mRNA和蛋白相对表达量较模型组、低剂量组和中剂量组降低,提示雷公藤多苷可有效抑制TLR-4、NF-κB mRNA和蛋白的表达,进而抑制TLR4/NF-κB信号通道的介导作用,且随着剂量的加大,抑制作用更加明显,而这可能是雷公藤多苷能改善糖尿病患者肝损伤的机制之一。
进一步分析发现, 模型组血清NF-κB和TNF-α水平均高于对照组,提示大鼠血清 NF-κB和TNF-α水平可能与肝脏损伤有着密切的关系;而低剂量组、中剂量组和高剂量组血清NF-κB和TNF-α水平均低于模型组,且高剂量组血清NF-κB和TNF-α水平均低于中剂量组及低剂量组,提示雷公藤多苷可有效抑制各种炎症因子的表达水平,进而改善肝损伤程度,且随着剂量的加大,抑制效果更为明显,其机制可能与雷公藤多苷能抑制TLR-4信号通道的介导有关。
综上所述,雷公藤多苷可减轻糖尿病大鼠的肝脏损伤,其机制可能与抑制TLR-4/NF-κB介导的炎症信号通路有关,值得进一步研究。
:
[1] Group IHS. Minimizing hypoglycemia in diabetes[J]. Diabetes Care, 2015, 38(8):1583.
[2] Benjamin FV, Laura JS, Valgerdur S, et al. Twelve type 2 diabetes susceptibility loci identified through large-scale association analysis[J]. Nat Rev Genet, 2015, 42(7):579-589.
[3] 杨立勇.关注糖尿病微血管并发症研究进展[J].中国糖尿病杂志,2016,8(8):449-451.
[4] 朱秋荣,徐惠庆,骆田斌,等.2型糖尿病患者慢性并发症与脑卒中发病的关系[J].浙江预防医学,2017,29(4):351-354.
[5] 袁敏,张敏,杨长青.肝硬化患者糖代谢异常与肝功能关系的临床回顾性分析[J].国际消化病杂志,2015,35(2):140-143.
[6] 陈育霞,刘树红,李明远,等.糖尿病性肝纤维化伴肝微血管病变1例[J].肝脏,2015(8):656-657.
[7] 李颖,汪永忠,罗欢,等.类风湿关节炎患者雷公藤甲素血清浓度测定及其药动学研究[J].中国中医药信息杂志,2014,21(1):85-87.
[8] 樊丹平,郭晴晴,郑康,等.雷公藤甲素对胶原诱导关节炎大鼠MIP-1α、Eotaxin和MCP-1表达的影响[J].世界科学技术-中医药现代化,2016,18(6):1027-1032.
[9] Nugent DA, Smith DM, Jones HB. A review of islet of Langerhans degeneration in rodent models of type 2 diabetes[J]. Toxicol Pathol, 2008,36(4): 529-551.
[10] Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes[J]. N Engl J Med, 2015, 373(22):2117.
[11] Lurbe E, Redon J, Kesani A, et al. Increase in nocturnal blood pressure and progression to microalbuminuria in type 1 diabetes[J]. N Engl J Med, 2016, 348(3):260-264.
[12] 陈明云, 李婷婷, 张蓉,等. 成人隐匿性自身免疫性糖尿病合并非酒精性脂肪肝的临床特征及其与血清C肽水平的关系[J]. 中华医学杂志, 2015, 95(44):3575-3578.
[13] 周铭, 马丽华, 崔颖,等. 雷公藤甲素对类风湿关节炎患者外周血T细胞的免疫抑制作用[J]. 中国药房, 2014,25(47):4441-4443.
[14] 张敏, 王守安, 刘黎星. 雷公藤多苷干预TLR-NF-κB通路发挥免疫抑制作用[J]. 中草药, 2014, 45(9):1288-1292.

