胰高血糖素对不同葡萄糖培养条件下胰岛β细胞分泌胰岛素的影响及机制
丁艳洁,李思源,李军,常子涛,张震,吴媛媛(石河子大学医学院,新疆石河子8300;石河子大学医学院第一附属医院)
糖尿病是以高血糖为特征的代谢性疾病。研究表明,无论1型还是2型糖尿病的发病都与胰岛素(INS)分泌异常有关[1,2]。因此,关于INS分泌的作用机制及其影响因素已成为近年来国内外研究的热门方向。胰高血糖素(Gn)和INS之间存在着拮抗作用:当血糖浓度过低时,Gn分泌增多,使血糖含量升高;当血糖浓度过高时,INS分泌增多,使血糖含量降低。本课题组前期研究表明,Gn在不同浓度葡萄糖环境下,均可促进胰岛β细胞分泌INS[3~5],但其具体机制尚不明确。环磷酸腺苷(cAMP)是一种由三磷酸腺苷(ATP)脱掉两个磷酸羧合而成的环状核苷酸,当血糖升高时,Gn可以刺激ATP环化为cAMP,从而增加其浓度。2016年10月~2017年1月,我们对胰岛β细胞系MIN6细胞在不同浓度葡萄糖环境下进行Gn干预,观察对INS及cAMP含量的影响,探讨Gn影响INS分泌的机制,为糖尿病治疗药物的开发提供实验依据。
1 材料与方法
1.1 细胞与材料 胰岛β细胞系MIN6细胞。主要试剂有cAMP信号通路刺激剂盐酸异丙肾上腺素(ISO)、0.25%含EDTA-胰蛋白酶液、小鼠INS-ELISA试剂盒、cAMP-ELISA试剂盒等。
1.2 细胞培养 用含15%胎牛血清(FBS)、4.5 g/L葡萄糖、2%青链霉素、1%L-谷氨酰胺及1%β-巯基乙醇的DMEM培养基,在37 ℃含5%CO2的培养箱中培养,传代至4~15代用于实验。
1.3 不同浓度Gn对MIN6细胞分泌INS及cAMP影响的观察
1.3.1 分组及干预方法 取对数生长期的MIN6细胞,以4×105/孔的密度接种于6孔板中,分为正常对照1组、低糖1组、高糖1组,分别在葡萄糖终浓度为0、2.8、16.7 mmol/L培养基中培养,每组均给予0、500、1 000 ng/L的Gn干预1 h。
1.3.2 细胞上清液INS含量检测 采用ELISA法。各组细胞接种于6孔培养板,换2%FBS的培养基37 ℃培养12 h后,Krebs液冲洗3遍,之后每孔分别加不同刺激的处理液,正常对照组的0 ng/L水平加入Kerbs液,37 ℃孵育1 h;吸取每孔上清液分装,用INS-ELISA试剂盒检测INS含量。
1.3.3 细胞上清液cAMP含量检测 采用ELISA法。各组细胞接种于6孔培养板,用不含FBS的培养基饥饿处理12 h,之后每孔分别加入不同刺激液1 mL处理,正常对照组的0 ng/L水平加入同体积Kerbs液,37 ℃培养箱孵育7 min。吸除刺激液,每孔加0.1 mmol/L的HCl 1 mL,室温孵育20 min;收集上清液,用cAMP-ELISA试剂盒检测cAMP含量。
1.4 加入ISO后不同浓度Gn对MIN6细胞分泌INS及cAMP影响的观察
1.4.1 分组及干预方法 取对数生长期的MIN6细胞,以4×105/孔的密度传代于6孔板中,分为正常对照2组、低糖2组、高糖2组,分别在葡萄糖终浓度为0、2.8、16.7 mmol/L培养基中培养,并均加入500 μL ISO,37 ℃孵育10 min,然后每组均给予0、500、1 000 ng/L的Gn干预1 h。
1.4.2 细胞上清液INS及cAMP含量检测 同1.3.2、1.3.3。
2 结果
2.1 不同浓度Gn对MIN6细胞分泌INS及cAMP的影响
2.1.1 细胞上清液INS含量比较 正常对照1组、低糖1组、高糖1组中,1 000 ng/L Gn干预后INS含量高于500、0 ng/L时,500 ng/L Gn干预后INS含量均高于0 ng/L时(P均<0.05)。见表1。
2.1.2 各组细胞上清液cAMP含量比较 正常对照1组中,1 000 ng/L Gn干预后cAMP含量高于0 ng/L时,500 ng/L Gn干预后cAMP含量高于0 ng/L时(P均<0.05)。低糖1组、高糖1组中,1 000 ng/L Gn干预后cAMP含量均高于500、0 ng/L时,500 ng/L Gn干预后cAMP含量均高于0 ng/L时(P均<0.05)。见表2。
2.2 加入ISO后不同浓度Gn对MIN6细胞分泌INS的影响
2.2.1 细胞上清液INS含量比较 正常对照2组、低糖2组、高糖2组中,1 000 ng/L Gn干预后INS含量均高于500、0 ng/L时,500 ng/L Gn干预后INS含量均高于0 ng/L时(P均<0.05)。见表1。

表1 不同浓度Gn条件下各组细胞上清液INS分泌量比较
注:与同组0 ng/L比较,*P<0.05;与同组500 ng/L比较,﹟P<0.05。
2.2.2 各组细胞上清液cAMP含量比较 正常对照2组、低糖2组、高糖2组中,1 000 ng/L Gn干预后cAMP含量均高于500、0 ng/L时,500 ng/L Gn干预后cAMP含量均高于0 ng/L时(P均<0.05)。见表2。
表2 不同浓度Gn条件下各组细胞上清液cAMP含量比较
注:与同组0 ng/L比较,*P<0.05;与同组500 ng/L比较,﹟P<0.05。
2.3 细胞上清液cAMP与INS含量的相关性 在未添加ISO时,细胞上清液cAMP与INS含量呈正相关(r=0.897 2,r2=0.804 9,P<0.05);在添加ISO后,细胞上清液cAMP与INS含量也呈正相关(r=0.894 7,r2=0.800 5,P<0.05)。见图1、2。
3 讨论
糖尿病是一种由于INS分泌不足和(或)INS抵抗而引起的代谢性疾病,除INS分泌绝对不足的1型糖尿病外,2型糖尿病患者亦表现为胰岛β细胞INS分泌功能的缺陷。β细胞的INS分泌过程受到各种供能物质及激素、多肽和神经递质类等多种因素的调控[6],其中如Gn、Gn样肽等激素,不直接引起INS分泌,但可通过作用于胰岛β细胞,增加或减少细胞内第二信使信号系统的某些第二信使的浓度,发挥调节INS分泌的作用[7]。以往的研究大都针对如何减少Gn,而Gn对胰岛β细胞INS分泌功能的影响则研究较少。

图1 未添加ISO时细胞上清液中cAMP与INS含量相关性散点图
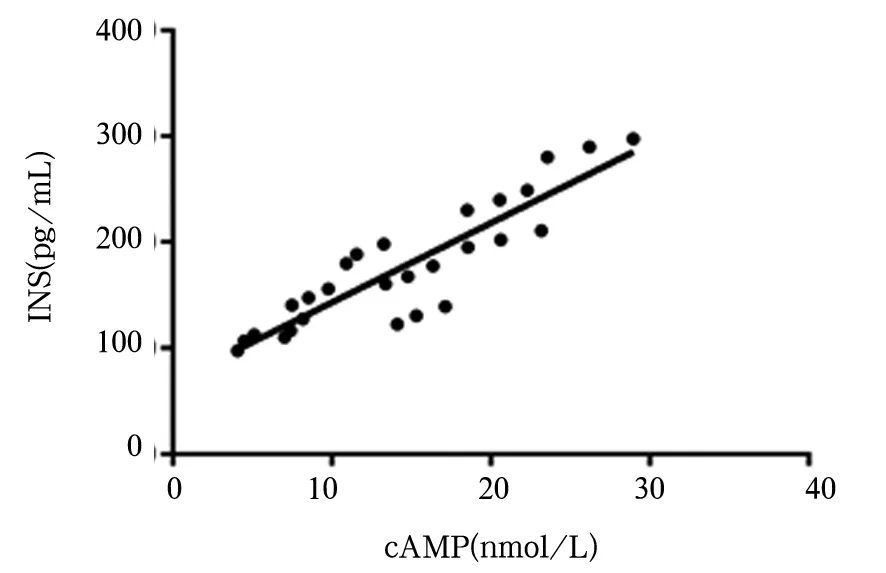
图2 添加ISO后细胞上清液中cAMP与INS含量相关性散点图
本课题组前期研究发现,Gn对INS分泌有促进作用[8]。Gn可能通过旁分泌作用直接到达临近的β细胞,对INS分泌产生调节作用;也可能通过先与细胞膜上的Gn受体结合,引起腺苷酸环化酶活化,从而使ATP环化为cAMP,再通过cAMP-PKA第二信使信号途径实现[9,10]。因此,第二信使信号分子cAMP可能是Gn参与调控INS分泌的桥梁[11,12],但其影响作用的机制和具体环节尚不十分清楚。本研究发现,正常对照1组、低糖1组、高糖1组中,1 000 ng/L Gn干预后INS的分泌量高于500、0 ng/L时,500 ng/L Gn干预后INS的分泌量均高于0 ng/L时;提示Gn干预可促进不同葡萄糖水平的细胞上清液INS含量升高[13],且Gn浓度较高时对INS含量的促进作用更明显;正常对照1组、低糖1组、高糖1组中,1 000 ng/L Gn干预后cAMP含量均高于500、0 ng/L时,500 ng/L Gn干预后cAMP含量均高于0 ng/L时,提示Gn干预可使不同葡萄糖水平的细胞上清液cAMP含量升高,且Gn浓度较高时对cAMP含量的促进作用更明显。cAMP含量与INS分泌量呈正相关关系,提示Gn干预可使不同葡萄糖水平的细胞上清液INS含量升高的机制可能与cAMP有关。
本研究进一步通过添加cAMP刺激剂ISO,测定Gn对第二信使信号通路cAMP产生的影响以及对INS分泌的影响。本研究发现,正常对照2组、低糖2组、高糖2组中,1 000 ng/L Gn干预后INS含量均高于500、0 ng/L时,500 ng/L Gn干预后INS含量均高于0 ng/L时;提示加入ISO后,Gn干预可使不同葡萄糖水平的细胞上清液INS含量升高,且Gn浓度较高时对INS含量的促进作用更明显。正常对照2组、低糖2组、高糖2组中,1 000 ng/L Gn干预后cAMP含量均高于500、0 ng/L时,500 ng/L Gn干预后cAMP含量均高于0 ng/L时;提示加入ISO后,Gn干预可使不同葡萄糖水平的细胞上清液cAMP含量升高,且Gn浓度较高时对cAMP含量的促进作用更明显。cAMP含量与INS分泌量呈正相关关系,提示Gn干预可使不同葡萄糖水平的细胞上清液INS含量升高的机制可能与cAMP有关。
综上所述,Gn可促进不同葡萄糖水平下胰岛β细胞INS的分泌,其浓度较高时对INS促进作用更明显;其机制可能为Gn通过cAMP信号通路促进INS分泌。本研究结果为研究促进INS分泌类的糖尿病治疗药物开发提供了实验室依据,对糖尿病病程的进展与治疗预后等具有重要意义。
:
[1] Butler AE, Janson J, Bonner WS, et al. Beta-cell deficit and increased beta-cell apoptosis in humans with type 2 diabetes[J].Diabetes, 2003,52(1):102-110.
[2] Defronzo RA. Lilly lecture 1987. The triumvirate: beta-cell, muscle, liver. A collusion responsible for NIDDM[J]. Diabetes, 1988, 37(6):667-687.
[3] 李军,李思源,张震,等.胰高血糖素对MIN6细胞胰岛素分泌作用的影响[J].兵团医学,2014,40(2):1-2.
[4] 李思源, 吴媛媛, 李军,等. 胰升血糖素对MIN6细胞增殖活力及胰岛素分泌影响的研究[J]. 中国糖尿病杂志, 2015(7):644-646.
[5] Li SY, Li J, Cao GL, et al. Effect of glucagon on insulin secretion through cAMP signaling pathway in MIN6 cells[J]. Int J Clin Exp Pathol, 2015, 8(5):5974.
[6] Brüning JC, Gautam D, Burks DJ, et al. Role of brain insulin receptor in control of body weight and reproduction[J]. Science, 2000, 289(5487):2122-2125.
[7] Brennesvik EO, Ktori C, Ruzzin J, et al. Adrenaline potentiates insulin-stimulated PKB activation via cAMP and Epac: implications for cross talk between insulin and adrenaline[J]. Cell Signal, 2005, 17(12):1551-1559.
[8] 常子涛, 李思源, 李军,等. 胰升血糖素通过环磷鸟嘌呤核苷信号通路调节MIN6细胞胰岛素分泌的作用机制研究[J].中国糖尿病杂志, 2016, 24(8):742-744.
[9] Klemm DJ, Roesler WJ, Boras T, et al. Insulin stimulates cAMP-response element binding protein activity in HepG2 and 3T3-L1 cell lines[J]. J Biol Chem, 1998, 273(2):917.
[10] Choi YH, Park S, Hockman S, et al. Alterations in regulation of energy homeostasis in cyclic nucleotide phosphodiesterase 3B-null mice[J]. J Biol Chem, 2006, 116(12):3240-3251.
[11] Peschke E, Mühlbauer E. New evidence for a role of melatonin in glucose regulation[J]. Best Pract Res Clin Endocrinol Metab, 2010,24(5):829-841.
[12] Idevallhagren O, Barg S, Gylfe E, et al. cAMP mediators of pulsatile insulin secretion from glucose-stimulated single β-cells[J]. J Biol Chem, 2010, 285(30):23007-23018.
[13] Kanno T, Gpel SO, Rorsman P, et al. Cellular function in multicellular system for hormone-secretion: electrophysiological aspect of studies on α-, β- and δ-cells of the pancreatic islet[J]. Neuro Res, 2002,42(2):79-90.

