不同浓度乙酰胆碱对骨骼肌干细胞增殖、分化的影响
向力,陈绍娟,江淼,袁也,郑飞,王露,张蕾,唐俊明,4(1湖北医药学院基础医学院,湖北十堰 44000;湖北医药学院附属人民医院;3十堰市太和医院;4胚胎干细胞研究湖北省重点实验室)
骨骼肌萎缩是一种常见的生理和病理过程,其机制非常复杂[1]。随着年龄的增长或在病理条件下,骨骼肌会发生损耗和萎缩,骨骼肌干细胞则能以增殖、分化的方式来实现骨骼肌的自我更新和修复[2,3]。近年研究发现,肌肉萎缩可能与交感神经过度兴奋有关[4~6]。交感舒血管神经兴奋时,发挥生物学效应的主要神经递质是乙酰胆碱。但乙酰胆碱是否参与了骨骼肌干细胞增殖、分化过程,从而影响骨骼肌的自我更新或修复,尚不明确。2016年6月~2017年8月,我们采用连续单次给予乙酰胆碱模拟交感神经兴奋后效应,观察乙酰胆碱对骨骼肌干细胞增殖、分化的影响,探讨乙酰胆碱是否通过影响骨骼肌自我更新或修复而参与骨骼肌萎缩过程。
1 材料与方法
1.1 细胞与试剂 小鼠骨骼肌干细胞C2C12细胞系购自中科院上海细胞库。乙酰胆碱购自美国Sigma公司;TRIzol总RNA提取试剂购自Invitrogen公司;DNA反转录试剂盒、BCA蛋白质浓度测定试剂盒购自Thermo公司;配对盒基因7(Pax7)、生肌调节因子(MyoD)、肌细胞生成蛋白(MyoG)、生肌调节因子(MYf5)、GAPDH引物均由南京金斯瑞公司合成;肌球蛋白重链(MYH)(H-300)兔多克隆抗体,MyoG小鼠多克隆抗体,毒蕈碱样乙酰胆碱受体亚型M1、M2、M3山羊多克隆抗体,M4、M5兔多克隆抗体,辣根过氧化物酶(HRP)标记的抗羊二抗,HRP标记的抗小鼠二抗均购自Santa Cruz公司;HRP标记的抗兔二抗,一抗、二抗稀释液、封闭液均购自碧云天生物技术研究所;聚乙烯二氟(PVDF)膜、ECL-Plus发光试剂均购自Millipore公司。
1.2 C2C12细胞的培养、诱导分化 将冻存的C2C12细胞常规复苏,接种于75 cm2的培养皿中,培养条件为10%胎牛血清+高糖DMEM培养基即为增殖培养基,置于37 ℃、5% CO2细胞培养箱中培养。待细胞增殖融合达80%~90%时,按照1∶3的比例传代。传代的C2C12细胞按上述条件继续培养。当细胞融合达到80%时,换用含有2%马血清(HS)的DMEM分化培养基(DM)进行成肌诱导分化,当细胞分化5 d后,在光学显微镜下观察见已经形成典型的肌管,采用免疫荧光法检测成肌细胞分化标志物MYH、MyoG的表达均呈强阳性,表明成肌细胞培养成功。
1.3 C2C12细胞毒蕈碱样乙酰胆碱受体亚型表达检测 ①实时定量PCR法。收集C2C12细胞,按TRIzol法分别提取总RNA,采用1%琼脂糖凝胶电泳检测RNA完整性,行分光光度计检测RNA浓度,并逆转录为cDNA,按SYBR®PremixExⅡ法行实时定量PCR反应,检测毒蕈碱样乙酰胆碱受体M1~M5亚型表达。引物序列:M1受体上游5′-CCTGAG-CTACCGAGCCAAG,下游 5′-CCCAACTAGGTATTGCCAGAAG-3′;M2受体上游5′-GGGACCTGTAGTGTGCGAC-3′,下游5′-GGGTAGGTTAGAGGTTTTGT-GAC-3′;M3受体上游5′-CCTCGCCTTTGTTTCCCAA-C,下游5′-TTGAGGAGAAATTCCCAGAGGT-3′;M4受体上游5′-ATGGCGAACTTCACACCTGTC-3′,下游 5′-CTGTCGCAATGAACACCATCT-3′;M5受体上游5′-TCAACGGCACCCCAGTAAATC-3′,下游5′-GGATGTAGGTCGTGTAGAGGTTC-3′;GAPDH上游5′-ATGACTCCACTCACGGCAAA-3′,下游5′-ATGATGACCCTTTTGGCTCC-3′。以GADPH为内参,使用公式2-ΔΔCt计算mRNA的差异倍数。②Western blotting法。取C2C12细胞,经RIPA裂解、离心收蛋白,行BCA法进行蛋白定量。按分组各上样50 μg 蛋白,经10%SDS-PAGE电泳后,转PVDF膜。用TBST配制的5%的脱脂奶粉低速摇床封闭40 min,分别放入含有α-Tubulin 、M1~M5受体等不同一抗的封闭袋中,4 ℃过夜,将条带放入含有辣根过氧化酶标记的二抗(1∶10 000)孵育液中2 h。最后用化学发光法显色,在BioRad蛋白成像仪成像,用Image J软件测灰度值进行半定量分析。
1.4 乙酰胆碱对C2C12细胞增殖的影响观察
1.4.1 细胞分组及干预方法 C2C12细胞传代后,在增殖培养基中培养至50%融合时,分为对照组、乙酰胆碱1组、乙酰胆碱2组、乙酰胆碱3组、乙酰胆碱4组,分别加入乙酰胆碱0、10-8、10-7、10-6、10-5mol/L,每隔1日换液1次,培养72 h。
1.4.2 细胞增殖情况检测 采用CCK8法。取各组细胞,于37 ℃、5% CO2培养箱中分别培养24、48、72 h后,每孔加入10 μL CCK8,孵育2 h。在全自动酶标仪上检测450 nm光密度值(OD值),评价C2C12细胞增殖情况。
1.4.3 细胞增殖标志基因Pax7表达检测 采用实时定量PCR法,进一步验证乙酰胆碱是否影响C2C12细胞增殖。收集各组细胞,按TRIzol法提取总RNA,采用1%琼脂糖凝胶电泳检测RNA完整性,行分光光度计检测RNA浓度,并逆转录为cDNA,按SYBR®PremixExⅡ法行实时定量PCR反应。引物序列:Pax7上游引物5′-TCTCCAAGATTCTG-TGCCGAT-3′,下游5′-CGGGGTTCTCTCTCTTATACT-CC-3′;GAPDH上游5′-ATGACTCCACTCACGGCAA-A-3′,下游5′-ATGATGACCCTTTTGGCTCC-3′。以GADPH为内参,使用公式2-ΔΔCt计算mRNA的差异倍数。
1.5 乙酰胆碱对C2C12细胞分化的影响观察
1.5.1 细胞分组及干预方法 取用2%HS诱导分化1 d后的C2C12细胞,分为对照2组、乙酰胆碱5组、乙酰胆碱6组、乙酰胆碱7组、乙酰胆碱8组,分别加入乙酰胆碱0、10-8、10-7、10-6、10-5mol/L,每隔1日换液1次,培养5 d。
1.5.2 细胞分化情况检测 采用光学显微镜观察法。取各组细胞,在光学显微镜下观察各组肌管的形成情况。
1.5.3 细胞分化相关基因mRNA表达检测 采用实时定量PCR法。取各组细胞,TRIzol法提取总RNA,采用1%琼脂糖凝胶电泳检测RNA完整性,行分光光度计检测RNA浓度,并逆转录为cDNA,按SYBR®PremixExⅡ法行实时定量PCR反应。引物序列:MyoD上游5′-CCACTCCGGGACATAGACTTG-3′,下游5′-AAAAGCGCAGGTCTGGTGAG-3′;MyoG上游5′-GAGACATCCCCCTATTTCTACCA-3′,下游5′-GCTCAGTCCGCTCATAGCC-3′;Myf5上游5′-GCCTTCGGAGCACACAAAG-3′,下游5′-TGACCTTC-TTCAGGCGTCTAC-3′;GAPDH上游5′-ATGACTCCA-CTCACGGCAAA-3′,下游5′-ATGATGACCCTTTTGGCTCC-3′。以小鼠GADPH为内参,使用公式2-ΔΔCt计算mRNA的差异倍数。
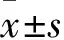
2 结果
2.1 乙酰胆碱M1~M5受体表达比较 M2受体mRNA及蛋白表达均为最高,M3受体mRNA及蛋白表达均为最低(P均<0.05)。见表1。
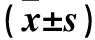
表1 C2C12细胞乙酰胆碱M1~M5受体表达比较
注:与其他受体 mRNA表达比较,*P<0.05。
2.2 各组细胞增殖情况比较 与对照组比较,乙酰胆碱1~4组各时点细胞增殖差异均无统计学意义(P均>0.05)。见表2。
2.3 各组细胞增殖标志基因Pax7表达比较 与对照组比较,乙酰胆碱1~4组Pax7 mRNA 表达差异均无统计学意义(P均>0.05)。见表2。
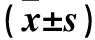
表2 各组细胞增殖及Pax7 mRNA 表达比较
2.4 各组细胞分化情况 光镜下发现,与对照2组相比,乙酰胆碱5组C2C12细胞分化明显,且肌管数目略有增多;乙酰胆碱6~8组C2C12细胞分化呈现减弱趋势,成熟肌管数目减少、分化被抑制,以乙酰胆碱8组分化为成熟肌管数目减少最明显。
2.5 各组细胞分化相关基因表达比较 乙酰胆碱5、6组MyoG mRNA表达均高于对照2组(P均<0.05)。乙酰胆碱7、8组MyoG、MyoD、Myf5 mRNA表达均低于对照2组,且乙酰胆碱8组MyoG、MyoD、Myf5 mRNA表达均低于乙酰胆碱7组(P均<0.05)。见表3。
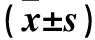
表3 各组MyoG、MyoD、Myf5 mRNA表达比较
注:与对照2组比较,*P<0.05;与其他乙酰胆碱组比较,#P<0.05。
3 讨论
骨骼肌由具有收缩能力的肌细胞组成,约占全身重量的40%,身体的几乎任何活动都是依靠骨骼肌的收缩来完成,骨骼肌的状况直接影响人体的力量和耐力。既往研究认为,肌肉的萎缩与失神经、营养不良、废用以及恶病质有关[7]。在临床实践中发现,心力衰竭、糖尿病患者常伴有交感神经过度兴奋的特征,与此同时伴有骨骼肌萎缩的症状。而骨骼肌的萎缩又进一步恶化心力衰竭患者的运动康复、糖尿病患者骨骼肌对胰岛素的抵抗[8,9]。研究显示,心力衰竭时交感神经过度兴奋将引起骨骼肌的萎缩[9,10]。上述变化均显示一个共同的特征,即交感神经过度兴奋与骨骼肌萎缩有关。但实际上,骨骼肌本身除了受运动神经支配外,骨骼肌血管还受交感舒血管神经支配,其共性是末梢释放的均是乙酰胆碱,但乙酰胆碱在骨骼肌自我更新及损伤修复中的作用及其导致骨骼肌萎缩的机制至今不明。
既往研究更多的乙酰胆碱M1~M5受体在心肌细胞和平滑肌细胞中的作用,而乙酰胆碱M受体在干细胞中的作用仅见零星报道,如发现乙酰胆碱M3受体具有促进干细胞增殖的作用[11,12],而M2受体具有抑制干细胞增殖而促进干细胞分化的作用[13,14]。既往研究显示,增加的cGMP或降低的cAMP有利于干细胞向心肌细胞分化[15]。本研究发现,C2C12细胞M2受体mRNA及蛋白表达均为最高,乙酰胆碱5组C2C12细胞分化明显、有肌管形成,提示较低剂量的乙酰胆碱可促进骨骼肌干细胞的分化;C2C12细胞M3受体mRNA及蛋白表达均为最低,且与对照组比较,乙酰胆碱1~4组各时点细胞增殖及Pax7 mRNA 表达差异均无统计学意义,提示乙酰胆碱对C2C12细胞增殖活性没有明显影响,表明乙酰胆碱没有影响C2C12细胞的增殖活性,可能与M3受体表达水平较低有关。以上结果表明,乙酰胆碱对C2C12细胞的增殖及分化的影响与其M2受体、M3受体有关。
胚胎期特异性的骨骼肌分化主要通过特异性骨骼肌转录因子决定的。其中,MyoD基因家族控制着肌细胞的增殖和分化,与肌纤维的数量、大小有着密切的关系[14]。MyoD基因家族可编码多种不同的转录因子如MyoD、MyoG、Myf5、MRF4等,它们各自或协同控制着骨骼肌生成方面的关键调节因子。而出生后,肌肉的使用程度与特异性的神经支配决定了肌肉收缩性蛋白的组成和更新程度[14,15]。MyoD不仅可使静止期的肌卫星细胞向成肌细胞,而且能把多种类型的细胞转化为成肌细胞,并促使成肌细胞融合、分化为成熟的肌纤维。本课题组前期研究发现,交感神经长期过度兴奋时,表现出抑制骨骼肌卫星细胞分化形成肌小管的能力[6]。本研究发现,乙酰胆碱5、6组MyoG mRNA表达均高于对照2组,提示低浓度的乙酰胆碱更可能主要通过影响MyoG的表达而促进成肌细胞向肌小管分化形成,这与本研究观察到的乙酰胆碱5组细胞分化明显、肌管数目略有增多相吻合。
但在交感舒血管神经兴奋时,乙酰胆碱大量释放所导致的乙酰胆碱浓度升高状态对于骨骼肌干细胞的影响,是否与低浓度乙酰胆碱促进分化的作用效果相同尚不明确。Myf5或MyoD均敲除的小鼠既不能生成骨骼肌,也无成肌细胞群[15]。而MyoG敲除的胚胎鼠具有几乎正常数目的卫星细胞和成肌细胞,但不能向肌细胞分化;提示MyoG位于MyoD或Myf5的下游,在成肌细胞向肌小管分化形成的过程中具有独特的功能。既往研究发现,MyoD可结合MyoG等基因启动区发挥其调节作用,促进它们的转录激活[15]。本研究发现,乙酰胆碱7、8组MyoG、MyoD、Myf5 mRNA表达均低于对照2组,且乙酰胆碱8组MyoG、MyoD、Myf5 mRNA表达均低于乙酰胆碱7组,结合乙酰胆碱6~8组C2C12细胞分化呈现减弱趋势、以乙酰胆碱8组分化为成熟肌管数目减少最明显的结果,考虑高浓度的乙酰胆碱具有强烈的抑制C2C12细胞分化的作用;表明乙酰胆碱大量释放时可明显抑制C2C12细胞的分化,可能与抑制细胞分化相关基因MyoG、MyoD、Myf5的表达有关。可见,交感舒血管神经异常过度兴奋时,其过多释放的乙酰胆碱可抑制骨骼肌干细胞分化,而引起骨骼肌损伤或更新不足,可能是导致骨骼肌萎缩的机制之一。
综上所述,高浓度乙酰胆碱可抑制C2C12细胞分化及其肌管形成,其机制可能与抑制分化相关基因MyoG、MyoD、Myf5的表达有关,可能是交感舒血管神经兴奋释放大量乙酰胆碱后导致骨骼肌萎缩的内在机制之一。
:
[1] Adams CM, Ebert SM, Dyle MC. Role of ATF4 in skeletal muscle atrophy[J]. Curr Opin Clin Nutr Metab Care, 2017, 20(3):164-168.
[2] Powers SK, Lynch GS, Murphy KT, et al. Disease-induced skeletal muscle atrophy and fatigue[J]. Med Sci Sports Exerc, 2016,48(11):2307-2319.
[3] Tieland M, Trouwborst I, Clark BC. Skeletal muscle performance and ageing[J]. J Cachexia Sarcopenia Muscle, 2018,9(1):3-19.
[4] Hyatt JP, Roy RR, Baldwin KM, et al. Nerve activity-independent regulation of skeletal muscle atrophy: role of MyoD and myogenin in satellite cells and myonuclei[J]. Am J Physiol Cell Physiol, 2003,285(5):1161-1173.
[5] Aagaard P, Suetta C, Caserotti P, et al. Role of the nervous system in sarcopenia and muscle atrophy with aging: strength training as a countermeasure[J]. Scand J Med Sci Sports, 2010, 20(1):49-64.
[6] 陈绍娟,向力,江淼,等. 异丙肾上腺素在C2C12细胞分化中的作用及机制[J]. 中国细胞生物学学报,2017,39(9):1178-1187.
[7] Dutt V, Gupta S, Dabur R, et al. Skeletal muscle atrophy: potential therapeutic agents and their mechanisms of action[J]. Pharmacol Res, 2015,99:86-100.
[8] Pelletier R, Hamel F, Beaulieu D, et al. Absence of a differentiation defect in muscle satellite cells from DM2 patients[J]. Neurobiol Dis, 2009,36(1):181-190.
[9 ]Brum PC, Bacurau AV, Cunha TF, et al. Skeletal myopathy in heart failure: Effects of aerobic exercise training[J]. Exp Physiol, 2014,99(4):616-20.
[10] Lymperopoulos A, Rengo G, Koch WJ. Adrenergic nervous system in heart failure: Pathophysiology and therapy[J]. Circ Res, 2013,113(6):739-753.
[11] Fukushima K, Yamazaki K, Miyamoto N, et al. Functional characterization of acetylcholine receptors expressed in human neurons differentiated from hippocampal neural stem/progenitor cells[J]. J Biomol Screen, 2016,21(10):1065-1074.
[12] Tang JM, Yuan J, Li Q, et al. Acetylcholine induces mesenchymal stem cell migration via Ca2+/PKC/ERK1/2 signal pathway[J]. J Cell Biochem, 2012,113(8):2704-2713.
[13] Resende RR, Alves AS, Britto LR, et al. Role of acetylcholine receptors in proliferation and differentiation of P19 embryonal carcinoma cells[J]. Exp Cell Res, 2008,314(7):1429-1443.
[14] 邓玉风, 黄亿元, 尚丽娜,等. 稳定表达Caveolin-3基因突变型P104L和P47L的C2C12骨骼肌细胞株的构建[J].山东医药,2016,56(31):12-15.
[15] Zanou N, GaillyP. Skeletal muscle hypertrophy and regeneration: Interplay between the myogenic regulatory factors (MRFs) and insulin-like growth factors (IGFs) pathways[J]. Cell Mol Life Sci, 2013,70(21):4117-4130.

