EDDS强化Fe0-Al0体系降解废水中4-氯酚的性能和机理
刘 霞,樊金红
EDDS强化Fe0-Al0体系降解废水中4-氯酚的性能和机理
刘 霞,樊金红*
(同济大学,污染控制与资源化研究重点国家重点实验室,上海 200092)
采用乙二胺二琥珀酸(EDDS)强化Fe0-Al0体系还原水溶液中的O2产生H2O2和•OH等活性氧(ROS)的绿色高级氧化工艺,以4-氯酚(4-CP)模拟废水为研究对象,考察了溶液的初始pH值、铁铝的质量比、EDDS投加量和4-CP的初始浓度等因素对4-CP降解的影响.采用电子自旋共振(ESR)法、苯甲酸捕捉法以及4-CP的降解产物等证实了ROS的产生及4-CP的降解机制.结果表明:EDDS强化Fe0-Al0/O2体系对4-CP的去除率随溶液初始pH的升高而降低,但在pH=2.5~9范围内,始终具有较好的4-CP去除率;随Fe0:Al0质量比增加4-CP的去除率先增大后减小,最佳质量比为4:1;随EDDS投加量和4-CP初始浓度增加,4-CP的去除率增大;EDDS可使体系的高级氧化能力提高9倍,在初始pH=2.5、Fe0=8g/L、Al0=2g/L、EDDS=1.5mmol/L条件下,反应3h后100mg/L 4-CP的去除率和脱氯率均达到近100%..
Fe0-Al0/O2体系;活性氧;乙二胺二琥珀酸;Fenton;降解机理
高级氧化技术(Advanced Oxidation Processes, AOPs)是近20年来兴起的水处理新技术,实际上就是一种人工强化产生活性氧(ROS)并利用它氧化去除有机物的工艺.高级氧化过程通常都涉及到H2O2和×OH的生成,诸如O3/H2O2, UV/H2O2,UV/H2O2/O3,TiO2/UV,Fe2+/ H2O2,Fe2+/UV/H2O2等工艺.UV和H2O2的使用显然导致费用增加成为限制高级氧化技术广泛使用的一个瓶颈.
为此,学者们一直在探索摒弃人工添加H2O2而利用环境中的O2生成活性氧ROS(H2O2、×OH)的方法,其中最受青睐的是零价铁法[1].但是,Fe0在有氧条件下的反应伴随着两个对反应不利的过程:(1)OH-的产生导致溶液pH上升,降低了体系的氧化能力,因为Fe0/O2界面H2O2的原位形成和后续的Fenton反应在酸性pH下才有效;(2)铁的氢氧化物沉淀在Fe0表面反应位点累积,导致Fe0表面钝化以及反应活性的逐步丧失.除了常见的Fe0以外,Al0也具有将分子氧活化产生ROS的能力[2],且比Fe0/O2体系更易产生H2O2.然而,Al0/O2体系中生成H2O2后,其类Fenton反应产生·OH的过程较慢,成为Al0/O2体系氧化降解有机污染物的控制反应.因此,有研究者提出双金属Fe0-Al0/O2体系,充分利用Al0/O2体系高效产生H2O2以及Fe0/O2体系连续提供铁源并快速发生类Fenton反应产生·OH的优势,协同强化ROS的原位产生[3-5].但是,研究表明曝气Fe0-Al0降解污染物仍适用于强酸性环境,不能解决Fenton氧化受pH制约的问题.
络合剂在现代工业中有着广泛的应用,研究发现,当溶液中的Fe2+、Fe3+与它形成络合物后, Fe0/O2及Fe2+/O2体系中氧化剂产量有着显著的增加,从而污染物的降解效率得到提高[6-8],与此同时络合剂本身也被氧化降解[9-11].常用的络合剂为草酸、氨三乙酸(NTA)和乙二胺四乙酸(EDTA).乙二胺二琥珀酸(EDDS )具有较强的络合能力,且在自然环境中易被微生物降解,EDDS作为一种环境友好型的络合剂,多用于代替EDTA作为土壤淋洗剂和重金属植物吸收的强化剂[12-15],也可以与过渡金属络合产生H2O2.因此EDDS作为一种环境友好的络合剂有可能代替EDTA用于类Fenton反应体系.
基于以上思路,本文从Fe-络合物的催化特性入手,采用EDDS强化Fe0-Al0/O2绿色高级氧化工艺处理4-CP模拟废水,达到快速产生×OH氧化降解4-CP的目的,考察了溶液的初始pH值、铁和铝的质量比、EDDS投加量和4-CP的初始浓度等因素对4-CP降解的影响,初步分析了H2O2和·OH的原位产生、4-CP的降解机制和EDDS的强化作用,为将来发展一种高效处理其他有机污染物的类Fenton体系提供理论和应用依据.
1 材料和方法
1.1 实验材料
铁粉和铝粉,均为购自国药集团化学试剂有限公司,平均粒径均为100~200目;铁粉纯度>98%;铝粉纯度>99%.因铁粉和铝粉表面有氧化膜,实验前要用1%稀盐酸对其进行预处理.实验所用药品均为分析纯,用水为超纯水.
1.2 试验方法
配制一定浓度的EDDS与目标污染物的混合溶液100mL,放置于敞口的200mL玻璃烧杯中,用1M H2SO4或1M NaOH调节pH后,置于磁力搅拌器上搅拌充氧30min以上,使溶液DO接近饱和状态.倒入称量的金属粉末(Fe0、Al0粉分别精确称取,分别投加)后开始计时.若需要监测pH值和DO,需将pH计和溶氧仪探头洗净擦干后直接放于溶液中实时监测.在一定的时间点取样1mL,用0.45μm滤膜过滤后立即采用高效液相色谱法分析4-CP的降解情况或者测定溶液中的Cl-等.如果实验中取样量较大,如测定DOC、GC-MS测产物等,则需要选择体积为2L的反应烧杯,溶液的体积为1L,其它试剂的投加量保持量纲不变.·OH用苯甲酸捕捉,试验方法与前述类似.所有试验在室温(25℃±2℃)下进行.
1.3 分析方法
1.3.1 HPLC分析法测定4-CP浓度 采用Agilent1260搭配DAD检测器,流动相为65%甲醇和35%超纯水(含体积分数1%的冰醋酸),流速为0.5mL/min,检测器波长278nm,柱温30℃,进样量20μL[15].Agilent高效液相色谱仪配以 ZORBAX Eclipse XDB-C18型色谱柱(4.6mm ×150mm, 5μm).
1.3.2 离子色谱法分析氯离子 采用DIONEX ICS-900离子色谱搭配IonPac® AS23离子交换柱和IonPac® AG23保护柱,流速为1.0mL/min,柱温为24℃,进样量为20μL,抑制电流46mA,等梯度淋洗液为4.5mmol/L Na2CO3和0.8mmol/L NaHCO3的混合液.
1.3.3 气相色谱-质谱联用技术(GC-MS)分析4-CP降解产物 色谱柱:HP-5(30m´0.25mm´0.25mm)毛细管柱;色谱条件:无分流进样,进样时间为2min,进样量为2μL;定性分析:全扫描方式,扫描质量范围:50~300amu.中间产物分析:采用Agilent公司GC-MS鉴定4-CP的中间降解产物.载气流速为1.0mL/min.溶剂延迟时间为7min,使用全扫描模式.柱温的升温程序为:初始温度40℃(停留5min),以20℃/min的温度梯度升至260℃(停留15min),保持20min;进样口温度为260℃.质谱检测器(MSD)以电子轰击模式(EI)运行,离子源温度为230℃,电子能量为70eV[16].
1.3.4 POD-DPD法测定H2O2浓度 取20mL溶液在四氟搅拌子的搅拌下加入3mL缓冲溶液(0.5mol/L NaH2PO4+0.5M Na2HPO4),再依次加入0.5mL DPD与0.5mL POD,10s后用10mm石英比色皿于551nm处比色,所有过程于45±5s内完成[4-5].
1.3.5 ESR法测定×OH 取1mL预先配制好的相应液体,加入50mL的尖底具盖聚乙烯离心管中,置于旋涡混合器中充氧搅拌 30min.向其中投加5mg Fe、5mg Al金属粉末后计时,11mim时向15mL的圆底具盖聚乙烯离心管中加入15μL预先配置好的100μmol/L DMPO捕捉剂待用;13min时用移液枪快速取出90μL的混合液,放置于15mL离心管中,继续置于漩涡混合器上搅拌2min,以使·OH被DMPO尽量捕捉完全.最后,该混合液要在1.5min内,经用0.45μm滤膜过滤后,装入ESR专用的石英毛细管中,上机检测.在整个反应过程中,用空调维持室内温度为25 ℃±1℃.
1.3.6 HPLC分析法对p-HBA的分析 采用Agilent1260搭配DAD检测器,色谱柱为反相的ZORBAX Eclipse XDB-C18柱(4.6mm×150mm,5 μm).流动相为30%甲醇和70%超纯水(含体积分数0.1%的冰醋酸),流速为1.0mL/min,检测器波长255nm,柱温35℃,进样量100μL[17].
2 结果与讨论
2.1 不同体系中4-CP的降解情况
由图1可以明显看出,单纯的Fe0、Al0体系降解效果要比Fe0-Al0双金属体系差,单纯Fe0体系反应8h后4-CP的降解率也只能达到20%,单纯Al0体系中,反应8h后4-CP的降解率能达到50%左右,EDDS的加入可以将Fe0-Al0双金属体系降解4-CP的效果提高约9倍,在其他条件相同的情况下100mg/L的4-CP完全降解只要3h.

图1 不同体系中4-CP的降解
2.2 初始pH值的影响
如前所述,pH值对传统均相Fenton和类Fenton反应的影响很大,因此,研究pH值对EDDS强化Fe0-Al0/O2体系的影响规律,可以评价该体系实际应用的性能.
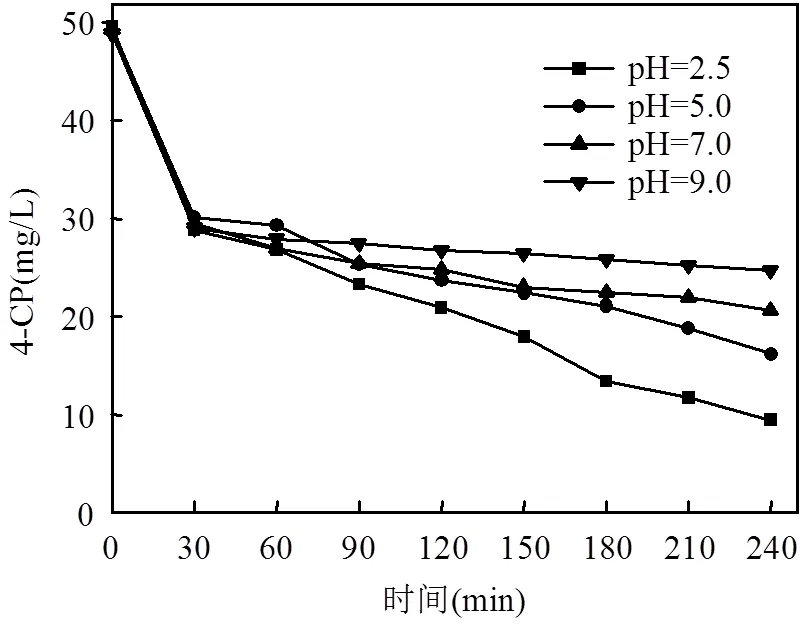
图2 初始pH对4-CP去除效果的影响
由图2可知,溶液不同pH值对4-CP的降解有一定的影响,但在中性和碱性这两个条件下4-CP也有降解,说明EDDS的络合能力较强,能够使双金属体系在较宽的pH值范围内都具有高级氧化作用.
2.3 Fe0与Al0质量比的影响
在反应体系中,活性氧的产生决定了4-CP的降解,活性氧来源于体系中Fe0和Al0还原水溶液的氧气,因此需要对反应体系中的Fe0、Al0质量比进行优化.
由图3可以看出保持Fe0和Al0质量总和为10g/L,反应时间为4h.不同Fe0、Al0质量比条件下,4-CP的降解效果有差异.随着Fe0、Al0质量比的减小4-CP的降解率先增大再减小;逐渐减小Fe0、Al0的质量比,当质量比为4:1时降解效果最好,降解率能达到90%.Fe0、Al0质量比继续减小直到3:2,此过程中4-CP的降解效率在下降.Fe0和Al0在体系中均能产生活性氧,Al0还原氧气产生H2O2的能力要强于Fe0,但Fe0腐蚀生成的Fe2+是Fenton反应的关键因素,因此Fe0要足量.若Fe2+过量,过量的Fe2+则会消耗产生的·OH,也会降低氧化效果.在Fe0、Al0质量比为4:1时,既满足了H2O2的产生量也使得·OH的产量最多.

图3 Fe0和Al0不同质量比对4-CP去除效果的影响
2.4 EDDS投加量的影响
研究发现,EDTA与溶液中Fe2+、Fe3+形成络合物后可显著增加Fe0/O2及Fe2+/O2体系中氧化剂产量,从而提高污染物的降解效率[6-11],原因包括:(1)络合物可提高Fe2+、Fe3+的溶解性,避免Fe2+和Fe3+的共沉降与金属表面的钝化.EDDS为EDTA的同分异构个体,是环境友好型络合剂,可以促进Fenton反应,但本身也是一种易降解的目标污染,因此需要研究EDDS投加量的影响.
由图4可以看出, EDDS的添加大大提高了反应的效率.4-CP的降解效率随着EDDS投加量的增加逐渐增大,当EDDS的投加量为0.1mmol/L时,反应4h后4-CP的降解率只有35%左右,而EDDS投加量在1.5mmol/L以上时,反应4h后4-CP的降解率几乎可以达到90%以上.
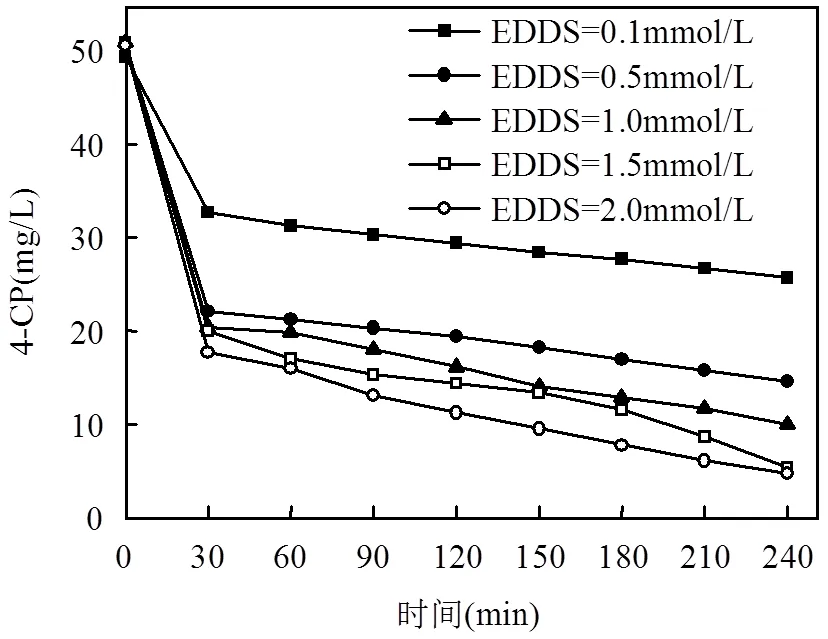
图4 EDDS的投加量对4-CP去除效果的影响
2.5 4-CP初始浓度的影响
选定合适的目标污染物浓度不仅可以得到好的实验结果,对于试验方法的工业应用和推广也有一定的参考意义.由图5可知,4-CP污染物初始浓度越大,其降解速率越快,经过2h反应,100mg/L的4-CP能够完全降解,而50mg/L的4-CP只能降解90%,这是因为当Fe0和Al0反应位充足时,污染物的浓度越大,其反应动力越大.
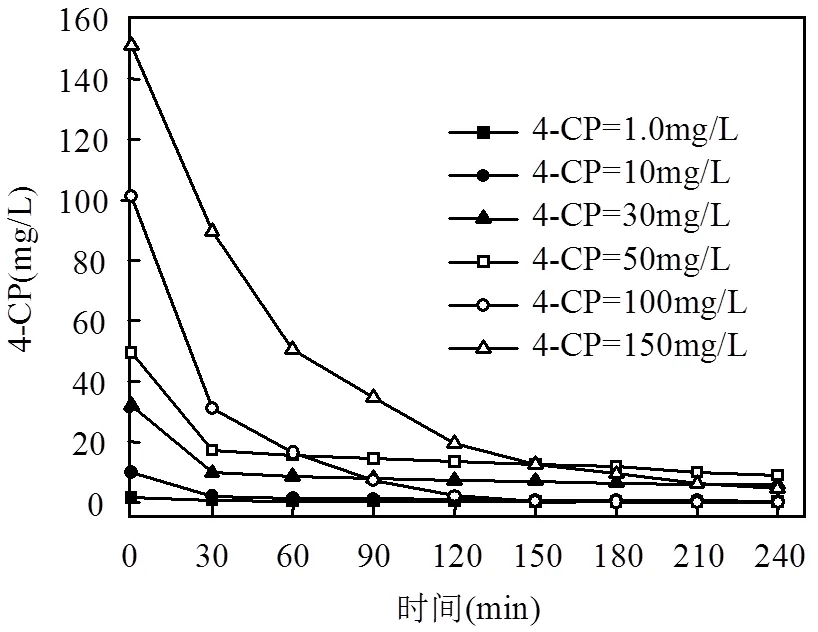
图5 不同初始浓度对4-CP降解的影响
2.6 ROS的原位产生及EDDS的强化作用
由图6可知,Al0/O2体系中生成H2O2后,其类Fenton反应产生·OH的过程较慢,会产生H2O2的累积,Fe0、Fe0-Al0和EDDS强化Fe0-Al0体系中H2O2作为一种活性氧中间体快速转化为×OH而难以捕捉到,但两种双金属体系中均可以观测到×OH的信号,且EDDS的加入使得反应体系中的×OH信号更加强烈(图7).因此,EDDS提高了Fe0-Al0双金属体系的高级氧化能力.

图6 H2O2在不同体系中的生成曲线
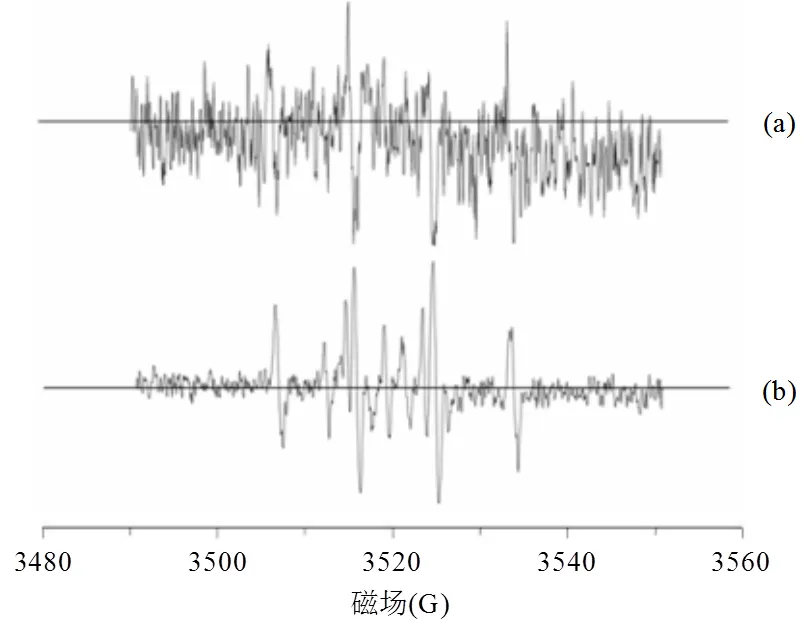
图7 ESR光谱测定EDDS强化Fe0-Al0双金属体系中的×OH
(a): Fe0-Al0; (b) EDDS强化Fe0-Al0
苯甲酸(BA)与·OH反应后生成有机物自由基,进一步被氧化生成羟基化产物:o-HBA、m-HBA和p-HBA,在足量BA存在下,·OH几乎不进一步与羟基化产物发生反应,因此,可以用其中一种羟基化产物p-HBA浓度来反映试验中累计产生的·OH浓度[17],其计算公式为累计产生的[·OH]=5.87×[p-HBA].图8描述了单纯Al0/O2、Fe0/O2、Al0-Fe0/O2和EDDS强化Al0-Fe0/O2四种体系中p-HBA产生量随时间变化,与图1中4-CP的降解效果基本相似.但单纯Fe0体系产生的×OH要多于单纯Al0,证实了前面所述,Al0/O2体系中生成H2O2后,其类Fenton反应产生·OH的过程较慢,成为Al0/O2体系氧化降解有机污染物的控制反应.EDDS的加入显著提高了体系的高级氧化能力.
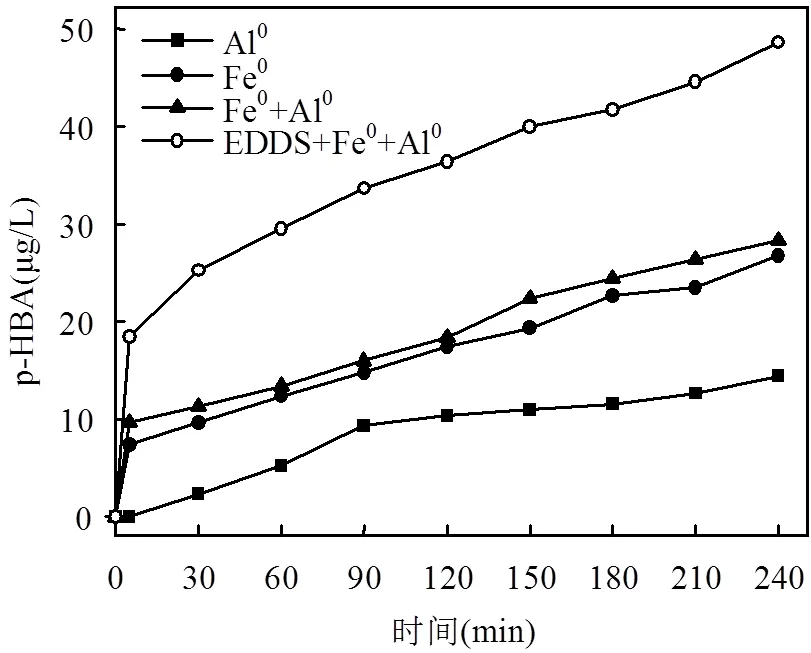
图8 羟基化产物p-HBA在不同体系中的生成曲线尤其是EDDS增强的Fe0-Al0系统
叔丁醇(Tert-butanol, TBA)是一种公认的×OH自由基捕捉剂,其与×OH的KHO×/TBA为3.8×108~7.6×108L/(mol×s),因此,加入TBA后,4- CP降解速率的下降可以间接反应体系中×OH的作用.如图9所示,在EDDS强化体系中加入10mg/L的TBA时4-CP降解率大约减少了30%左右,增加TBA的浓度至20mg/L时,4-CP的降解率又进一步降低了约20%.当加入30mg/L的TBA时4-CP降解率仅15%,说明体系中4-CP的降解主要归因于×OH的高级氧化作用.

图9 EDDS强化Fe0-Al0双金属体系中叔丁醇对4-CP去除的抑制作用
Fan等[4]研究结果表明,EDTA作为络合剂,与反应体系中的Al3+络合不能改变分子氧的活化途径,而与Fe2+络合可以改变反应体系活化分子氧产生ROS的途径.EDDS与EDTA属于同分异构体,在结构上均有两个氨基和四个羧基,其络合作用均来自这两种基团,因此,EDDS强化Fe0-Al0/O2体系产生ROS的机理如下:
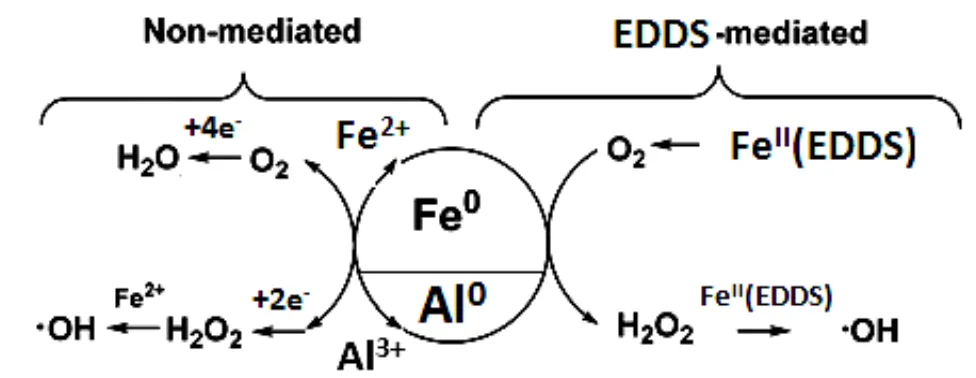
图10 EDDS强化Fe0-Al0分子氧活化示意
综上所述,在Fe0-Al0/O2体系中可以发生O2的二电子还原产生H2O2的反应,但Fe0和Al0的反应仍以吸氧腐蚀最终还原为H2O的反应为主,所以体系的氧化能力较低.当体系中加入EDDS后,EDDS与Al3+的络合物不能改变分子氧的还原途径,而FeII(EDDS)可以提高分子氧二电子还原为H2O2的能力;另外EDDS还能络合Fe3+,能够防止Fe3+生成Fe(OH)3沉淀累积在Fe0表面,使得界面反应能够顺利进行.
2.7 4-CP的降解动力学与途径
对污染物降解的动力学研究,国内外经常利用准一级动力学方程进行线性拟合,即将污染物浓度取对数后,对反应时间进行线性回归,如图11所示,4-CP在EDDS强化Fe0-Al0/O2反应体系中的降解遵循准一级反应动力学,最优条件下,其反应速率常数为0.0332min-1.相较于类Fenton体系 (Fe3O4/H2O2)中4-CP的反应动力学常数的单位至少为day-1,以及传统Fenton体系(Fe2+/H2O2)中4-CP的反应动力学常数一般为0.3~0.5min-1左右[18],本体系可以通过还原水溶液中溶解氧原位产生H2O2和×OH,实现4-氯酚的氧化降解,其对4-氯酚的降解速率约为Fe@Fe2O3纳米线―O2降解速率的10倍左右,与外加超声能量反应体系US/Fe/EDDS –O2降解4-氯酚的反应速率常数为同一数量级.

图11 4-CP的降解动力学拟合
4-CP的毒性主要来源于它的氯代原子,因此也对EDDS强化体系的脱氯能力进行了分析.由图12可以看到4-CP是逐渐释放Cl-的,在溶液中能检测到的C1-有16.636mg/L.将所有Al-Fe金属粉末在系统内反应4h后,溶解于4mol/L H2SO4,最终可以测到27.35mg/L C1-(占理论C1元素的质量的99.02%).因此,在反应体系中C1-能被完全脱除.

表1 Fe0-Al0-EDDS体系与文献中相似催化剂对有机污染物降解情况的比较

图12 4-CP的脱氯
根据Liu等[20]的研究结果,4-CP在曝气Al-Fe双金属体系内的降解应当走4-氯代邻苯二酚路径,而在EDTA强化反应体系中4-CP的降解过程包含邻苯二酚和卤代邻苯二酚两种路径.而EDDS作为EDTA的同分异构体,其强化反应体系中4-CP的降解究竟遵循什么路径?本节主要检测了4-CP的可能降解产物:对苯二酚(hydroquinone)和4-氯代邻苯二酚(4- chlorocatechol),以此确定EDDS强化Fe0-Al0/O2反应体系中4-CP的氧化降解,结果如图13所示.
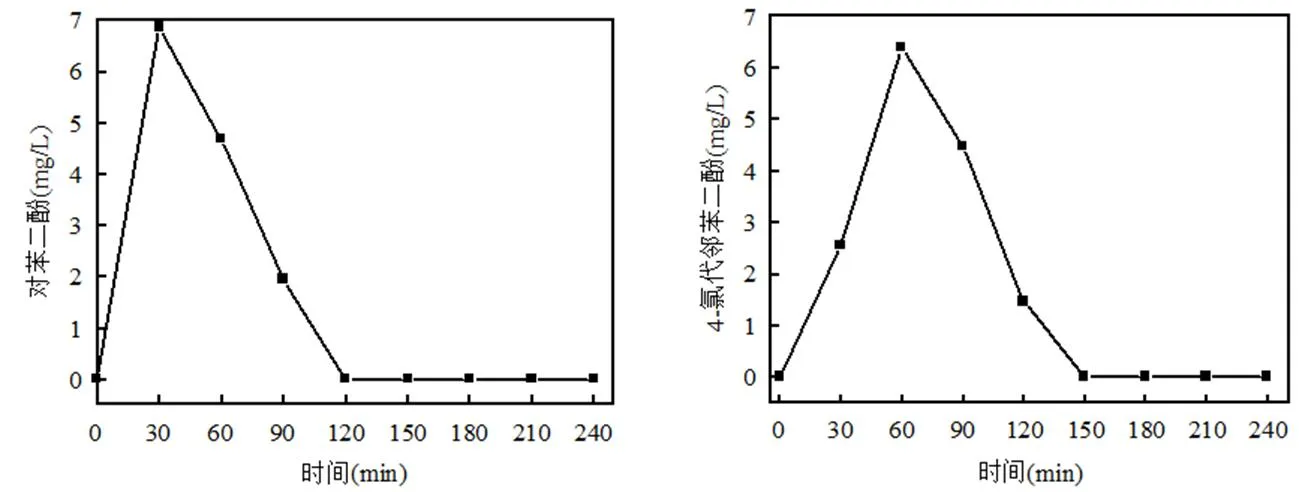
图13 反应过程中对苯二酚和4-氯代邻苯二酚的变化
在反应过程中对苯二酚和4-氯代邻苯二酚均检测到.对二苯酚在反应30min时浓度约7mg/L而后逐渐减少直至消失,如图11所示.然而,4-氯代邻苯二酚浓度在反应开始半小时后快速增加,到60min时到达最大值约为6.5mg/L,而后逐渐消失,见图13.则这两种物质均为为中间产物,因此可以断定,在EDDS强化Fe0-Al0/O2反应体系中,4-CP的降解也符合氧化降解的经典路径.
3 结论
3.1 与传统的Fenton反应不同,EDDS强化Fe0-Al0双金属体系在pH值2.5~9.0范围内都有高级氧化作用,最优条件下可使体系对4-CP的降解速率提高9倍.
3.2 随Fe0:Al0质量比增加4-CP的去除率先增大后减小,最佳质量比为4:1;随EDDS投加量和4-CP初始浓度增加,4-CP的去除率增大;在初始pH=2.5、Fe0=8g/L、Al0=2g/L、EDDS=1.5mmol/L条件下100mg/L 4-CP反应3h后几乎能够全部降解,其表观一级反应动力学常数为0.0332min-1.
3.3 常温常压下,EDDS能与Fe2+络合进一步促进Fe0的腐蚀生成Fe2+从而促进体系中自发产生H2O2,继而产生×OH,实现4-CP的氧化去除,Cl-能全部被脱除.
[1] Ma L M, Zhang W X. Enhanced biological treatment of industrial wastewater with bimetallic zero-valent iron [J]. Environ. Sci. Technol., 2008,42(15):5384-5389.
[2] Bokare A D, Choi W. Zero-valent aluminum for oxidative degradation of aqueous organic pollutants [J]. Environ. Sci. Technol., 2009,43(18):7130-7135.
[3] Liu X, Fan J H, Ma L M. Elimination of 4-chlorophenol in aqueous solution by the bimetallic Al–Fe/O2at normal temperature and pressure [J]. Chemical Engineering Journal, 2014, 236:274-284.
[4] Fan J H, Liu X, Ma L M. EDTA enhanced degradation of 4- bromophenol by Al0–Fe0–O2system, Chemical Engineering Journal, 2015,263:71–82.
[5] Fan J H, Wang H W, Ma L M. Oxalate-assisted oxidative degradation of 4-chlorophenol in a bimetallic, zero-valent iron– aluminum/air/water system [J]. Environmental Science and Pollution Research, 2016,23(16):16686-16698.
[6] Feitz A J, Joo S H, Guan J, et al. Oxidative transformation of contaminants using colloidal zero-valent iron [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2005, 265(1):88-94.
[7] Keenan C R, Sedlak D L. Ligand-enhanced reactive oxidant generation by nanoparticulate zero-valent iron and oxygen [J]. Environ. Sci. Technol., 2008,42(18):6936-6941.
[8] Noradoun C, Engelmann M D, McLaughlin M, et al. Destruction of chlorinated phenols by dioxygen activation under aqueous room temperature and pressure conditions [J]. Industrial & Engineering Chemistry Research, 2003,42(21):5024-5030.
[9] Zhou T, Lim T T, Li Y, et al. The role and fate of EDTA in ultrasound-enhanced zero-valent iron/air system [J]. Chemosphere, 2010,78(5):576-582.
[10] Zhou T, Lu X, Wang J, et al. Rapid decolorization and mineralization of simulated textile wastewater in a heterogeneous Fenton like system with/without external energy [J]. Journal of hazardous materials, 2009,165(1):193-199.
[11] Englehardt J D, Meeroff D E, Echegoyen L, et al. Oxidation of aqueous EDTA and associated organics and coprecipitation of inorganics by ambient iron-mediated aeration [J]. Environmental science & technology, 2007,41(1):270-276.
[12] Rivero-Huguet M, Marshall W D. Scaling up a treatment to simultaneously remove persistent organic pollutants and heavy metals from contaminated soils [J]. Chemosphere, 2011,83(5):668-673.
[13] Yan D, Lo I. Enhanced multi-metal extraction with EDDS of deficient and excess dosages under the influence of dissolved and soil organic matter [J]. Environmental Pollution, 2011,159(1):78-83.
[14] Salati S, Quadri G, Tambone F, et al. Fresh organic matter of municipal solid waste enhances phytoextraction of heavy metals from contaminated soil [J]. Environmental Pollution, 2010, 158(5):1899-1906.
[15] Zhou T, Li Y, Ji J, et al. Oxidation of 4-chlorophenol in a heterogeneous zero valent iron/ H2O2Fenton-like system: Kinetic, pathway and effect factors [J]. Separation and Purification Technology, 2008,62(3):551-558.
[16] Zhao J, Zhang Y, Quan X, et al. Enhanced oxidation of 4-chlorophenol using sulfate radicals generated from zero-valent iron and peroxydisulfate at ambient temperature [J]. Separation and Purification Technology, 2010,71(3):302-307.
[17] Pang S Y, Jiang J, Ma J. Oxidation of sulfoxides and arsenic (III) in corrosion of nanoscale zero valent iron by oxygen: evidence against ferryl ions (Fe (IV)) as active intermediates in Fenton reaction [J]. Environmental Science and Technology, 2010,45(1):307-312.
[18] 周 涛.氯酚类物质在零价铁强化还原/氧化体系中的降解研究[D]. 武汉:华中科技大学, 2008:68-284.
[19] Ai Z H, Gao Z T, Zhang L Z, et al. Core–Shell Structure Dependent Reactivity of Fe@Fe2O3Nanowires on Aerobic Degradation of 4-Chlorophenol [J]. Environmental science and technology, 2013,47(10):5344-5352.
Enhanced bimetallic Fe0-Al0/O2system by EDDS for degradation of aqueous 4-CP.
LIU Xia, FAN jin-hong*
(State Key Laboratory of Pollution Control and Resource Reuse,Tongji University, Shanghai 200092, China)., 2018,38(5):1704~1711
The green advanced oxidation process of Fe0-Al0/O2enhanced by ethylenediamine disuccinic acid (EDDS) was applied to generating reactive oxygen species (ROS) of H2O2and×OH by the O2spontaneous reduction at normal temperature and pressure. The simulated 4-CP wastewater was degraded in this study. The effects of the initial pH, the mass ratio of Fe0to Al0, the EDDS dosage and initial 4-CP concentration were investigated in the process. The insitu -generation of H2O2and×OH as well as the oxidative mechanism of 4-CP degradation were proved by electron spin resonance (ESR), benzoic capturing, oxygen stripping and 4-CP degradation products. The results show that 4-CP degradation efficiency in the Fe0-Al0/O2system enhanced by EDDS decreases with the initial pH increasing and remains pleasurable in the pH range of 2.5~9. With the mass ratio of Fe0and Al0increasing, the removal rate of 4-CP increases first and then decreases, and the best mass ratio of Fe0to Al0was 4:1. The removal rate of 4-CP increases with EDDS dosage and the initial 4-CP concentration. EDDS was found to have improved 4-CP removal rate by 9times. The complete 4-CP removal and dechlorination were achieved within 3h at nitial pH of 2.5, EDDS dosage of 1.5mmol/L, Fe0:Al0(:) of 4:1and initial 4-CP concentration of 4-CP of 100mg/L.
Fe0-Al0/O2system; Reactive oxygen species (ROS);EDDS;Fenton;Degradation mechanisms
X703
A
1000-6923(2018)05-1704-08
2017-10-09
上海市自然科学基金(18ZR1440800)
* 责任作者, 副教授, jinhongfan@tongji.edu.cn
刘 霞(1971-),女,江西南昌人,高级工程师,博士,主要从事水污染控制研究.发表论文10余篇.

