一种具有磁光性能的潜在药物载体的研制
赵宏鑫,王俊峰,3,4*
(1.中国科学院 合肥物质科学研究院 强磁场科学中心,安徽 合肥 230031;2.中国科学技术大学,安徽 合肥 230036;3.中国科学院 强磁场与离子束物理生物学重点实验室, 安徽 合肥 230031; 4.安徽大学 物质科学与信息技术研究院, 安徽 合肥 230601)
磁小体形成于趋磁细菌细胞内,多数为单磁畴纳米级晶体铁磁颗粒Fe3O4,少数为Fe3S4所组成[1].由于磁小体在趋磁细菌体内成链状排列从而赋予趋磁细菌一定的磁偶极距[2],使得趋磁细菌能够响应磁场,沿着地磁场或外加磁场进行运动[3-4].此外,磁小体颗粒由一层生物膜包裹,可防止磁性颗粒的集聚.与化学合成的磁性纳米颗粒相比,磁小体不但具有低毒性的特点,还具有更好的生物兼容性[5-6].正因为磁小体具有这种天然的物理磁性以及生物特性,使得磁小体在生物医学领域得到广泛的应用.Himmelreich等[7]成功地将磁小体颗粒转入体内并利用其制作成了造影剂;Xiang及更多的研究学者[6, 8-9]利用磁小体表面含有的多种活性基团,用化学交联剂把包括抗体、小分子药物、酶、DNA分子等在内的生物活性物质修饰到磁小体颗粒上,用于免疫学检测、肿瘤治疗、细胞分离、疾病相关单核苷酸多态性分析及mRNA分析等研究;Alphandery等[8-9]则把磁小体转入癌细胞内,利用交变磁场使磁小体放热,使得局部温度升高从而杀死肿瘤细胞.
CdTe/CdS 量子点(QDs)因其具有极高的量子效率和粒子大小可调的光学性质而成为一种备受关注的近红外(NIR)成像探针,相比传统有机荧光染料,具有许多优异的光学性能,如激发波长范围宽、发射波长范围窄且对称、寿命长、光学性能稳定等,尤其由于近红外光在组织内具有很强的穿透能力,使得该探针可用于深层组织的成像[10-11].
笔者拟利用点击化学反应将CdTe/CdS量子点共价修饰到磁小磁上,研制出磁光载体,使载体兼具磁小体的磁性和量子点的发光性双重特性,并将磁光载体转入HepG2细胞内,初步实现磁光载体的细胞示踪.此项研究将为后续的磁靶向给药,磁靶向热疗及光示踪一体化的研究及应用提供实验基础和理论依据.
1 实验方法
1.1 主要的试剂与仪器
趋磁细菌AMB-1(ATCC 700264)购于ATCC菌株保藏中心,人肝癌细胞系HepG2细胞由笔者实验室保存,量子点由中国科学技术大学梁高林教授提供.
趋磁细菌培养基:MSGM培养基(ATCC 1653);HepG2细胞培养基:DMEM培养基,Hycolon;N-羟基琥珀酰亚胺(NHS)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC),Sigma公司.
JY96-IIN超声波细胞破碎仪,宁波新芝;JEM-2100 高分辨透射电子显微镜(TEM),日本岛津;LEICA DMI4000B荧光倒置显微镜,德国莱卡.
1.2 趋磁细菌的培养及收集
将1 mL冻存于-80 ℃的趋磁细菌AMB-1菌株接种至10 mL MSGM培养基中,30 ℃静置培养复苏细菌.当培养5 d后细菌浓度达到OD600=0.3~0.4时将菌体转接到300 mL培养基中,静置培养4~6 d,待细菌浓度达到OD600=0.3~0.4时按照1∶10的比例进行扩大培养.为了收集细胞,将磁场强度为0.3 T的永磁铁固定到培养瓶的外壁上,静置放置2 h,待培养瓶内壁上聚集大量的趋磁细菌时,去上清,将收集到的趋磁细菌用去离子水重悬,并取出10 μL进行TEM 表征实验.
1.3 磁小体的分离提取
取出10 g冻存的趋磁细菌,重悬于100 mL缓冲液(20 mM PBS 100 mM NaCl pH 7.2)中,使用超声破碎的方法裂解细菌,超声功率为30%,开2 s,关3 s分别进行10 min和20 min超声.根据磁小体的特性将永磁铁固定在烧杯外表面,吸附分离出的磁小体30 min,缓慢倒掉上清液,再用50 mL PBS 缓冲液重新悬浮磁小体,反复清洗—磁吸附5次,去除残留的细胞碎片,得到高纯度的磁小体,最后将磁小体溶于缓冲液(20 mM PBS 100 mM NaCl pH 6.5)中使其浓度达到10 mg·mL-1,取出2 μL稀释到10 μL进行TEM 表征实验.
1.4 磁小体的量子点修饰
取10 mg量子点溶于1 mL 缓冲液(20 mM PBS 100 mM NaCl pH 6.5)中,加入NHS和EDC各11 μmol 反应30 min后,将反应物混合物加至1 mL的磁小体中继续反应1 h.反应完成后用永磁铁吸附磁小体.并用去离子水反复清洗—磁吸附5次,最后用1 mL的缓冲液(20 mM PBS 100 mM NaCl pH 7.2)20 mM PBS重悬磁光载体.
1.5 细胞培养及磁小体转入细胞
取HepG2细胞接种于10 mL DMEM细胞培养基(含10%血清)中,放置于CO2细胞培养箱中(37 ℃,5% CO2)培养24 h后,用胰蛋白酶消化细胞并进行细胞计数,按照5×105个/孔将细胞接种至6孔细胞培养板中,培养24 h后每孔中加入10 μL磁光载体,并分别在孵育1,2,3,4,5 h 后用PBS缓冲液反复清洗细胞3次,然后在荧光显微镜下观测转染情况.
2 结果与讨论
2.1 趋磁细菌的磁吸附收集与表征
趋磁细菌由于形成磁小体可被永磁体所吸附,图1A显示经过永磁铁吸附之后,培养瓶内壁上有趋磁细菌聚集,表明磁吸附的方法能有效地分离收集富含磁小体的趋磁细菌.TEM对收集的趋磁细菌进行表征,发现在趋磁细菌体内有成链状排列的磁小体,如图1B所示,这与前人报道一致[12],表明成功地培养并收集了具有磁小体的趋磁细菌.

A:用0.3T的永磁体吸附趋磁细菌2h;B:TEM表征磁吸附收集的富含磁小体的趋磁细菌.图1 磁铁吸附趋磁细菌及趋磁细菌的TEM表征
2.2 磁小体的纯化
磁小体链的长度对于后续的细胞转染实验非常重要.如果磁小体链太长不易转染;若太短则在细胞内不稳定,也不能产生足够大的磁矩用于后续实验;一般认为5~10个磁小体的链是最合适的,兼顾了稳定性和后续的磁热疗作用的要求[9].实验中分别运用10 min和20 min超声时间来破碎菌体,提取磁小体链,并用TEM对其进行表征,结果如图2所示,当超声破碎10 min时,大部分的磁小体链的长度超过10个磁小体(图2A),当超声时间为20 min时产生的磁小体链的长度则为5~10个(图2B).因此后续实验选择20 min的超声破碎时间.
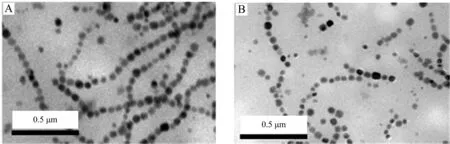
A:超声破碎10 min;B:超声破碎20 min.图2 TEM表征提取的磁小体
2.3 磁光载体的构建
利用共价结合的方法将量子点修饰至磁小体表面构建磁光载体,图3A为磁光载体合成示意图.通过反复清洗—磁吸附方法去除没有连接到磁小体表面的量子点,得到的磁光载体样品在透射电镜下进行观察,能够清晰地看到5 nm左右的量子点的存在,表明已成功地将量子点与磁小体结合在一起,完成了磁光载体的制备,结果如图3B所示.
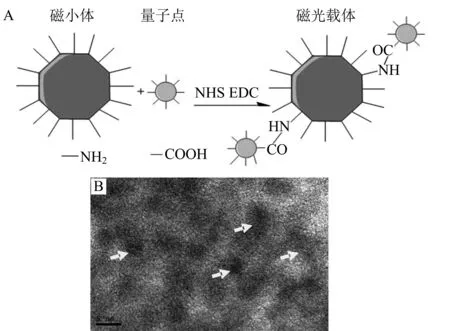
A:TEM表征磁光载体; B:箭头标记量子点.图3 磁光载体制备示意图
2.4 磁光载体的细胞成像实验
将磁光载体与细胞共孵育时,磁光载体可以通过胞吞作用进入细胞.用PBS溶液洗涤细胞以除去未进入细胞的磁光载体.利用量子点的荧光特性,在荧光显微镜下观察磁光载体进入细胞的效率,将磁光载体和HepG2细胞共孵育,在不同的孵育时间(1,2,3,4,5 h)均可观察到磁光载体不同程度地进入细胞中,其中孵育3 h时转染效率达到100%,如图4所示.

A:孵育后的细胞在荧光下的显微图像;B:孵育后的细胞在明场下的显微图像;C:荧光成像与明场成像的叠加图.图4 HepG2细胞加入磁光载体孵育3 h后的显微图
图4显示,由量子点发出红色的荧光(图4A)与明场视野下的细胞形态(图4B)能很好地相重叠(图4C),表明磁光载体已成功转入细胞内,同时也验证了可以利用量子点的光学性质对磁光载体进行光示踪.
3 结束语
磁靶向热疗是近年来靶向给药系统研究的热点,磁小体可在磁场的调控下靶向至肿瘤组织,同时在交变磁场下能够产生足够的热量,从而有效杀死肿瘤细胞.因此肿瘤的磁小体给药治疗及磁热疗日益受到广泛的关注.量子点具有良好的生物兼容性、无毒性,其受激发后发出的近红外光具有有效穿透组织达到实时定位的作用.笔者用带有羧基的CdTe/CdS量子点作为修饰材料,对趋磁细菌 AMB-1天然合成的具有生物膜包被的磁小体进行修饰,得到同时具有光磁特性的磁光载体.将磁光载体与HepG2细胞进行共培养转染,荧光显微观察表明可以利用量子点的光学性质对磁光载体进行光定位.期望该研究结果能为将来的肿瘤及癌症的治疗提供有利的实验基础,对将来的应用研究具有一定的意义.
参考文献:
[1] LOWER B H, BAZYLINSKI D A. The bacterial magnetosome: a unique prokaryotic organelle[J]. J Mol Microbiol Biotechnol, 2013, 23 (1/2): 63-80.
[2] SCHULER D. Genetics and cell biology of magnetosome formation in magnetotactic bacteria[J]. FEMS Microbiol Rev, 2008, 32 (4): 654-672.
[3] BLAKEMORE R. Magnetotactic bacteria[J]. Science, 1975, 190 (4212): 377-379.
[4] BARBER-ZUCKER S, ZARIVACH R. A look into the biochemistry of magnetosome biosynthesis in magnetotactic bacteria[J]. ACS Chem Biol, 2017, 12 (1): 13-22.
[5] KORNIG A, DONG J, BENNET M, et al. Probing the mechanical properties of magnetosome chains in living magnetotactic bacteria[J]. Nano Lett, 2014, 14 (8): 4653-4659.
[6] XIANG Z, YANG X, XU J, et al. Tumor detection using magnetosome nanoparticles functionalized with a newly screened EGFR/HER2 targeting peptide[J]. Biomaterials, 2017, 115: 53-64.
[7] HIMMELREICH U, HOEHN M. Stem cell labeling for magnetic resonance imaging[J]. Minimally Invasive Therapy & Allied Technologies, 2008, 17 (2): 132-142.
[8] ALPHANDERY E, CARVALLO C, MENGUY N, et al. Chains of cobalt doped magnetosomes extracted from AMB-1 magnetotactic bacteria for application in alternative magnetic field cancer therapy[J]. Journal of Physical Chemistry C, 2011, 115 (24): 11920-11924.
[9] ALPHANDERY E, FAURE S, SEKSEK O, et al. Chains of magnetosomes extracted from AMB-1 magnetotactic bacteria for application in alternative magnetic field cancer therapy[J]. Acs Nano, 2011, 5 (8): 6279-6296.
[10] YUAN Y, ZHANG J, AN L N, et al. Oligomeric nanoparticles functionalized with NIR-emitting CdTe/CdS QDs and folate for tumor-targeted imaging[J]. Biomaterials, 2014, 35 (27): 7881-7886.
[11] 毕红, 余乐乐, 宋梦梦. 无机纳米载体在靶向药物输送中的应用研究进展[J]. 安徽大学学报 (自然科学版), 2011, 35 (3): 1-8.
[12] FUKUMORI Y, TAOKA A. Magnetotactic bacteria’s organella, magnetosome-localization, and cytoskeleton[J]. Tanpakushitsu Kakusan Koso, 2008, 53 (13): 1746-1751.

