小麦-豆粕型饲粮添加复合酶制剂对肉鸡肠道微生物菌群和酸度的影响
谭子超,刘浩民,薛 梅,宋玉芹,王述柏*
(1.青岛农业大学动物科技学院,山东青岛 266109;2.山东省海阳市畜牧兽医站,山东海阳265100)
饲用酶制剂不仅会促进机体对营养物质的消化吸收,而且会影响肠道微生物的发育 (任文等,2017;NIBA 等,2009)。 周小娟等(2013)研究发现AA肉鸡饲粮中添加复合酶可明显降低盲肠大肠杆菌数量,提高乳酸杆菌数量。Choct等(2004)研究报道,小麦日粮添加木聚糖酶使鸡肠道食糜黏度下降,微生物区系改变。由肠道菌群构建的生物屏障可对外界及机体内的病原微生物产生定植抗力,防止其侵入机体,保持健康(甄建华等,2017)。多年来饲用酶制剂研究主要集中在对动物生长性能以及营养物质消化率的影响,而对肠道微生物区系的影响及其相关作用机制的研究相对较少 (任文等,2017)。本试验研究了肉鸡小麦-豆粕型饲粮添加不同水平复合酶制剂对肉鸡胃肠道微生物菌群和食糜酸度的影响,从而为其在肉鸡小麦型饲粮中的合理应用提供参考依据。
1 材料与方法
1.1 试验材料与动物 4种单酶制剂按复合酶酶谱剂量均匀混合,复合酶酶谱:木聚糖酶(850 U/g)、纤维素酶(750 U/g)、β-葡聚糖酶(50 U/g)、植酸酶(2000 U/kg)(薛梅等,2015)。
1.2 试验设计 将1日龄健康AA肉鸡720只(体重40 g左右)随机分为 6组(120只/组),每组设6个重复(20只/重复),1组(对照组)饲喂基础饲粮,2~6组分别在基础饲粮中添加 1000、1500、2000、2500、3 000 mg/kg 复合酶制剂。 试验分1~21 d和22~42 d两个阶段。基础饲粮参照AA肉鸡营养标准配制(表1)。

表1 基础饲粮组成及营养水平(风干基础)
1.3 试验鸡的饲养管理 试验鸡采用三层半阶梯式笼养,自由采食、饮水,按照白羽肉鸡常规饲养管理规程饲养于同栋鸡舍。
1.4 肠道不同部位内容物微生物检测 样品采集与处理:在试验第21天和42天,从每个重复中选择接近平均体重的肉鸡1只,颈部放血处死,迅速打开腹腔,分别结扎十二指肠、空肠、回肠和盲肠两端,取下十二指肠、空肠、回肠和盲肠后,立即放入-20℃冰箱中保存。取低温保存的十二指肠、空肠、回肠和盲肠自然解冻,在超净工作台中取内容物,充分混匀后取0.5 g,加入到盛有4.5 mL灭菌生理盐水的离心管中,用微型振荡器振荡10 min,此液为10-1倍稀释液,离心后吸取上清液0.5 mL,加入盛有4.5 mL灭菌生理盐水的另一只离心管中进行10-2倍稀释,依次稀释到10-7倍。
细菌培养:取稀释液进行细菌培养,乳酸杆菌采用乳酸杆菌选择性培养基(LBS)37℃厌氧培养48 h、双歧杆菌采用双歧杆菌培养基(BS)37℃厌氧培养48 h、大肠杆菌采用麦康凯培养基37℃有氧培养24 h、总需氧菌采用营养琼脂培养基37℃有氧培养24 h、总厌氧菌采用Schaedler厌氧菌琼脂培养基37℃厌氧培养48 h。每个稀释度做3个重复。
菌落计数:选择最适宜的稀释梯度 (以0~300个菌落为宜),对细菌进行平板菌落计数,每个样品取3个重复平均值,并计算每克肠道内容物所含的细菌数。结果以每克内容物中菌落数的常用对数表示(lg cfu/g)。
1.5 消化道不同部位食糜酸度检测 在试验第21天和第42天,从每个重复中选择接近平均体重的肉鸡1只,颈部放血处死,迅速打开腹腔,取出嗉囊、腺胃、肌胃、小肠(十二指肠、空肠、回肠)和盲肠食糜,立即用testo 205型pH计测其pH。
1.6 数据统计与处理 数据采用Excel 2007进行初步整理,采用SPSS 17.0进行ANOVO方差分析、Duncan法进行组间多重比较。结果表示为“平均值±标准差”。
2 结果与分析
2.1 不同水平复合酶制剂对肉鸡肠道不同部位大肠杆菌数量的影响 21 d和42 d肉鸡肠道各部位大肠杆菌数量随复合酶制剂添加水平的增加呈不同程度下降趋势(表2)。十二指肠和空肠内容物大肠杆菌数量各组间均差异不显著 (P>0.05);21 d肉鸡回肠内容物大肠杆菌数量,4~6组分别较 1组降低 0.94%、1.10%、1.41%(P<0.05)。42 d肉鸡回肠内容物大肠杆菌数量,3~6组分别较 1组降低 1.03%(P<0.05)、1.33%(P<0.05)、1.62%(P < 0.01)、1.77%(P < 0.01);4 ~ 6组盲肠内容物大肠杆菌数量分别较1组降低0.83% (P < 0.05)、1.11%(P < 0.01)、1.11% (P <0.01)。各组鸡肠道大肠杆菌数量存在部位的明显差异,肠道前段至后段数量逐渐增多。
2.2 不同水平复合酶制剂对肉鸡肠道不同部位乳酸杆菌数量的影响 21 d和42 d肉鸡肠道不同部位内容物乳酸杆菌数量,2~6组均不同程度高于1组(表3)。21 d肉鸡肠道不同部位内容物乳酸杆菌数量,4~6组空肠分别较1组升高2.18%、2.47%、3.20%(P<0.05),2~6组盲肠分别较 1组升高 2.06%、3.22%、3.60%、3.47%、3.60%(P<0.05)。42 d肉鸡肠道不同部位内容物乳酸杆菌数量,4~6组十二指肠分别较1组升高0.94%(P < 0.05)、1.34% (P < 0.01)、1.34% (P <0.01);4~6组空肠分别较 1组升高 1.59%(P<0.05)、1.74%(P < 0.01)、2.03%(P < 0.01);4 ~ 6组盲肠分别较1组升高0.97%(P<0.01)、1.09%(P < 0.01)、1.09%(P < 0.01)。

表2 复合酶制剂对肉鸡肠内容物大肠杆菌的影响lg cfu/g
2.3 不同水平复合酶制剂对肉鸡肠道不同部位双歧杆菌数量的影响 21 d和42 d肉鸡肠道不同部位内容物双歧杆菌数量,2~6组均不同程度高于1组(表4)。21 d肉鸡肠道不同部位内容物双歧杆菌数量,4~6组十二指肠分别较1组升高 3.28%、4.37%、4.74%(P < 0.05),6组空肠较1组升高2.59%(P<0.05)。42 d肉鸡肠道不同部位内容物双歧杆菌数量,3~6组十二指肠分别较 1组升高2.37%、2.92%、3.28%、3.65%(P<0.05);3~6组回肠分别较 1组升高 1.04%、1.34%、1.49%、1.64%(P<0.05);3~6组盲肠分别较 1组升高 0.63%、0.88%、1.13%、1.13%(P<0.05);6组空肠较 1组升高 1.78%(P < 0.05)。
2.4 复合酶制剂对肉鸡肠道总需氧菌数量的影响 21 d和42 d肉鸡肠道不同部位内容物总需氧菌数量,2~6组均不同程度低于1组 (表5)。21 d肉鸡肠道不同部位内容物总需氧菌数量,5组、6组十二指肠分别较1组降低1.91%、2.07%(P<0.05);5组、6组盲肠分别较1组降低2.04%、2.99%(P<0.05)。42 d肉鸡肠道不同部位内容物总需氧菌数量,4~6组十二指肠分别较1组降低1.47%、1.28%、1.65%(P<0.05);5~6组空肠分别较1组降低1.76%、1.76%(P<0.05);6组回肠较1组降低1.44%(P<0.05);3~6组盲肠分别较1组降低1.07%、2.28%、2.55%、2.82%(P<0.05)。
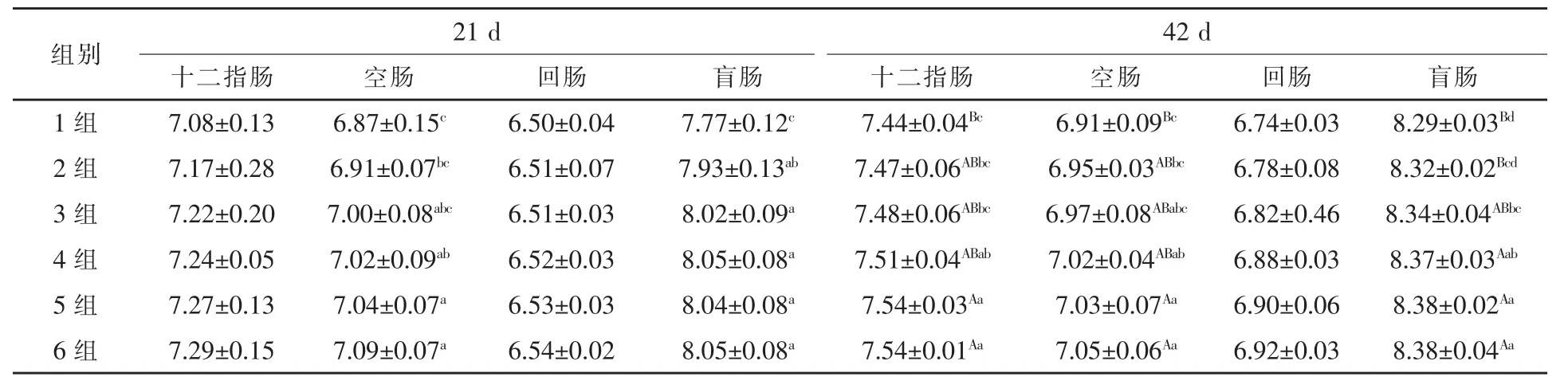
表3 复合酶制剂对肉鸡肠道内容物乳酸杆菌的影响lg cfu/g
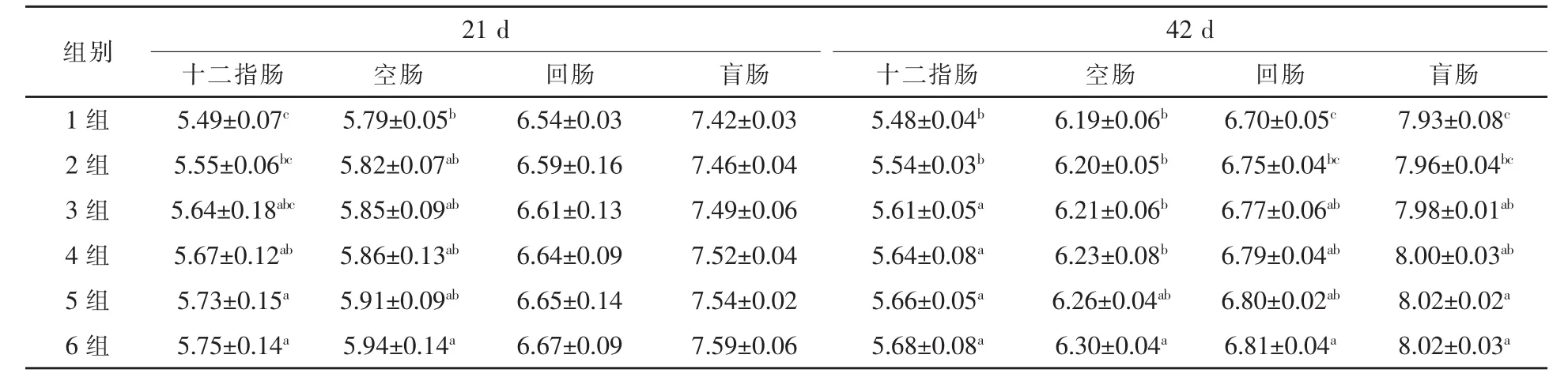
表4 复合酶制剂对肉鸡肠道内容物双歧杆菌的影响lg cfu/g
2.5 复合酶制剂对肉鸡肠道总厌氧菌数量的影响 21 d和42 d肉鸡肠道不同部位内容物总厌氧菌数量,2~6组均不同程度高于1组 (表6)。21 d肉鸡肠道不同部位内容物总厌氧菌数量,4~6组十二指肠分别较1组升高 0.96%、1.24%、1.37%(P<0.05);3~6组回肠分别较1组升高1.22%、2.03%、2.30%、2.71%(P < 0.05);3 ~ 6 组盲肠分别较 1组升高 0.99%、1.37%、1.86%、2.11%(P<0.05)。42 d肉鸡肠道不同部位内容物总厌氧菌数量,4~6组十二指肠分别较1组升高0.79%、1.19%、1.32%(P < 0.05);4~ 6组回肠分别较 1组升高 0.97%、1.39%、1.53%(P<0.05);4~6组盲肠分别较1组升高0.83%、1.07%、1.30%(P<0.05);5~6组空肠分别较 1组升高 1.41%、1.55%(P < 0.05)。
2.6 不同水平复合酶制剂对肉鸡消化道食糜酸度的影响 21、42 d肉鸡的嗉囊、腺胃、肌胃、十二指肠、空肠、回肠和盲肠食糜pH(表7)各试验组(2~6组)均低于对照组(1组),但差异均不显著(P > 0.05)。
3 讨论
3.1 小麦-豆粕型饲粮中添加复合酶制剂对肉鸡肠道微生物的影响 有益菌乳酸杆菌和双歧杆菌及致病菌大肠杆菌是动物肠道的正常菌群。研究发现木聚糖酶、β-葡聚糖酶、纤维素酶以及β-甘露聚糖酶等NSP酶对胃肠道中有益菌有益生作用,而对有害菌具有抑制作用(任文等,2017;丁雪梅等,2009)。周利芬等(2004)研究报道,肉鸡饲粮中添加酶制剂能促进肠道乳酸菌的生长,抑制大肠杆菌的生长;宋智娟等(2006)研究报道,β-葡聚糖酶的添加,促进了乳酸杆菌、双歧杆菌的生长,抑制了大肠杆菌的生长。本试验结果显示,小麦-豆粕型饲粮中添加复合酶制剂,肉鸡肠道各部位的大肠杆菌、总需氧菌数量有不同程度降低,而乳酸杆菌、双歧杆菌、总厌氧菌数量呈明显增加趋势,本试验所用复合酶制剂有优化肉鸡肠道有益菌群的作用,与上述研究结果一致。但不同复合酶对肠道微生物的影响报道不尽一致,有部分研究发现饲用酶制剂对肠道微生物菌群影响不明显(任文等,2017)。

表5 复合酶制剂对肉鸡肠道内容物总需氧菌数量的影响lg cfu/g
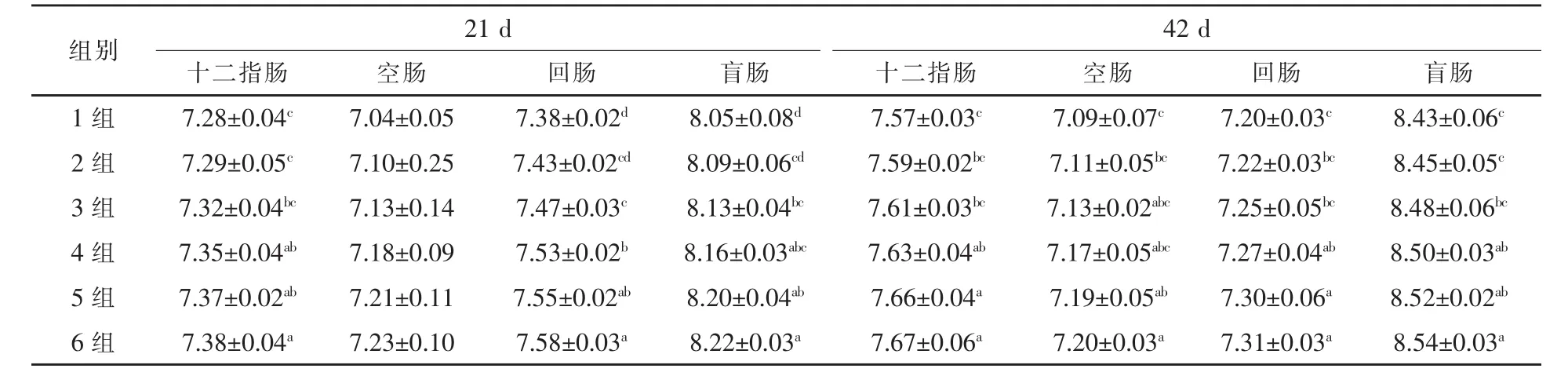
表6 复合酶制剂对肉鸡肠道内容物总厌氧菌的影响 lg cfu/g
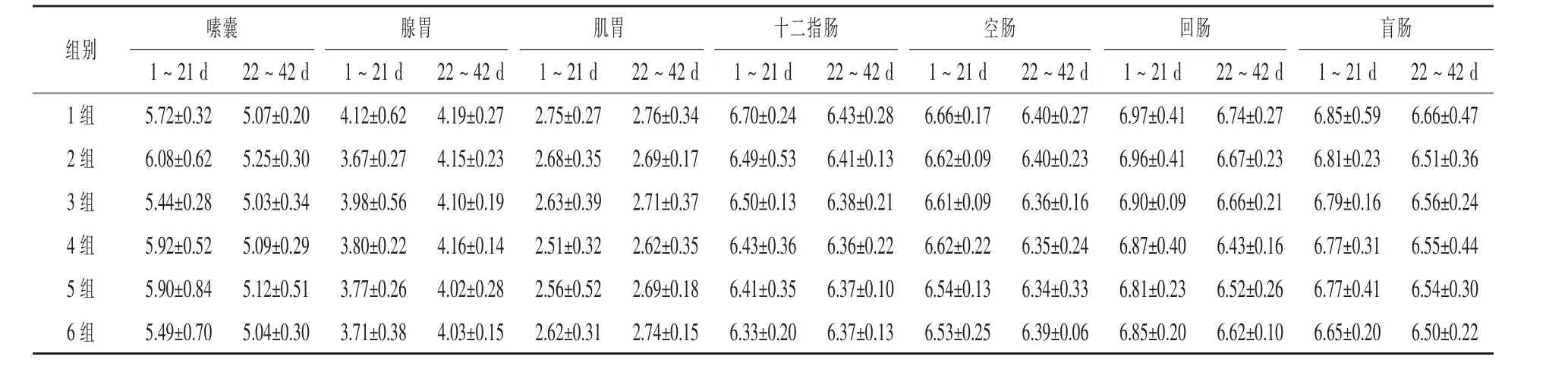
表7 复合酶制剂对肉鸡消化道食糜pH的影响
3.2 小麦-豆粕型饲粮中添加复合酶制剂对肉鸡消化道食糜酸度的影响 消化道微生物、腺胃分泌的盐酸、胰液、胆汁及肠液等是消化道食糜酸度值的决定因素,pH降低可抑制大肠杆菌的生长,促进乳酸杆菌、双歧杆菌的增殖,而乳酸杆菌、双歧杆菌等有益菌又可将肠道中的可发酵性糖转变成乳酸和醋酸,从而降低肠道环境的pH(Zacherl等,2011;Dikeman 等,2006)。 动物胃肠道酸性环境有利于胃蛋白酶原的激活,pH越低,胃蛋白酶原激活率越高(冷向军等,2001)。吕秋凤等(2013)研究报道,小麦饲粮中添加木聚糖酶能够显著降低肉鸡空肠食糜pH。本试验显示添加不同水平复合酶制剂肉鸡消化道各部位食糜酸度均低于对照组,但差异均不显著。 Mathlouthi(2003)报道,小肠酸度值的下降是由木聚糖酶和β-葡聚糖酶降解NSP产生挥发性脂肪酸造成的。Hume(1992)等研究表明,盲肠酸度值的下降是由于酶制剂提高了肠道内乳酸菌和挥发性脂肪酸的浓度。
4 结论
本试验结果显示,肉鸡小麦-豆粕型饲粮中添加不同水平复合酶制剂,可不同程度增加肠道中乳酸杆菌、双歧杆菌、总厌氧菌的数量,降低大肠杆菌和总需氧菌的数量;不同水平复合酶制剂均有降低肉鸡消化道各部位食糜酸度值趋势,添加量以2000~3000 mg/kg作用效果最佳。
参考文献
[1]丁雪梅,张克英.小麦-豆粕型日粮添加木聚糖酶对艾维茵肉鸡免疫指标、肠道形态和微生物菌群的影响[J].动物营养学报,2009,21(6):931 ~ 937.
[2]冷向军,李小勤,王康宁.pH值对胃蛋白酶原激活率影响的研究[J].广西农业生物科学,2001,20(1) :27 ~ 30.
[3]吕秋凤,文宗雪,邵彩梅,等.小麦日粮中添加木聚糖酶对肉鸡肠道大肠杆菌数量、pH值及食糜黏度的影响 [J].饲料工业,2013,34(2):41 ~ 44.
[4]任 文,喻晓琼,翟恒孝,等.饲用酶制剂调节单胃动物肠道微生态及作用机理[J].动物营养学报,2017,29(3):762 ~ 768.
[5]宋智娟.β-葡聚糖酶对肉鸡生产性能、肠道微生物及免疫机能的影响:[硕士学位论文][D].保定:河北农业大学,2006.
[6]薛梅,史雪萍,徐玉,等.肉鸡小麦-豆粕型饲粮中4种单酶复配的体外消化筛选试验[J].中国畜牧杂志,2015,51(3):57 ~ 62.
[7]甄建华,于河,谷晓红.肠道微生态医学研究进展概述[J].中华中医药杂志,2017,32(7):3069 ~ 3078.
[8]周利芬.厌氧真菌粗酶制剂的研制及应用研究:[硕士学位论文][D].南京:南京农业大学,2004.
[9]周小娟,常江,张志帅,等.复合酶对肉鸡生产性能和肠道微生物的影响[J].中国饲料,2013,14:19 ~ 22.
[10]Choct M,Kocher A,Waters D L,et al.A comparison of three xylanaseson the nutritive value of two wheatsfor broiler chickens[J].British Journal ofNutrition,2004,92:53 ~ 61.
[11]Dikeman C L,Fahey Jr G C.Viscosity as related to dietary fiber:a review[J].Critical Reviews in Food Science and Nutrition,2006,46(8):649 ~ 663.
[12]Hume M F,Kubena L F,Beier R C,et al.Fermentation of[14C]lactose in broiler chicks by ceal anaerobes[J].Poultry Science,1992,71:1464 ~ 1470.
[13]Mathlouthi N,Mallet S Saulnier L.Effects of xylanase and βglucanase addition on performance,nutrient digestibility,and physico-chemical conditionsin the small intestine contentsand caecal microflora of broiler chickens fed a wheat and barley-based diet[J].Journal of Animal Science,2003,51:395 ~ 406.
[14]Niba A T,Beal J D,Kudi A C,et al.Bacterial fermentation in the gastrointestinal tract of non-ruminants:influence of fermented feeds and fermentable carbohydrates[J].Tropical Animal Health and Production,2009,41(7) :1393 ~ 1407.
[15]Zacherl C,Eisner P,Engel K H.In vitro model to correlate viscosity and bile acid-binging capacity of digested water-soluble and dietary fibres[J].Food Chemistry,2011,126(2):423 ~ 428.

