肉鸭消化道酵母益生菌胆酸盐耐受性及其机理研究
刘 琼, 罗青平, 左家华, 王学东,胡骏鹏, 段胜浩, 郑红生,胡先勤*
(1.武汉轻工大学,湖北武汉 430023;2.农业部畜禽细菌病防治制剂创制重点实验室,湖北武汉 430064;3安琪酵母股份有限公司,湖北宜昌443003;4.武汉永生鸭业有限公司,湖北武汉 430077)
胆酸盐是胆汁中由胆固醇衍生而来的,是人和动物体中具有甾核结构的一类两性大分子,肉鸭肠道中胆酸盐的浓度约为0.3%,其对于肠道菌群如酿酒酵母菌、乳酸杆菌的生存和生长具有抑制作用(Adebola 等,2014)。 García-Hernández 等(2012)对鸡排泄物中的酵母益生菌进行耐胆酸盐试验发现,部分酿酒酵母菌能够耐受0.3%~0.6%的胆酸盐浓度。由此可见,在消化道正常胆汁浓度下,酵母益生菌具有良好的抗胆酸盐能力。海藻糖是一类非还原性的二糖(Jules,2008),是酵母细胞在应对外界环境变化时,保护自身所形成的一种具有高抗性的应激状态物质,在生物圈内的表达无所不在。其由两个葡萄糖分子经过α1-1糖苷键相连,具有其他糖类所不具有的一系列特殊的物理特征,如高亲水性和化学稳定性,不形成分子内氢键。当酵母细胞处于高浓度胆酸盐环境中时,细胞内盐浓度变化,会引起蛋白质变性、改变细胞膜构造等危害酵母细胞生长代谢的变化。海藻糖对酵母细胞处于高浓度胆酸盐环境中的保护机理可能是由于其具有很强的水分子束缚能力,使得膜蛋白的亲水性部分与水结合,最终防止了酵母细胞膜的变性(Argüelles,2000)。 本试验旨在从肉鸭消化道内分离筛选出的7株酿酒酵母中,通过高浓度胆酸盐应激处理选取高抗性菌株,并探究高浓度胆酸盐与酵母细胞质膜ATPase活性及胞内海藻糖积累量的相关性,为开发高抗性、专一型的酵母益生菌制剂奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品来源 本实验室从肉鸭肠道分离保存的7株酿酒酵母(张霞等,2015)。
1.1.2 培养基 琼脂培养基、YPD培养基均为国产。
1.1.3 试剂 GENMED Bradford蛋白质浓度定量试剂盒 (Genmed Scientifics INC.U.S.A),GEN-MED酵母ATP酶(ATPase)活性酶连续反应光谱法定量检测试剂盒 (Genmed Scientifics INC.U.S.A),牛胆盐、三氯乙酸、硫酸、蒽酮等均为国产。
1.2 试验方法
1.2.1 酵母菌的培养 将7株酿酒酵母分别接种于YPD培养基中,28℃、150 r/min 2次培养(以获得第二代酵母细胞)至对数期(107~108cfu/mL)。1.2.2 酵母菌胆酸盐耐受性 取适量制备好的菌悬液,在600 nm波长处用液体YPD培养基调节其OD值为 (0.8±0.02), 在胆盐浓度为0%、0.30%、0.60%(牛胆盐,Solarbio,中国)的液体YPD中培养24 h后,参考国标GB4789.15-2010,计算其存活率,计算公式为:
S/%=[(cfu/mL)YPD+胆盐×100]/(cfu/mL)YPD。
1.2.3 酵母菌细胞膜ATPase活性测定 取10 mL待测的新鲜真菌/酵母细胞 (OD600=0.4~0.8),移入到预冷的15mL锥形离心管中,置于冰槽中5min,离心(1000 g,4 ℃,5 min),抽去上清液,加入 250 μL GENMED裂解液,充分混匀,移入预冷的1.5 mL离心管中,加入100 mg GENMED强化液,强力涡旋振荡15 s,置于冰槽中1 min(重复五次),加入250μLGENMED裂解液,充分混匀,离心(16000 g,4℃,15 min),移取500μL上清液到新的预冷的1.5 mL离心管,移取10μL进行蛋白定量检测(使用GENMED Bradford蛋白质浓度定量试剂盒-MS30030.1)。移取730μL GENMED缓冲液到新的比色皿,加入20μL ENMED酶促液,100μL GENMED反应液,100μL GENMED底物液,放进28℃培养箱里静置3 min,加入50μL待测样品,混匀,即刻放进分光光度仪检测:340 nm读数0~30 min。样品ATPase活性计算公式为:

式中:A 为样品活性,mg;r1为样品读数;r0为背景读数;为x为样品稀释倍数;6.22为毫摩尔吸光系数;t为反应时间,min。
1.2.4 酵母细胞胞内海藻糖含量测定 精确称取鲜酵母0.1 g(称准至0.0002 g)于离心管中,加入4.0 mL 0.5 mol/L三氯乙酸溶液于振荡器振荡混匀后置于带有冰块的冰水中,每15 min振荡一次,共1 h,于离心机3000 r/min离心5 min,将上清液倒入50 mL容量瓶中,用冰水洗涤离心管及沉淀,振荡混匀后,再放如高速离心机中3000 r/min离心5 min,将上清液倒入50 mL容量瓶中,然后用冰水稀释至刻度,摇匀。于50 mL容量瓶中加入4.0 mL 0.5 mol/L三氯乙酸溶液,用冰水稀释至刻度,摇匀,作为空白溶液。吸取空白及样品1.00 mL于两个洁净干燥的试管中,再分别精确加入蒽酮试液5 mL,振荡摇匀,沸水浴中反应时间为10 min,拿出立即将样液温度冷却至室温,再次摇匀,放于分光光度计630 nm处,用1 cm比色皿测定吸光度,以空白作对照。试验样品中海藻糖积累量的计算公式为:
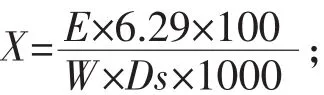
式中:X为试样中海藻糖的百分含量,%;E为试样的吸光度;6.29为当E=1时,每毫升溶液中含海藻糖的质量,mg;W试样质量,g;Ds为试样干物质的百分含量,%。
2 结果和分析
2.1 不同胆酸盐浓度环境培养酵母菌存活率通过高浓度胆酸盐冲击试验,采用平板涂布计算酿酒酵母在不同胆酸盐浓度环境的存活率,结果发现7株酿酒酵母均可在高浓度胆酸盐环境中生长,7株菌株的存活率都随胆酸盐浓度的增加而减小,酿酒酵母培养环境胆酸盐浓度对酵母生长有显著影响,不同酵母菌株对环境胆酸盐耐受性有差异(表1)。且Y-2、Y-6和Y-7三株酿酒酵母菌株在不同胆酸盐浓度环境中的存活率均高于其他菌株。

表1 不同胆酸盐浓度环境中菌株的存活率%
2.2 不同胆酸盐浓度环境中酵母菌细胞膜ATPase活性 酵母细胞质膜ATPase属于膜结合蛋白,高浓度胆酸盐胁迫下,酵母细胞质膜结构及其稳定性发生变化从而影响ATPase活性。酵母细胞处于高浓度胆酸盐胁迫环境中时,通过加强细胞质膜ATPase活性,促进Na+/H+的逆向转运,从而避免细胞内胆酸盐浓度过高,保护其细胞免受恶劣外界环境的损害。从表2可知,7株酿酒酵母细胞质膜ATPase活性随着胆酸盐的浓度增加而增加,在胆酸盐的浓度为0.3%时该酶活性增长较快,随着胆盐浓度继续增加,酶活性增加幅度变小。且Y-2、Y-6和Y-7这3株菌株在高浓度胆酸盐环境培养时的ATPase活性均高于其他菌株,这一结果与其细胞存活率试验结果一致,因此认为,酵母细胞质膜ATPase在维持其细胞结构的稳定中起到重要作用。由于高浓度胆酸盐环境下酵母菌株存活率降低,但其ATPase活性增加,推断是由于存活的酿酒酵母细胞在处于高浓度胆酸盐环境中时,其细胞质膜ATPase表达量增加所致。
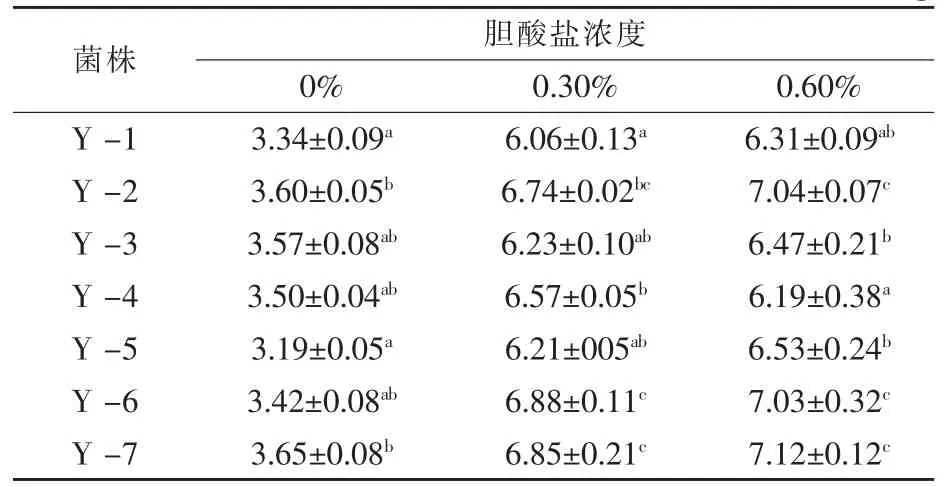
表2 7株酵母不同胆酸盐浓度培养24 h后细胞质膜ATPase活性 μmol/mg
2.3 不同胆酸盐浓度环境中酵母菌株胞内海藻糖含量 海藻糖不仅是酿酒酵母中重要的贮藏性碳源,还对细胞生物膜、蛋白质、核酸等大分子物质结构的稳定性起到重要的作用 (张和笙等,1999)。在恶劣的环境中,海藻糖可以保护酵母细胞的结构,这得益于其独特的物理性质 (呙于明等,2014)。海藻糖的含量对高浓度胆酸盐条件下酵母的存活率起着至关重要的作用 (黄国宏等,2007)。从表3可知,7株酿酒酵母胞内海藻糖积累量随胆酸盐浓度的增加而降低,但胆酸盐耐受性较好的菌株其胞内海藻糖积累量始终高于耐受性较差的菌株,说明酵母细胞内的海藻糖确实对其细胞处于高浓度胆酸盐环境中起到一定的保护作用,随着酵母细胞生长环境胆酸盐浓度的增加,其胞内海藻糖积累量降低,可能是由于酵母细胞处于高浓度胆酸盐环境中时部分酵母细胞死亡所致。供试的7株酿酒酵母菌株Y-2、Y-6和Y-7胞内海藻糖积累量始终高于其余几株,这与其细胞存活率试验结果一致。
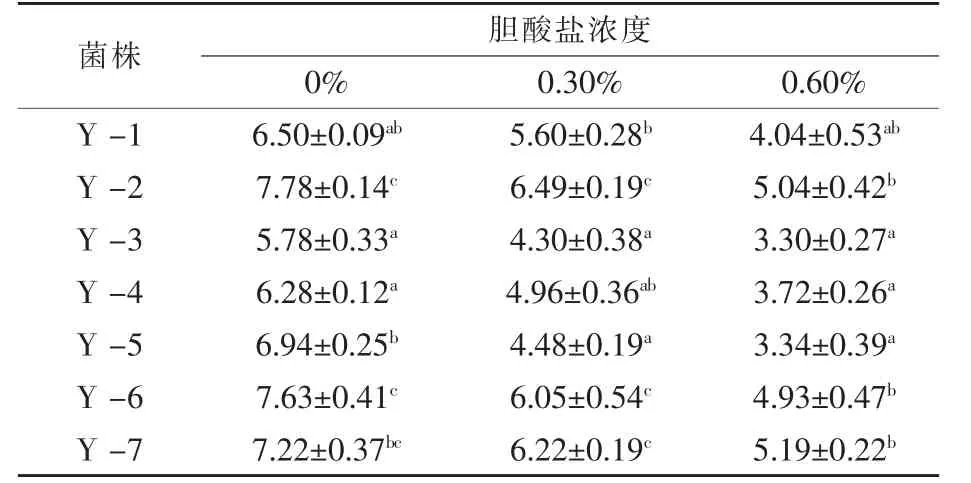
表3 酿酒酵母在不同胆酸盐浓度培养24 h后胞内海藻糖积累量%
3 讨论
动物消化道高浓度胆酸盐环境对酿酒酵母生长具有抑制损害作用,但部分酿酒酵母具有良好的胆酸盐耐受性(王继花,2008)。本试验对肉鸭消化道分离出的7株酿酒酵母进行高浓度胆酸盐冲击试验,研究了7株肉鸭原籍酵母菌株的胆酸盐耐受性,并对其可耐受高浓度胆酸盐环境的机理进行了初步探讨。7株酿酒酵母菌株均可在高浓度胆酸盐环境中生长,其存活率随胆酸盐浓度的增加而减小,不同酵母菌株对环境胆酸盐耐受性有差异。这可能是由于酵母生长环境中高浓度的胆酸盐对酵母细胞结构产生破坏,导致耐受性较差的酵母菌生长繁殖受到抑制甚至死亡。
关于酿酒酵母细胞胆酸盐耐受性机理研究中,有研究证实,当酵母细胞长期处于不利于自身生长的恶劣环境条件中时,其细胞内物质含量及组分往往会发生明显变化(Bonhivers等,1998)。本试验对酵母细胞质膜ATPase活性和胞内海藻糖积累量进行分析发现,7株酿酒酵母细胞质膜ATPase活性与其生长环境胆酸盐浓度呈负相关,因此推断随环境胆酸盐浓度的增加,酿酒酵母细胞质膜ATPase大量表达,通过其自身构象的变化保证了酵母细胞内离子的平衡,但随着胆酸盐浓度的增加,由于酵母细胞膜遭到破坏而死亡,其ATPase活性增加幅度变小。7株酿酒酵母胞内海藻糖积累量与其生长环境胆酸盐浓度呈正相关,说明酵母细胞处于高浓度胆酸盐环境中时,其细胞结构遭到破坏大量死亡,但其存活率较高的菌株海藻糖含量也较高,因此推断,酿酒酵母细胞处于高浓度胆酸盐环境中时海藻糖对其细胞起到了保护作用。Y-2、Y-6和Y-7三株菌株细胞质膜ATPase活性与其胞内海藻糖积累量变化均与其存活率结果一致。
4 结论
肉鸭消化道酵母菌株的胆酸盐耐受性存在差异,不同菌株的胆酸盐耐受性与其细胞质膜ATPase活性和胞内海藻糖积累量密切相关。本研究中Y-2、Y-6和Y-7三株酿酒酵母菌株的胆酸盐耐受性较其余几株酿酒酵母菌株的胆酸盐耐受性佳,可作为后续开发肉鸭专用饲用酵母益生菌的备选菌株。
参考文献
[1]黄国宏,李科德,曾庆孝.酵母葡聚糖的制备及其理化性质研究[J].食品与发酵工业,2007,8:108 ~ 112.
[2]王继花.盐胁迫下酿酒酵母生理生化特性的研究:[博士学位论文][D].辽宁:大连工业大学,2008.
[3]呙于明,刘丹,张炳坤.家禽肠道屏障功能及其营养调控[J].动物营养学报,2014,10:3091 ~ 3100.
[4]张和笙,梁卫红.浅论镁离子对啤酒发酵的影响[J].酿酒科技,1999,1:43 ~ 44.
[5]中华人民共和国国家技术监督局.GB4789.15[S].中华人民共和国卫生部.北京:中国标准出版社,2010-03-26.
[6]张霞,王学东,李彪,等.肉鸭消化道酵母益生菌的分离与鉴定[J].饲料工业,2015,22:59 ~ 64.
[7]Adebola OO,Corcoran O,Morgan WA.Synbiotics:the impact of potential prebiotics inulin,lactulose and lactobionic acid on the survival and growth of lactobacilli probiotics[J].Journal of functional foods,2014,10:75 ~ 84.
[8]Argüelles J C.Physiological roles of trehalose in bacteria and yeasts:a comparative analysis[J].Archives of Microbiology,2000,174(4):217 ~ 224.
[9]Bonhivers M,Carbery JM,Gould SJ,et al.Aquaporinsin Saccharomyces genetic and functional distinctions between laboratory and wild-typestrains[J].Biol.Chem,1998,273 (42): 27565 ~ 27572.
[10]García-Hernández Y,Rodríguez Z,Brandao L R,et al.Identification and in vitro screening of avian yeasts for use as probiotic[J].Res Vet Sci,2012,93(2):798 ~ 802.
[11]Jules M.New insights into trehalose metabolism by Saccharomyces cerevisiae:NTH2 encodes a functional cytosolic trehalase,and deletion of TPS1 reveals Ath1p-dependent trehalose mobilization[J].Appl Environ Microbiol,2008,74(3):605 ~ 614.

