饲料中油脂过氧化值检测方法的研究
陈 焕, 毕艳兰*,吴永辉,谭龙泉,杨国龙, 汪学德
(1.河南工业大学粮油食品学院,河南郑州450001;2.广州倚德生物科技有限公司,广东广州510000)
受温度、水分、金属离子、各种酶制剂等因素的影响,在加工和储存过程中含油较高的饲料中的油脂往往会发生化学变化,会产生不良的风味,甚至产生毒性,此现象称为油脂的酸败,俗称饲料(油脂)哈变(李建华,2007;于炎湖,2003)。油脂的酸败可分为水解酸败与氧化酸败(毕艳兰,2005)。张志刚等(2007)提出饲料的酸败主要表现在饲料中油脂的氧化酸败。油脂氧化酸败极其普遍,氧化与油脂营养降低、风味劣变等息息相关(Fankel,1984)。其不利影响包括:油脂感官变劣导致适口性变差、不饱和脂肪酸比例下降导致营养价值降低、氧化产生有毒的初级及次级产物、弱化加工适应性等 (曹文明,2013;Sikorski,2003; 任泽林,2000)。过氧化值是常温下不饱和脂肪氧化的初级产物评价指标,能够比较合理的评价油脂氧化初期的氧化情况。然而,目前还没有检测饲料中油脂过氧化值的标准方法。由于饲料组分的复杂性,一般须先将油脂分离出来,再用油脂的过氧化值(Peroxide Value,PV)国家标准(GB/T 5538-2005)来测定。食品中油脂的提取及过氧化值测定的影响因素有溶剂类型、浸提方式、残留溶剂等(程建华,2004;姚庆伟,1998);程建华等(2005)研究了饲料中油脂的过氧化值的测定方法∶将饲料粉碎后用石油醚浸泡过夜、过滤后减压脱溶后得到油脂后再测过氧化值,该方法测定过氧化值的回收率能达到105%~113%,是目前较可行的方法,但是该方法浸泡时间过长,分析效率较低。因此,本文拟研究一种较为快速的检测饲料中油脂过氧化值的有效方法。
1 材料与方法
1.1 材料
1.1.1 原料与试剂 饲料(市售仔猪浓缩饲料,产地湖南),脱脂饲料(自制,方法见1.2.1),抗氧化剂TBHQ (Sigma~Aldrich西格玛奥德里奇 (上海)贸易有限公司),精炼一级大豆油:益海(周口)粮油工业有限公司。石油醚(30~60℃)、石油醚(60~90℃)、无水乙醚、正己烷、冰乙酸、硫代硫酸钠、可溶性淀粉、碘化钾等均为市售分析纯。
1.1.2 仪器 BSA224S分析天平 (感量0.0001 g),WDYI-1000微量移液器,90-1型恒温磁力搅拌器,RE-52AA旋转蒸发仪,800-2台式离心机,HH-2数显恒温水浴锅。
1.2 实验方法
1.2.1 脱脂饲料的制备 取适量饲料用滤纸包好,在索氏抽提管中用石油醚回流浸取10 h,脱溶完成后收集饲料粕,并测得脱脂饲料的含油率为 (0.14±0.04)%。按照此方法共制备脱脂饲料8 kg备用。
1.2.2 抗氧化剂TBHQ含量为200 mg/kg的大豆油的配置 准确称取1000 g(精确至0.1 g)大豆油于1.5 L干净娃哈哈矿泉水瓶,加入0.2 g(精确至0.1 mg)的TBHQ,摇晃30 min使之完全溶解,得到TBHQ含量为200 mg/kg的油样。
1.2.3 不同过氧化值油脂的配置 按1.2.5中的方法测定高过氧化值大豆油的过氧化值PV0(21.00±0.54)mmol/kg和低过氧化值大豆油的过氧化值 PV1(3.57±0.01)mmol/kg,然后按公式(1)计算并称取对应的低过氧化值大豆油和高过氧化值大豆油的质量,充分混匀后再测定所配置油脂的过氧化值PV3。
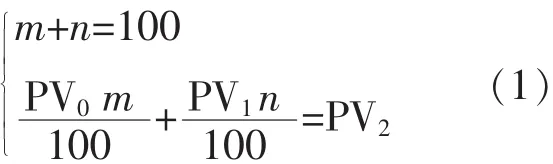
式中:PV0为高过氧化值大豆油的过氧化值,mmol/kg;PV1为大豆油的过氧化值,mmol/kg;PV2为所需配置的油脂过氧化值,mmol/kg;m为配置100 g所需过氧化值油脂加入高过氧化值大豆油的质量,g;n为配置100 g所需过氧化值油脂加入低过氧化值大豆油的质量,g。
高过氧化值油脂的制备:取一定质量的一级大豆油加入到2000 mL的大烧杯中,在60℃的烘箱中加热约5 d,测定其过氧化值直至达到所需大小。
1.2.4 油脂提取的方法 称取预先计算好的一定质量的所配置油脂和脱脂饲料共50 g至150 mL烧杯中,充分搅拌均匀,混匀后加入到500 mL三口瓶中,加入一定量溶剂,在一定温度下于磁力搅拌装置中浸取一定时间,完成后取上层液于离心桶中并在4500 r/min下离心5 min,取上清液于 30℃、80~100 r/min、20~30 kPa条件下旋蒸脱溶。
1.2.5 油脂过氧化值的测定 GB/T 5538-2005动植物油脂过氧化值测定
2 结果与讨论
2.1 是否添加TBHQ对饲料油脂过氧化值测定结果的影响 从饲料中提取油脂过程中,受氧气、温度、搅拌、脱溶等因素的影响,可能会促使油脂的进一步氧化,发生氧化后的油脂无法准确反映原来饲料中油脂的真实过氧化值。往饲料中添加TBHQ可能会降低饲料中的油脂在提取过程中的氧化程度。因此,本研究首先比较了是否添加TBHQ对饲料中油脂过氧化值测定结果的影响(图 1 和图 2)。
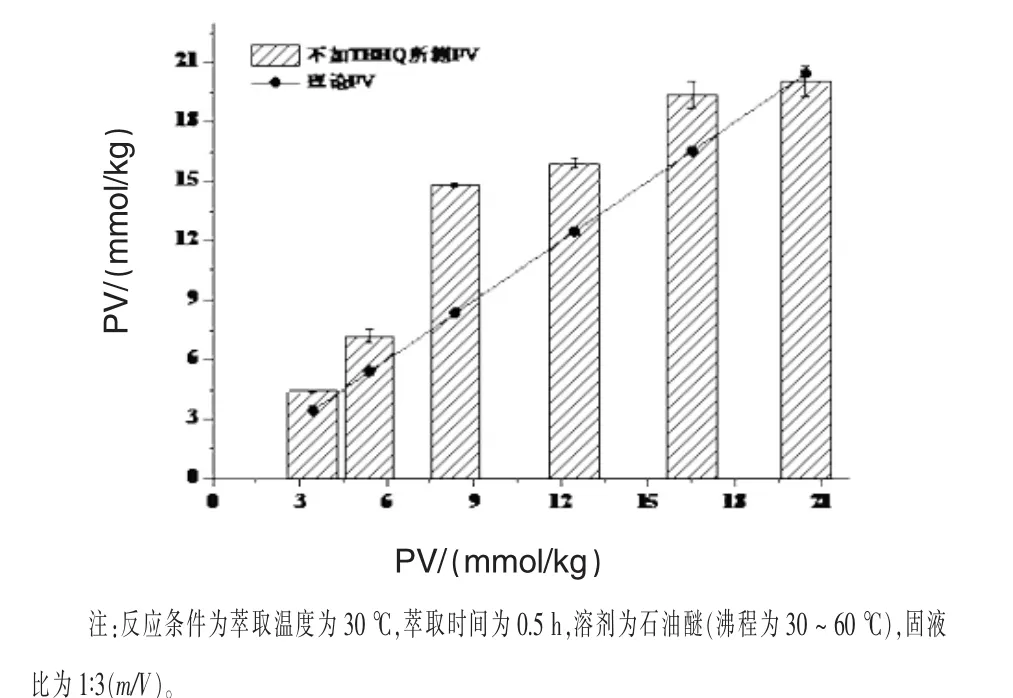
图1 不加TBHQ所测PV与所加油脂PV的比较

图2 加TBHQ所测PV与所加油脂PV的比较
从图1和图2可以看出:添加TBHQ所测的过氧化值与不添加TBHQ之间存在显著性差异(P<0.05),添加TBHQ所测的过氧化值与所加油脂的过氧化值相比无显著性差异 (P>0.05)。如在脱脂饲料中加入过氧化值为8.35 mmol/kg的油脂时,提取过程不添加TBHQ测定油脂的过氧化值高达14.80 mmol/kg,添加TBHQ测出油脂的过氧化值仅为8.64 mmol/kg,不添加TBHQ测定油脂的过氧化值是添加TBHQ测得油脂过氧化值的1.74倍,表明在油脂提取过程中添加TBHQ能有效降低油脂的氧化程度。
2.2 不同提取溶剂对过氧化值测定结果的影响不同溶剂的性质差异较大且可能影响脂溶性物质的过氧化值。因而,本文对不同提取溶剂对饲料油脂过氧化值测定结果的影响进行了研究(见表 1)。

表1 不同溶剂提取油脂所测过氧化值
由表1可知,乙醚作为提取溶剂时,过氧化值回收率与石油醚(沸程为30~60℃)、石油醚(沸程为60~90℃)、正己烷作为提取溶剂相比具有显著性差异(P<0.05);如理论过氧化值为5.4 mmol/kg时,乙醚提取油脂所测过氧化值达到了8.4 mmol/kg,其回收率为156.1%,是石油醚(沸程为30~60℃)测定结果的1.4倍、是石油醚(沸程为60~90℃)测定结果的1.5倍、是正己烷测定结果的1.5倍。乙醚作为提取溶剂会使油脂的过氧化值显著增大,这可能与乙醚自身在空气、光作用下氧化成过氧化物并且促进不饱和油脂氧化有关。

表2 三种溶剂的线性回归方程和相关系数
由表2可知,在过氧化值为3~22 mmol/kg时,以正己烷作为提取溶剂时,其相关系数最高,为最优方案,回收率为95.56%~106.83%,相关系数为0.9981,RSD为0.46%~3.63%。
2.3 不同含油率对过氧化值测定结果的影响饲料中油脂的含量不尽相同,为了探究方法的广泛适用性,本文选择了含油5%~15%的饲料作为研究对象,研究不同含油率对饲料油脂过氧化值测定结果的影响(见表3)。
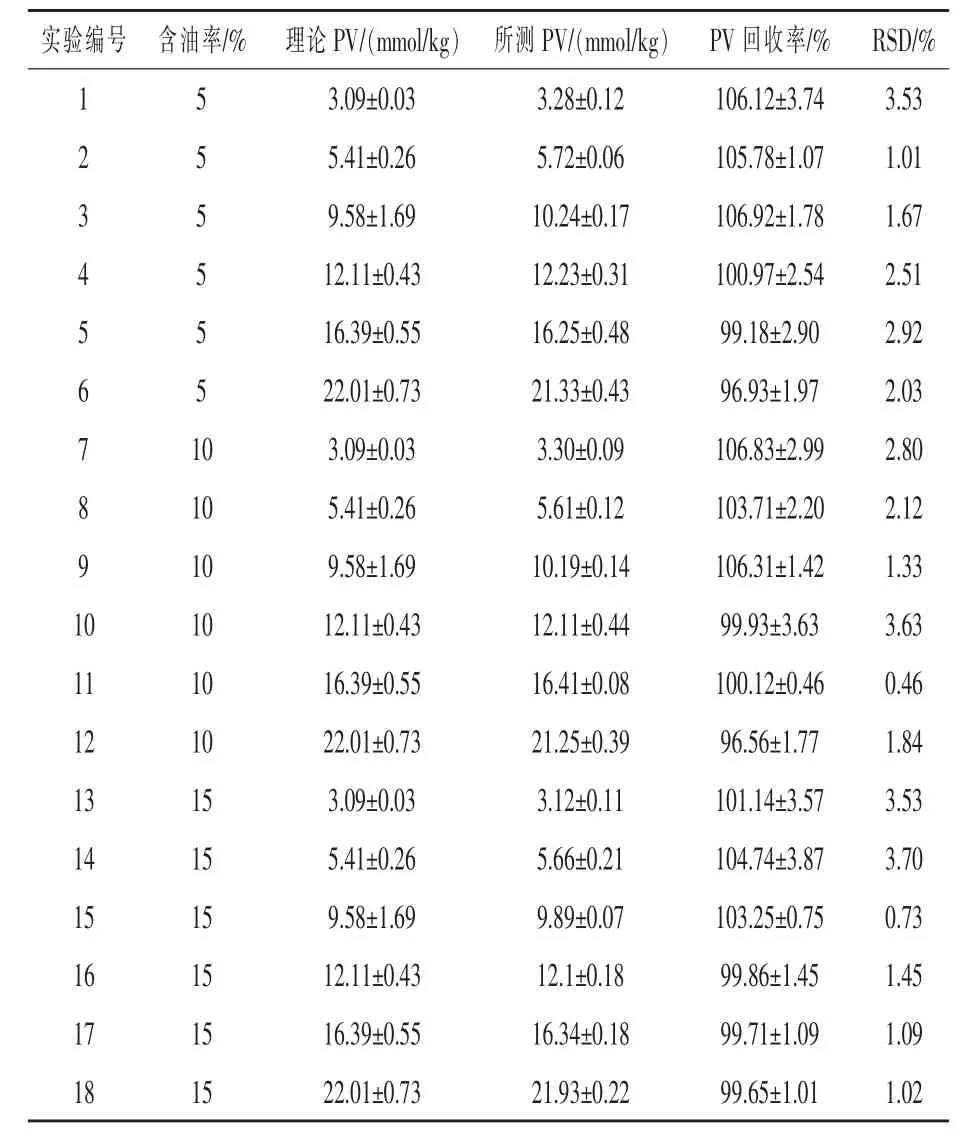
表3 不同含油率饲料提取油脂所测过氧化值
通过SPSS 20.0对不同含油率的过氧化值回收率进行方差分析,过氧化值回收率无显著差异。饲料含油率在5%~15%对该检测方法结果影响不显著。通过测定及计算日内精密度和日间精密度得到,日内精密度为1.43%~2.28%,日间精密度为1.97%~3.85%。
3 结论
本文将饲料油脂过氧化值(PV)的检测方法优化为:将TBHQ添加到饲料中搅拌均匀[m(TBHQ)=饲料重×饲料含油率(200 mg/kg)],称取 50 g含TBHQ的饲料到500 mL圆底烧瓶中,加入150 mL[料液比(g/mL)=1∶3]正己烷。 在 30 ℃磁力搅拌下回流浸取0.5 h。反应结束后,在4500 r/min下离心5 min,然后旋蒸,旋蒸脱溶后按GB/T 5538-2005中方法测定过氧化值。
结果表明,过氧化值在3~20 mmol/kg范围内,线性关系良好,线性相关系数为0.9981,多次试验平均PV回收率为95.56%~106.83%,日内精密度为1.43%~2.28%,日间精密度为1.97%~3.85%,且不受饲料含油率影响,具有很好的精密度和准确性。
参考文献
[1]毕艳兰.油脂化学[M].化学化工出版社,2005.
[2]曹文明,薛斌,袁超,等.油脂氧化酸败研究进展[J].粮食与油脂,2013,26(3):1 ~ 5.
[3]程建华,杨卫民,张凤枰,等.油样短期存放条件对过氧化值测定的影响[J].中国油脂,2004,29(2):55 ~ 58.
[4]程建华,冉莉,王德谦.饲料过氧化值测定方法的研究[J].饲料研究,2005,7:40 ~ 43.
[5]李纯华.影响饲料脂质酸败的因素及其评价指标[J].中国饲料,2007,14:444.
[6]任泽林,霍启光.氧化油脂对动物机体的影响[J].动物营养学报,2000,12(3) :1 ~ 13.
[7]姚庆伟.食品过氧化值测定的几种常见错误 [J].食品科学,1998,19(10):50 ~ 51.
[8]于炎湖.饲料安全性问题——(8)饲料油脂酸败的危害及其控制措施[J].养殖与饲料,2003,6:6 ~ 8.
[9]张志刚,董继红.张午普.饲料哈喇味产生的原因、危害及预防措施[J].今日畜牧兽医,2007,7:59 ~ 60.
[10]Frankel E N.Chemistry of free radical and singlet oxidation of lipids.[J].Progressin Lipid Research,1984,23(4):197 ~ 221.
[11]Penumetcha M,Khan N,Parthasarathy S.Dietary oxidized fatty acids:an atherogenic risk[J].Journal of Lipid Research,2000,41(9):1473~1480.
[12]Sikorski Z E,Kolakowska A.Chemical and functional properties of food lipids[J].RevistaBrasileira De CiênciasFarmacêuticas,2003,40(2):269 ~ 269.

