伽玛刀联合放疗对脑转移瘤的疗效及不良反应
祁 红 张旭东
根据相关统计报道,超过50%肿瘤存在脑转移的风险,并且多数发生为脑内多发转移瘤,这是导致肿瘤患者死亡和并发症发生的重要原因[1-2]。对于脑肿瘤转移患者,一旦无法获得及时的救治,会对患者的生存期和生存质量产生严重的影响。从上世纪五十年代以来,临床治疗脑转移瘤的主要方式为全脑放疗,可有效地延长患者的中位生存期[3-4]。随着放射治疗技术的不断改进,立体定向放射外科(SRS)逐渐趋于成熟,为脑转移瘤患者的病情控制和生存率提高提供更高的技术支持。本研究采用伽玛刀联合放疗方案治疗脑转移瘤患者,并且与单纯放疗疗效对比,现报告如下。
1 资料与方法
1.1 一般资料
2013年1月至2016年1月脑转移瘤患者60例,其中男性患者33例,女性患者27例,年龄35~64岁,平均年龄(45.4±5.2)岁,将其随机分为两组,各30例,其中观察组男性患者17例,女性患者13例,年龄37~63岁,平均年龄(44.8±5.5)岁;对照组男性患者16例,女性患者14例,年龄35~64岁,平均年龄(45.2±5.0)岁。两组基本资料的比较差异不具有统计学意义(P<0.05),具有可比性。
1.2 治疗方法
对照组:采用单纯全脑放疗方案治疗;具体的放疗操作如下:治疗仪器为电子直线加速器(瑞典医科达,BJ-6B),采取仰卧位,使用头罩进行固定,经激光系统标识选择照射点,并且使用胶布标记于面罩上,以作为坐标参考基点。增强CT扫描层厚设置为0.50 cm,定位,从头顶扫描至舌骨,扫描完毕后,输送影像资料至治疗计划系统。等中心两侧平行对穿照射,注意避开眼球、视觉神经和内耳等器官。按照常规进行分割,每次1.8~3.0 Gy,每天1次,每周5次,总剂量为DT30~40 Gy。
观察组:基于放疗基础上,联合立体定向放射治疗(伽玛刀治疗SRT)。采用陀螺旋转立体定向放射治疗系统(上海伽马星,GMX-1)。采取仰卧位,使用面罩固定头部,在额面部标记,以作为治疗计划制定和摆位的参考基点。增强CT扫描层厚0.50 cm定位,输送影像资料至治疗计划系统。以MRI图像作为勾画靶区的依据,以确定PTV。根据病灶的大小制定治疗计划,选择1~4号不同的准直器,调整和优化剂量分布。
1.3 观察指标
观察和比较两组患者的近期疗效(治疗有效率)、化疗前后的CD4+、CD4+/CD8+、毒副作用发生率。
1.4 疗效判断标准
参考《实体瘤疗效评价标准》,分为四级;进展(PD):出现新的病灶,CA125水平升高超过25%;稳定(SD):病灶缩小程度低于50%,甚至无明显变化,CA125水平恢复程度仅达25%且治疗效果维持1个月以上;部分缓解(PR):病灶缩小程度超过50%,CA125水平恢复程度超过化疗前一半以上且治疗效果维持1个月以上;完全缓解(CR):病灶全部消失,CA125水平恢复正常且治疗效果维持1个月以上;控制率=CR+PR+SD/总例数[5]。
1.5 统计学方法
应用SPSS 20.0统计学软件进行统计分析,采用t检验/卡方检验,采用±s表示数据的分布趋势,P<0.05表示数据比较差异具有统计学意义。
2 结果
2.1 近期疗效
与对照组临床有效率(66.67%)比较,观察组临床有效率(93.33%)明显更高,差异具有统计学意义,P<0.05,见表1。
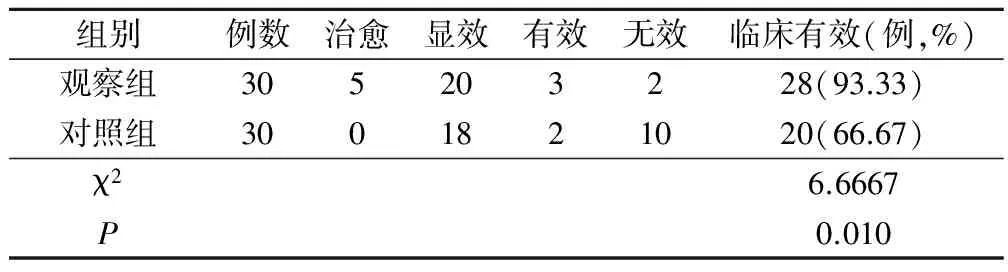
表1 两组疗效比较/例
2.2 免疫调节作用
与治疗前对比,两组CD4+水平明显降低,CD4+/CD8+比值明显上升,差异具有统计学意义,P<0.05;观察组治疗后与对照组治疗后相比,CD4+水平和CD4+/CD8+比值差异无统计学意义,见表2。
表2 两组治疗前后CD4+、CD4+/CD8+比较(±s)
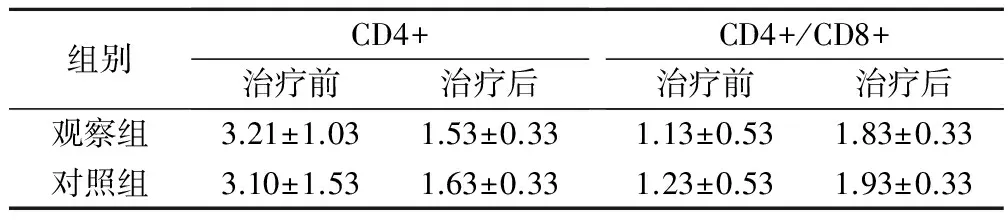
表2 两组治疗前后CD4+、CD4+/CD8+比较(±s)
组别CD4+治疗前治疗后CD4+/CD8+治疗前治疗后观察组3.21±1.031.53±0.331.13±0.531.83±0.33对照组3.10±1.531.63±0.331.23±0.531.93±0.33
在观察组中,治疗前和治疗后的外周血白细胞计数、红细胞、血红蛋白水平不存在统计学的意义,P>0.05;在对照组中,治疗前与治疗后外周血白细胞计数、红细胞、血红蛋白比较差异有统计学的意义,P<0.05;与对照组治疗后对比,观察组治疗后外周血白细胞计数、红细胞、血红蛋白水平差异有统计学意义,P<0.05,见表3。
表3 两组患者的外周血白细胞计数、红细胞、血红蛋白对比分析(±s)

表3 两组患者的外周血白细胞计数、红细胞、血红蛋白对比分析(±s)
观察指标观察组治疗前治疗后对照组治疗前治疗后外周血白细胞(×109/L)6.83±2.936.03±2.037.23±2.534.83±1.83红细胞(×1012/L)3.82±0.634.23±0.524.12±0.623.83±0.53血红蛋白/(g·L-1)120.03±22.03119.33±13.23122.33±16.03115.33±20.53
2.3 毒副作用发生情况
观察组和对照组不良反应发生率比较无明显差异,P>0.05,其不良反应以轻度不良反应为主,包括消瘦、消化道反应、水肿、脱发等,见表4。
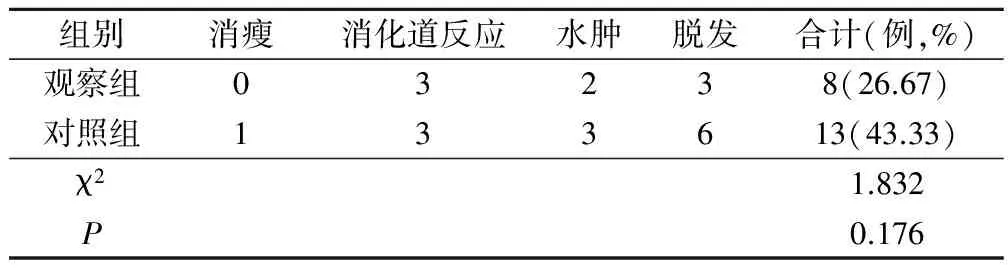
表4 两组患者毒副作用发生情况/例
3 讨论
脑转移瘤作为颅内肿瘤中最常见的肿瘤之一,其肿瘤位置大多位于大脑中动脉供血区,多为椭圆形小结节大水肿,且边界清楚,侵袭性小,容易挤压正常脑组织[6-9]。目前临床上主要采用全脑放疗(WBRT)来杀死脑转移瘤周围的浸润细胞以及亚临床病灶,然而这种方式容易造成下丘脑功能损伤、智力低下等放射性脑损伤,导致患者术后的生存质量下降[10-12]。随着立体定向放射外科(SRS)在临床上不断发展应用,其微创性和小风险性的优点越来越被人们认可,SRS已逐步成为脑转移瘤的重要治疗手段。SRS利用立体定向来对患者的颅内病灶进行三维定位,在肿瘤组织上聚焦电离辐射,促使肿瘤坏死从而到达治疗效果,这样通过适形的剂量分布来保护颅脑周围的正常组织[13-14]。SRS的原理是通过选择性定位颅内靶点,将不同方向的大剂量电离射线集中射入靶点位置来破坏肿瘤,同时确保靶点周围组织不受大量电离射线影响,减少周围组织损伤。而SRT通过 MRI 、 CT等工具实施精确定位来标志放射靶区,然后采用大量电离射线进行聚焦照射,对颅内较小病灶治疗效果显著。但是仅仅实施SRT治疗,会造成肿瘤一定程度的复发以及转移,其原因可能是由脑转移灶周围组织含有部分亚临床病灶,而SRT治疗对肿瘤周围组织的杀伤较弱,为亚临床病灶提供复发机会。针因此通过WBRT+SRT治疗可同时杀伤亚临床病灶,而减少神经系统功能损失、提高局部控制率。相关报道研究也证实了其对肿瘤局部控制改善、缓解患者神经系统症状、提高患者生活质量以及延长中位生存期效果显著,这与本文结果相符合[15]。
综上所述,全脑放疗联合伽马刀治疗,可有效地降低损伤,预防新病灶的出现,缩小转移瘤的体积,二者相结合,可互补彼此的弱点,共同提高控制肿瘤的疗效,并且促使脑损伤降低至最低程度。
[1] 武智刚,王 千,吴铁鹰,等.旋转式头部伽玛刀治疗脑转移瘤171例临床分析〔J〕.中华神经外科疾病研究杂志,2013,12(6):540-542.
[2] 刘才兴,石松生,杨卫忠,等.姑息性伽玛刀治疗老年脑转移瘤〔J〕.中华神经医学杂志,2012,11(8):792-795.
[3] 师 娟,杜美翠,陈琬玲,等.全脑三维适形放疗联合伽玛刀治疗肺癌脑转移瘤患者的护理〔J〕.中国实用护理杂志,2013,29(1):50.
[4] 王建军,陈绍华,李国明,等.伽玛刀联合吉非替尼治疗非小细胞肺癌脑转移瘤的疗效分析〔J〕.国际呼吸杂志,2016,36(8):576-579.
[5] 钱学江,张磊华,刘中冲,等.T1 WI-FLASH 3D+MT 双倍钆剂增强扫描在脑转移瘤伽玛刀立体定位中的价值〔J〕.实用放射学杂志,2015,31(7):1227-1228.
[6] 郭 琪,张雪宁,吴梦琳,等.基于MRS的脑转移瘤伽玛刀疗效分析〔J〕.中国临床医学影像杂志,2015,26(1):9-13.
[7] 汤旭群,江 华,魏立晨,等.伽玛刀同步贝伐珠单抗治疗伴广泛脑水肿的结直肠癌脑转移瘤:5例病例报道〔J〕.中国微侵袭神经外科杂志,2016,21(6):258-261.
[8] 高红祥,张晓智,党亚正,等.伽玛刀治疗非小细胞肺癌脑转移瘤预后指标评价〔J〕.西部医学,2015,27(9):1344-1348.
[9] 王嘉嘉,梁军潮,伍犹梁,等.伽玛刀联合替莫唑胺治疗脑转移瘤的假性进展1例〔J〕.中国微侵袭神经外科杂志,2015,20(6):279-280.
[10] Chinot O L,Barrie M,Frauger E,et al.Phase II study of temozolomide without radiotherapy in newly diagnosed glioblastoma multiforme in an elderly populations〔J〕.Cancer,2004,100(10):2208-2214.
[11] Gerosa M,Nicolato A,Foroni R,et al.Gamma knife radio surgery for brain metastases:a primary ther apeutic option〔J〕.J Neurosurgery,2002,97(5):515-524
[12] Lee DW,Shin DY,Jin WK,et al.Additional prognostic role of EGFR activating mutations in lung adenocarcinoma patients with brain metastasis:integrating with lung specific GPA score〔J〕.Lung Cancer,2014,86(3):363-368.
[13] Leone JP,Lee AV,Brufsky AM.Prognostic factors and survival of patients with brain metastasis from breast cancer who underwent craniotomy〔J〕.Cancer Med,2015,4(7):989-994.
[14] Gerdan L,Segedin B,Nagy V,et al.Brain metastasis from non-small cell lung cancer(NSCLC):prognostic importance of the number ofinvolved extracranial organs〔J〕.Strahlenther Onkol,2014,190(1):64-67.
[15] Bae MK,Yu WS,Byun GE,et al.Prognostic factors for cases with no extracranial metastasis in whom brain metastasis is detected after resection of non-small cell lung cancer〔J〕.Lung Cancer,2015,88(2):195-200.

