非诺贝特对DDC诱导的原发性硬化性胆管炎模型小鼠的预防作用及机制
林韩特,代曼云,华慧英,徐港铭,罗怡爽,刘爱明
(宁波大学医学院生理药理学系,浙江 宁波315211)
胆汁淤积是由于受环境、遗传、药物和生物性因素影响导致的胆汁形成、分泌和排泄异常,进一步发展可演变为肝纤维化、肝硬化和肝癌等一系列胆汁淤积性肝病。常见的胆汁淤积性肝病主要包括原发性胆汁性肝硬化、原发性硬化性胆管炎(primary sclerosing cholangitis,PSC),及各型病毒性肝炎所致胆汁淤积性肝病[1-2],其中PSC以胆管周围炎症和胆汁淤积为病理特征,可能的发病机制是病毒、细菌或药物等诱导的炎症和胆管疾病以及少数遗传免疫问题。国内外对PSC发病机制和防治措施的研究较少,3,5-二乙氧基羰基-1,4-二氢-2,4,6-三甲基吡啶(3,5-diethoxycarbonyl-1,4-dihydrocollidine,DDC)诱导的胆汁淤积性肝病被认为更符合PSC的病理特征[3-5],可用于PSC动物模型的复制。
非诺贝特(fenofibrate)是过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor α,PPARα)激动剂,是临床治疗高脂血症的一线经典药物,其应用历史已有五十余年。该药临床治疗高脂血症的剂量为每天150~300 mg,在梗阻性黄疸肝损伤大鼠和原发性胆汁性肝硬化小鼠等胆汁淤积性肝病模型中,非诺贝特防治剂量多为50~200 mg·kg-1[6-8]。近年来发现,非诺贝特还可通过NF-κB等通路发挥抗炎作用[9],但PPARα在低剂量非诺贝特抗炎中的作用特征与规律尚不明确。
本研究室前期研究发现,每天2次ig给予非诺贝特25 mg·kg-1,预防给药3 d能抑制JNK炎症通路,有效预防α-荼基异硫氰酸盐诱导的小鼠原发性胆汁性肝硬化,而高剂量(125 mg·kg-1)或低剂量(5 mg·kg-1)下均无效[10]。鉴于炎症反应在PSC发病过程中发挥重要作用,本研究拟以非诺贝特25 mg·kg-1,每天2次的给药方案,观察其对DDC诱导PSC的预防作用,为临床治疗胆汁淤积性肝病提供新的思路。
1 材料与方法
1.1 药品、试剂和仪器
非诺贝特(湖南千金湘江药业,C1603027,纯度≥99%);玉米油(上海阿拉丁);DDC(STBG4282,纯度99%,美国Sigma公司);Trizol(美国Ambion-Invitrogen公司);逆转录试剂和定量PCR试剂(北京康为世纪生物科技公司);定量PCR仪(LightCycle 480,瑞士Roche公司);谷草转氨酶(glutamic-oxaloacetic transaminase,GOT,2017041201)、谷丙转氨酶(glutamic-pyruvictransaminase,GPT,2017042001)、碱性磷酸酶(alkalinephosphatase,ALP,2017092501)、总胆汁酸(total bile acid,TBA,2017090801)、总胆红素(total bilirubin,TBIL,2017021601)和直接胆红素(direct bilirubin,DBIL,2017022001)检测试剂盒(宁波瑞源生物科技有限公司);显微镜(BX43,日本奥林巴斯公司)。
1.2 动物
129/Sv背景的Pparα基因敲除型小鼠,从美国国立癌症研究院引进,获得了在国内繁殖和使用授权,并在宁波大学动物房与野生型进行杂交和纯化,获得相同遗传背景的野生型和全身Pparα基因敲除型小鼠(动物合格证号2015000552973),体质量21~25 g,饲养于宁波大学实验中心SPF环境中,室温21~25°C,湿度40%~70%,12 h昼夜循环,自由饮水摄食。
1.3 动物分组、造模和药物处理
将健康雌性野生型和Ppara基因敲除型小鼠各20只分别随机分为4组,每组5只。非诺贝特对照组和非诺贝特预防组连续10 d每天2次ig非诺贝特25 mg·kg-1,PSC模型组则给予溶剂玉米油(据文献报道,玉米油对炎症和胆汁酸代谢无影响[11-12]);给药第4~10天,PSC模型组和非诺贝特预防组连续食饲含0.1%DDC的饲料诱导PSC,非诺贝特对照组和正常对照组正常饲养。
1.4 生化法检测血清中肝功能指标
末次给予非诺贝特24 h后,小鼠摘除眼球取血,将血液样本4℃,1500×g离心15 min分离血清,-80℃冰箱保存。检测时,将血清样本置于冰上,按照试剂盒说明书采用速率法或终点法检测小鼠血清中GOT,GPT,ALP,TBA,TBIL和DBIL含量。
1.5 HE染色观察肝组织病理变化
小鼠取血后处死,切取1/2肝大叶(其余肝组织-80℃保存)置10%甲醛溶液中固定48 h后,经常规石蜡包埋,制成4 μm连续切片,常规HE染色后用树脂胶封片,显微镜观察肝病理形态学变化。
1.6 RT-qPCR检测肝组织胆汁酸代谢与转运、炎症及细胞凋亡相关基因mRNA水平
取肝组织20 mg加入Trizol 500 μL匀浆,加入氯仿50 μL,4℃,13 000×g离心15 min后提取上层液,加入异丙醇50 μL沉淀,弃上清后加入75%乙醇(无RNA酶水配制)洗涤,加入适量DEPC水溶解提取总RNA。取总RNA 1 μg,加入逆转录试剂,普通PCR仪中反应合成模板cDNA,于-20℃保存备用。取模板cDNA 1 μL,反应混合物5 μL,上下游引物各0.2 μL,DEPC水3.6 μL,组成10 μL的反应体系,在PCR仪中先95℃预变性10 min;再经95℃变性10 s,60℃退火30 s和72℃延伸32 s共40个循环。反应结束后,PCR仪自动分析并计算结果。以18S rRNA作为内参,用得到的各基因的扩增效率和各样本的Ct值,采用2-△△Ct相对定量法计算基因的相对转录水平。引物序列见表1。
1.7 统计学分析
实验结果数据以x±s表示,采用GraphPad 7.03软件做图,用SPSS 17.0软件进行统计学分析,用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 非诺贝特对DDC诱导的PSC模型小鼠血清生化指标的影响
血清生化指标检测结果(图1)显示,在野生型和Pparα基因敲除型小鼠中,模型组GPT,GOT TBA,ALP,TBIL和DBIL水平均显著升高(P<,Cyp7a1:cholesterol 7α hydroxylase;Cyp8b1:sterol 12α-hydroxylase;Oatp1:organic anion transporting polypeptide 1;Ntcp:Na+-taurocholate cotransporting polypeptide;Bsep:bile salt export pump;Mdr1α:multidrug resistance 1α;Ostβ:organic solute transporter β;IL-1β:interleukin-1β;Tnf-α:tumor necrosis factor-α;Socs3:suppressor of cytokine signaling;18S rRNA:18S ribosomal RNA.0.01),分别升高至相应正常对照组的48,26,28,15,58和112倍(野生型),及10,8,20,4,20和62倍(基因敲除型),表明2种基因型小鼠出现肝细胞损伤和肝内胆汁淤积,提示DDC诱导小鼠PSC模型复制成功。在野生型小鼠中,非诺贝特预防组上述指标水平分别较模型组降低了96%,96%,91%,60%,98%和99%(P<0.01),提示肝细胞受损和肝内胆汁淤积得到改善;而在基因敲除型小鼠中,非诺贝特预防组对上述指标无降低作用。2种基因型小鼠非诺贝特对照组以上指标与正常对照组无明显差异。

Tab.1 Sequence of primers
2.2 非诺贝特对DDC诱导的PSC模型小鼠肝组织病理改变的影响
如图2所示,野生型和基因敲除型正常对照组小鼠肝外观正常,无坏死,无炎症细胞浸润;2种基因型小鼠模型组肝肿胀,淤血,胆汁淤积颜色深;肝组织内大面积细胞染色加深,呈嗜酸性病变,胆管周围可见大量炎症细胞浸润,肝细胞局灶性坏死,提示DDC诱导PSC模型成功。野生型小鼠预防组肝组织坏死灶和炎症细胞浸润较模型组减少。而基因敲除型小鼠预防组肝组织病理变化未见明显改善。2种基因型小鼠非诺贝特组肝组织结构均未见明显病理改变。
2.3 非诺贝特对DDC诱导的PSC模型小鼠肝组织胆汁酸代谢与转运相关基因mRNA水平的影响
RT-qPCR检测结果(图3)显示,在野生型小鼠中,模型组肝组织胆汁酸合成相关酶固醇12α羟化酶(Cyp8b1),胆汁酸相关摄取蛋白钠离子-牛磺胆酸协同转运多肽(Ntcp)和有机阴离子转运多肽1(Oatp1)mRNA表达较正常对照组分别降低95%,60%和87%(P<0.01);胆汁酸外排相关多药耐药蛋白Mdr1α和Mdr2以及有机溶质转运体β(Ostβ)和多药耐药蛋白Mrp4 mRNA表达水平较正常对照组分别升高90%和69%,80%和52%(P<0.01)。在基因敲除型小鼠模型组和正常对照组中,上述指标的变化趋势与野生型小鼠一致。野生型小鼠中,预防组Cyp8b1和Ntcp mRNA表达较模型组分别上调了10和1.04倍(P<0.05),Mdr1α,Mdr2和Ostβ mRNA表达水平下调64%,59%和90%(P<0.01),而在基因敲除型小鼠中上述指标均无明显改变。在基因敲除型小鼠中,非诺贝特对照组Cyp8b1 mRNA表达水平较正常对照组升高(P<0.05),其他指标均无显著改变。
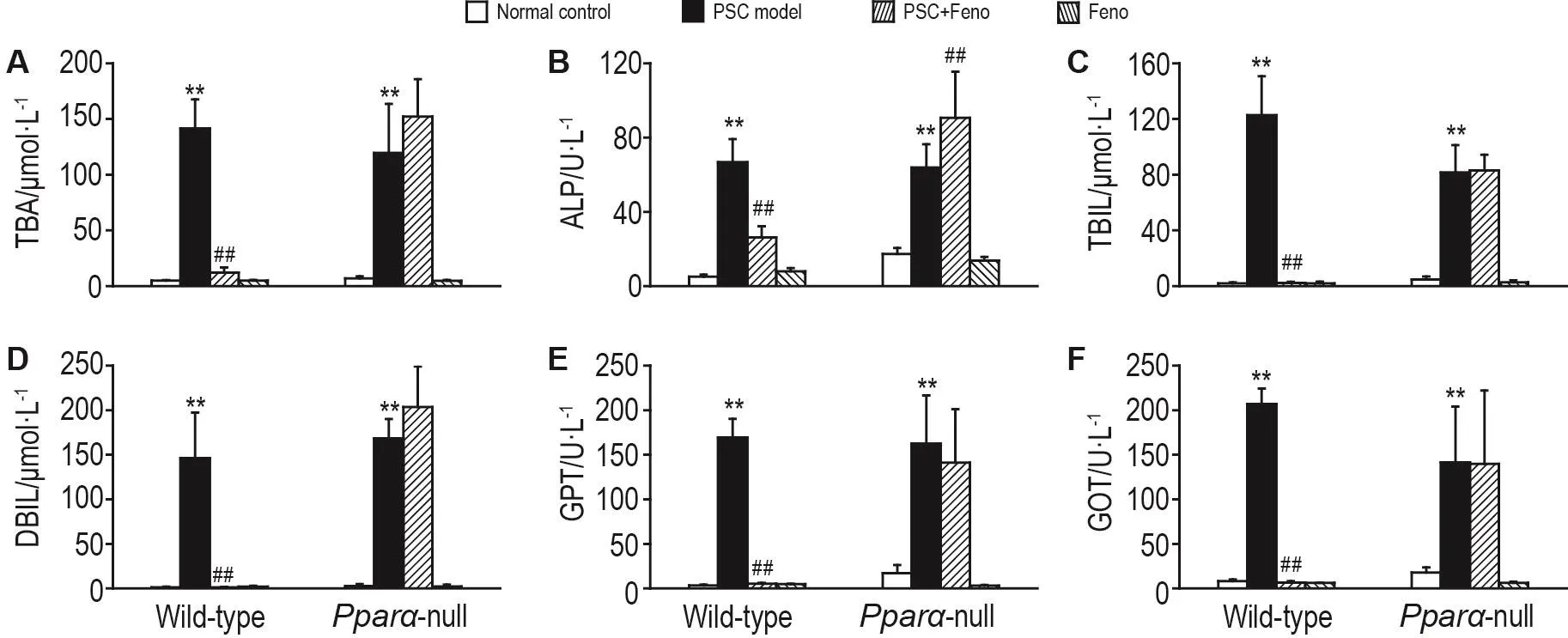
Fig.1 Effect of fenofibrate(Feno)on levels of total bile acid(TBA,A),alkaline phosphatase(ALP,B),total bilirubin(TBlL,C),direct bilirubin(DBlL,D),glutamic-pyruvictransaminase(GPT,E)and glutamic-oxaloacetictransaminase(GOT,F)in serum of mice with 3,5-diethoxycarbonyl-1,4-dihydrocollidine(DDC)-induced primary sclerosing cholangitis(PSC).Twenty female wild-type mice and Ppara-null mice were divided into normal control group,PSC model group,PSC+Feno group,and Feno group,respectively.Mice in PSC+Feno group and Feno group were treated with Feno 25 mg·kg-1twice per day for 10 d,and in PSC model group were ig given corn oil.Mice in PSC model group and PSC+Feno group were fed with 0.1%DDC-supplemented diet during the 4th-10thday,and in normal control group and Feno group were fed with normal commercial diet.x±s,n=5.**P<0.01,compared with normal control group;##P<0.01,compared with PSC model group.
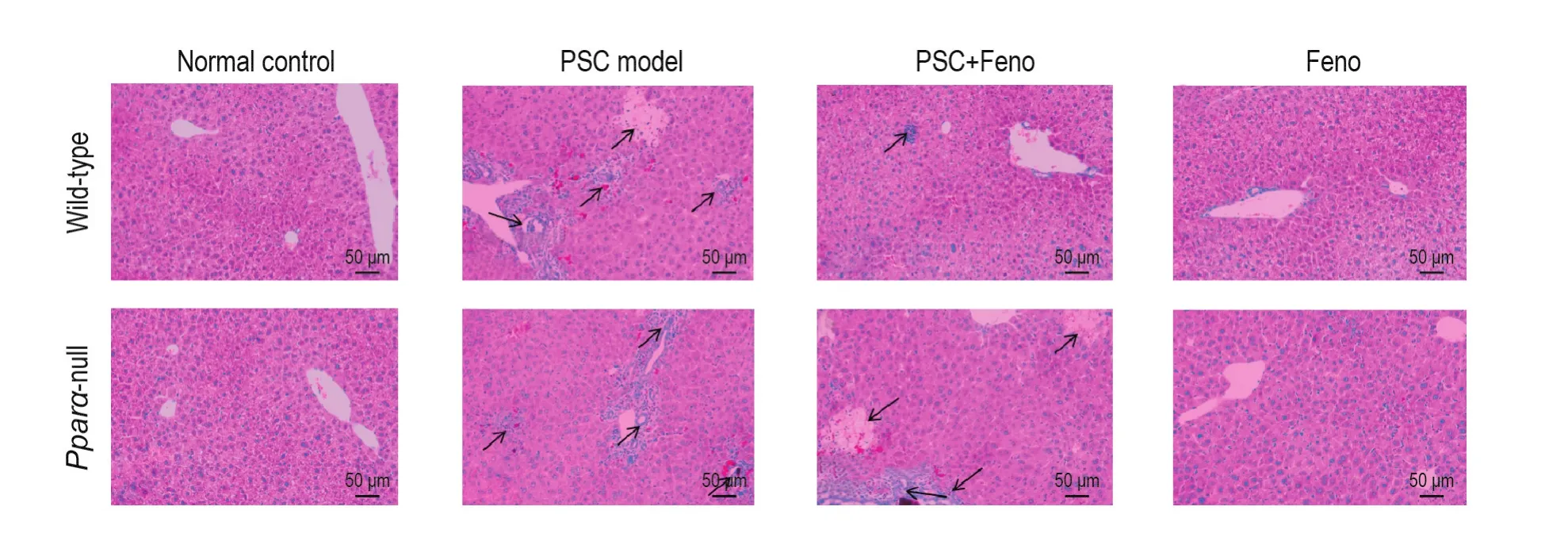
Fig.2 Effect of Feno on histopathological changes in hepatocytes of mice with DDC-induced PSC(HE staining).See Fig.1 for the mouse treatment.The arrows show lesion locations.
2.4 非诺贝特对DDC诱导的PSC模型小鼠肝组织炎症相关基因mRNA水平的影响
实验结果(图4)显示,在野生型小鼠中,与正常对照组相比,模型组小鼠肝组织白细胞介素1β(IL-1β),IL-2,IL-6,IL-10,Socs3,c-Fos和c-Jun mRNA表达水平分别升高4,5,5,6,3,27和13倍(P<0.05,P<0.01);与模型组比较,预防组小鼠的上述基因mRNA表达水平分别下降了80%,85%,90%,77%,70%,95%和75%(P<0.01)。在基因敲除小鼠中,模型组小鼠肝组织IL-1β,Socs3,c-Fos和c-Jun表达水平较正常对照组显著升高(P<0.05,P<0.01);而与模型组比较,预防组小鼠上述基因mRNA表达水平未见明显改变。在2种基因型小鼠中,非诺贝特组上述指标与正常对照组均无明显变化(图4)。
2.5 非诺贝特对DDC诱导的PSC模型小鼠肝组织凋亡相关基因mRNA水平的影响
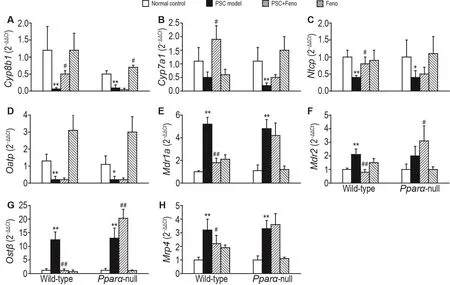
Fig.3 Effect of Feno on mRNA levels of Cyp8b1(A),Cyp7a1(B),Ntcp(C),Oatp1(D),Mdr1α(E),Mdr2(F),Mrp4(G)and Ostβ(H)in mice with DDC-induced PSC.See Fig.1 for the mouse treatment.x±s,n=5.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with PSC model group.
实验结果(图5)显示,在野生型和基因敲除型小鼠中,模型组凋亡相关基因Bcl-2和Bax mRNA表达水平较正常对照组显著升高(P<0.01,P<0.05)。在野生型小鼠中,非诺贝特预防组以上基因表达水平较模型组显著降低(P<0.01);而在基因敲除型小鼠中无此效应。Bcl-xl mRNA表达水平的变化趋势与Bcl-2和Bax一致,但在野生型小鼠中差异无统计学意义。在2种小鼠中,非诺贝特组上述3种凋亡相关基因表达水平均与正常对照组无显著差异。

Fig.4 Effect of Feno on mRNA levels of IL-1 β(A),IL-2(B),IL-6(C),IL-10(D),Tnf-α(E),Socs3(F),c-Fos(G)and c-Jun(H)in mice with DDC-induced PSC.See Fig.1 for the mouse treatment.n=5.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with PSC model group.
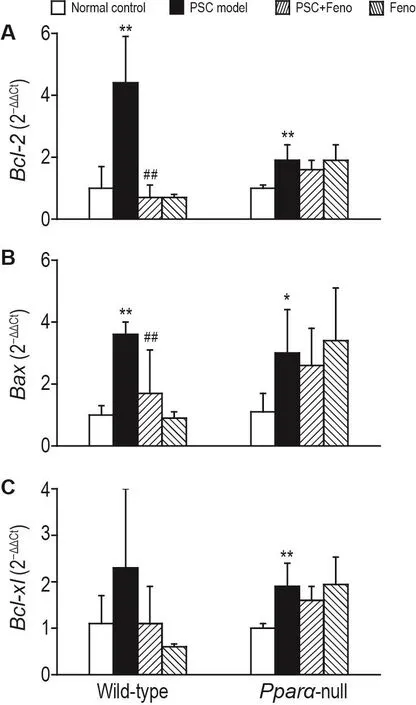
Fig.5 Effect of Feno on mRNA levels of Bcl-2(A),Bax(B)and Bcl-xl(C)in mice with DDC-induced PSC.See Fig.1 for the mouse treatment.s,n=5.*P<0.05,**P<0.01,compared with normal control group;##P<0.01,compared with PSC model group.
3 讨论
本研究采用DDC食饲法诱导PSC小鼠模型。模型组小鼠血清GOT,GPT,TBA,ALP,TBIL和DBIL水平明显升高;肝肿胀;经HE染色,光镜下可见胆管周围大量炎症细胞浸润和肝细胞局灶性坏死。上述结果表明,食饲DDC方法可成功诱导小鼠PSC,与文献报道结果一致[13-14]。本研究中小鼠PSC造模成功率为100%。
炎症反应是PSC的典型特征,在全氟癸酸(perfluorodecanoic acid)诱导胆汁淤积模型小鼠的研究中,提示PPARα同时具有致炎和抗炎双向作用[15]。本研究发现,PSC模型组NF-κB炎症信号通路激活,IL-1β,IL-2,IL-6和IL-10 mRNA表达增加,与文献报道基本一致[9];此外,STAT3通路和JNK通路也不同程度地参与了DDC诱导PSC炎症的发生。野生型模型组小鼠炎症因子IL-2,IL-6,IL-10,c-Fos和c-Jun mRNA表达水平高于基因敲除型模型组,提示PPARα可能介导并加重PSC的炎症,但2种基因型小鼠的模型组在血清生化指标上无明显差异。非诺贝特预防组小鼠转氨酶(GPT和GOT)和炎症因子mRNA表达在野生型小鼠中下降,而在基因敲除型小鼠中保持不变,提示非诺贝特基于PPARα对PSC产生抗炎作用。
胆汁酸代谢和转运平衡是胆汁淤积性肝病发生的重要环节,有文献报道,PPARα既可介导破坏胆汁酸合成、代谢和转运的平衡,又可维持胆汁酸稳态[16-17]。Cyp7a1和Cyp8b1等CYP酶是胆汁酸合成代谢的关键酶。有研究报道,PPARα可通过调控其表达影响胆汁酸代谢稳态[18]。也有文献报道,PPARα在雌性小鼠体内表达水平较雄性低,可能会下调CYP酶的表达[19],因此本研究使用了雌性野生型和Pparα敲除型小鼠,以观察PPARα对雌性PSC小鼠胆汁酸代谢稳态的影响。研究结果显示,2种小鼠正常对照组Cyp7a1和Cyp8b1 mRNA表达无明显差异,其他胆汁酸代谢酶基因mRNA表达亦无明显差异,提示在雌性小鼠中,Pparα基因敲除对胆汁酸代谢关键酶Cyp7a1和Cyp8b1基因表达无明显影响。在2种小鼠中,PSC模型组均表现出血清生化指标TBA,ALP,TBIL和DBIL升高及胆汁酸代谢和转运相关基因mRNA表达异常,提示在DDC诱导PSC过程中破坏了胆汁酸稳态,且该作用并不受PPARα调控。在野生型小鼠中,非诺贝特预防组可通过上调胆汁酸合成(Cyp7a1)和转运(Ntcp)相关基因,下调胆汁酸外排相关基因(Mdr1α,Mdr2,Mrp4和Ostβ)基本恢复胆汁酸稳态;而在基因敲除型小鼠中,非诺贝特预防组的上述代谢和外排基因表达未发生改变。提示非诺贝特能作用于胆汁酸代谢和转运的代偿调控,且该作用依赖于PPARα的介导。
综上所述,非诺贝特可通过恢复胆汁酸的正常代谢,减轻胆管周围炎症反应,减少肝组织损伤,预防DDC诱导的PSC,且其维持胆汁酸稳态和抗炎作用由PPARα介导。本研究结果提示,非诺贝特对预防和治疗胆汁淤积性肝病具有良好的应用前景。

