PPARα调控SOD2表达的机制研究
杨锡彤,秦 燕,杜小珊,徐弘扬,王光明*
(1.大理大学基础医学院,云南大理 671000;2.大理大学第一附属医院,云南大理 671000)
PPAR(过氧化物酶体增殖物激活受体)是一类由配体激活的核转录因子,属于核激素受体超家族成员之一,包括α,β,γ 3种亚型,均具有调节靶基因表达的功能〔1〕。非诺贝特是PPARα的配体,因能降低甘油三脂和胆固醇而在临床上作为降脂药物广泛使用〔2〕。而近年研究表明,贝特类药物除降脂作用外,还是PPARα的激动剂〔3〕。PPARα的配体包括Clofibrate、Gemfibrozil、Wy14634和非诺贝特等,除了降脂作用外还有抗炎和抗氧化作用等〔4〕。SODs是ROS(活性氧)防御系统中最原始也是最重要的抗氧化酶〔5〕。SODs 包括SOD1(Cu∕Zn-SOD)、SOD2(Mn-SOD)、SOD3(ecSOD)3种亚型,其中SOD2作为辅因子存在于需氧细胞的线粒体内,其物理结构由5个外显子和4个内含子构成。SOD2以同源四聚体存在,在促进细胞分化和肿瘤发生过程中起重要的作用,并能防止氧过多而引起的肺毒性作用〔6〕。
前期研究表明,小鼠在脑缺血状态下,SODs的表达下降,但经过PPARα的激动剂非诺贝特或Wy14643处理后,SODs表达明显升高〔7-8〕,从而非诺贝特和Wy14643能起到保护神经的作用,但是目前非诺贝特或Wy14643如何影响SODs的表达其机制尚不清楚。因此在2013年3月至2016年5月本研究通过在细胞水平,利用培养的BMEC经非诺贝特处理后,用实时荧光定量PCR的方法检测非诺贝特是否影响PPARα和SOD2的表达;利用C57BL∕6小鼠经非诺贝特处理,分离脑微血管,用实时荧光定量PCR的方法检测非诺贝特是否在动物水平影响PPARα和SOD2的表达;用pGL4 mSOD2(含SOD2基因启动子序列)或pGL4 mu mSOD2(含SOD2基因启动子中PPRE结合区域突变)荧光素酶报告质粒,BMEC经过转染后用非诺贝特处理,检测BMEC中的荧光素酶活性,以研究非诺贝特如何调节SOD2的表达。
1 材料和方法
1.1 实验动物和主要试剂15只6~8周龄的雄性C57BL∕6小鼠(湖南斯莱克景达实验动物有限公司,合格证号:SCXK2016(湘)0002);CMC(羧甲基纤维素,Sigma公司);DMSO(二甲基亚砜,Sigma公司);非诺贝特(Sigma公司);lipofectamine2000引物合成,总RNA提取试剂盒、cDNA合成试剂盒和定点突变试剂盒均由Invitrogen公司(Carlsbad,CA)提供,实时荧光定量PCR试剂盒购自Bio-Rad公司(Richmond,CA),荧光素酶报告系统购自Promega公司(Madison,WI),BMEC细胞购自北京钧尧伟业生物科技有限公司(CRL-3245),其余试剂未作特殊说明均来自Sigma公司。
1.2 细胞培养及非诺贝特处理BMEC生长在含10%的胎牛血清、100 IU∕mL青霉素和链霉素的F12培养基中,在37℃、5%CO2饱和湿度培养箱中培养,每3~4天传代1次,5~6代用于实验。细胞传代后,当细胞生长到培养皿底部的70%~80%,换不含血清和双抗的F12培养基过夜处理,第2天加入终浓度为10 μg∕mL的非诺贝特(溶解于DMSO中)处理12 h(实验组),对照组用同等体积的DMSO处理。收获细胞,提取总RNA。
1.3 C57BL∕6小鼠的处理雄性C57BL∕6小鼠购买回来后,随机分为2组,实验组7只,在试验中给予Feno干预;对照组(8只)用制作非诺贝特混悬液的试剂CMC处理。为适应环境,在大理大学动物中心饲养1周,然后灌胃给药,分别给予30 mg∕kg Feno、10 mL∕kg 5%CMC混悬液处理,连续给药7 d,每次给药时间均控制在上午8:00—8:30间。在第7天给药30 min内处死小鼠,取脑组织置于4℃的PBS(pH 7.4)中分离脑微血管用于后续实验。
1.4 脑微血管的分离按照参照文献〔7〕介绍的方法分离小鼠脑微血管,上述脑组织去除脑膜后在3 mL的0.1 mol∕L PBS中匀浆,4 ℃、2 000 g离心5 min,沉淀物用3 mL 0.1 mol∕L PBS混悬后在混悬液的上方加入5 mL的15%右旋糖苷溶液(0.1 mol∕L PBS配制)中,4℃、3 500 g离心35 min后,沉淀物用冷的0.1 mol∕L PBS混悬,过孔径为40 μm的尼龙膜,收获尼龙膜上方的部分即为脑微血管,提取总RNA。
1.5 实时荧光定量PCR检测PPARα和SOD2的表达为了在细胞水平和动物水平阐明非诺贝特对SOD2表达的影响及是否激活PPARα,从非诺贝特处理的BMEC和非诺贝特处理的小鼠脑微血管提取总RNA,并反转录为cDNA。总RNA的提取和反转录总RNA为cDNA均依照Invitrogen公司的RNA提取试剂盒和cDNA合成试剂盒说明书进行,然后用Bio-Rad公司的iQ SYBR Green试剂盒进行检测,反应体系为50 μL,其中cDNA 2 μL,SYBR Green混合物25 μL,引物各0.5 μL,其余用DEPC处理的水补齐50 μL。反应条件为95℃预变性10 min,然后95 ℃ 10 s,55 ℃ 10 s,72 ℃ 10 s,35个循环。PPARα、SOD2和内参18 s的引物序列见表1。

表1 PCR扩增及克隆用引物
1.6 含SOD2启动子的荧光素酶报告质粒的构建通过网上数据库:http:∕∕genome.ucsc.edu∕index.html,调取小鼠SOD2基因的启动子序列,设计引物,用小鼠的基因组DNA为模板进行PCR扩增,PCR产物插入pGL4.10 Luciferase Reporter Vectors中,得到含SOD2启动子序列的荧光素酶报告质粒pGL4mSOD2。
1.7 含SOD2启动子的荧光素酶报告质粒的定点突变在1 633至1 660碱基序列中,有PPAR的结合位点;序列为cgttggGGTCagagtccccgttgtttct,根据该序列及突变试剂盒的说明书,设计用于突变的引物,然后利用点突变试剂盒,把GGTC突变为CCAG,插入pGL4 Luciferase Reporter Vectors中,可得到含突变的SOD2启动子序列的荧光素酶报告质粒pGL4 mu mSOD2。
1.8 荧光素酶活性检测为了阐明PPARα对SOD2表达的调节作用,以pGL4.74所携带的荧光素酶信号为内参,pGL4 mSOD2携带的信号为目的信号。为了排除细胞数量的差异,用内参信号对目的信号进行同一化处理。本研究用含SOD2启动子序列的荧光素酶报告质粒pGL4 mSOD2与pGL4.74用lipofectamine2000共转染BMEC,转染24 h后用最终浓度为10 μg∕mL的非诺贝特处理12 h,收获细胞后按照试剂盒说明检测细胞中的荧光素酶活性;为了进一步研究PPARα通过与SOD2基因启动子上的PPRE结合以调节SOD2的表达,本研究用pGL4 mu mSOD2与pGL4.74共转染BMEC,24 h后经10 μg∕mL的非诺贝特处理12 h,收获细胞检测细胞中的荧光素酶活性。
1.9 统计学分析PPARα和SOD2 mRNA表达数据进行t检验,荧光素酶活性用SPSS 10.0统计软件进行one-way ANOVA分析,并进行Scheffe post hoc统计学分析。
2 结果
2.1 BMEC中PPARα和SOD2的表达BMEC给予10 μg∕mL的非诺贝特刺激12 h后,提取总RNA,逆转录总RNA为cDNA,荧光定量PCR检测结果表明PPARα和SOD2的表达明显升高(P<0.01)。见图1~2。
BMEC给予非诺贝特处理12 h后,PPARα的表达升高;C57BL∕6经连续灌胃给非诺贝特7 d后,分离脑组织中的微血管成分,实时荧光定量PCR检测PPARα的表达升高。
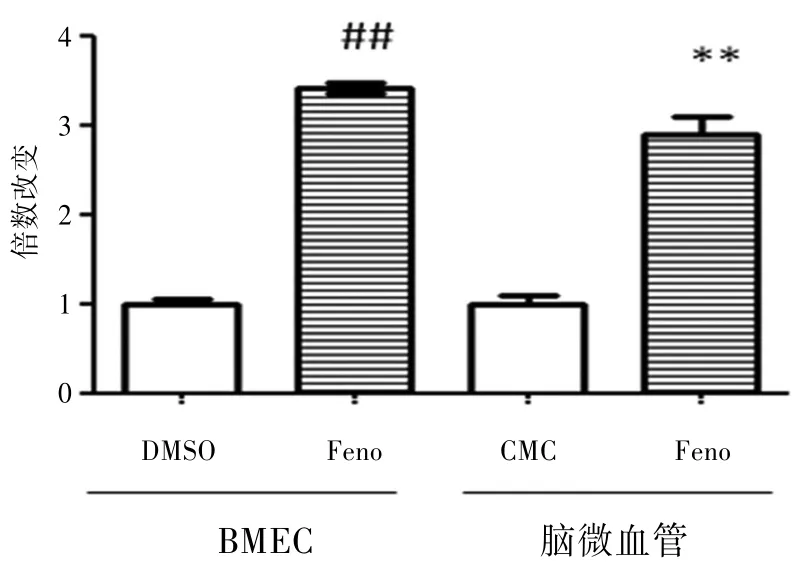
图1 PPARα的表达图
2.2 C57BL∕6小鼠脑微血管中PPARα和SOD2的表达C57BL∕6小鼠灌胃给予30 mg∕kg体重的非诺贝特处理7 d后,其脑微血管中PPARα和SOD2的表达明显升高(P<0.01)。见图1~2。BMEC给予非诺贝特处理12 h后,SOD2的表达升高;C57BL∕6经连续灌胃给非诺贝特7 d后,分离脑组织中的微血管成分,实时荧光定量PCR检测SOD2的表达升高。

图2 SOD2的表达图
2.3 荧光素酶活性变化BMEC转染pGL4.74和pGL4 mSOD2或pGL4 mu mSOD2 24 h后,BMEC给予10 μg∕mL的非诺贝特处理12 h,测定荧光素酶的活性,结果发现非诺贝特能够增强pGL4 mSOD2的活性(P<0.01),但是把SOD2基因启动子中PPRE结合序列的关键碱基突变后,即使给予非诺贝特刺激,pGL4 mu mSOD2的活性没有明显的改变。
BMEC共转染pGL4.74和pGL4 mSOD2后,给予非诺贝特刺激,荧光素酶活性增强;当SOD2启动子区与PPRE结合的关键碱基突变后,即使给予非诺贝特刺激,荧光素酶活性也并未改变。见图3。

图3 荧光素酶活性检测图
3 讨论
PPARα主要分布在代谢活跃的组织中,例如肝脏、肾脏和心脏,其作用主要是调节脂肪酸的代谢〔9-10〕。另外,PPARα在脑组织中也广泛表达,在小鼠I∕R(缺血∕再灌注)损伤中可以抑制NOX的表达和减少氧自由基ROS的含量〔11〕以保护由于I∕R引起的损伤。非诺贝特和Wy-14643,都作为PPARα的配体,能导致过氧化物酶体的增殖和肝脏肿大。近年来的研究表明PPARα可作为部分抗氧化酶的一种表达促进剂,例如过氧化氢酶、超氧化物歧化酶(SODs)和抗炎介质〔12〕。
体内的ROS主要来源于还原型辅酶Ⅱ(NADPH oxidase)等的作用,而ROS的清除主要依赖于SODs〔13〕。有研究表明,在心脏、胃、小肠、脑、视网膜等组织缺血过程中,ROS的含量升高〔14-16〕。Boshra等〔17〕在研究肝脏缺血-再灌注损伤时发现非诺贝特可以促进SODs的表达以降低ROS含量而对肝脏缺血∕再灌注损伤进行保护;Ibarra-Lara等〔18〕在心肌缺血损伤时也发现非诺贝特的类似物Clofibrate也具有相似的功能;同样的保护机制在其他脏器的缺血∕再灌注损伤的研究中得到进一步证实〔19-20〕,说明非诺贝特可能具有调节SODs表达的功能。而我们前期研究发现给予非诺贝特处理后,缺血小鼠脑组织中的ROS含量降低,进一步研究发现PPARα的表达、SOD2含量及SODs活性升高,结合PPARα作为核转录因子的功能,进一步说明非诺贝特可能是通过促进PPARα的表达以影响SOD2在体内的含量及其活性,以维持ROS在体内含量的相对稳定,从而在缺血∕再灌注损伤起保护作用。
为了进一步阐明非诺贝特调节SOD2的机制,本研究用体外实验BMEC经非诺贝特处理和体内实验C57BL∕6小鼠给予非诺贝特处理后分离脑组织中的微血管,其PPARα和SOD2的表达均升高,说明非诺贝特可以促进PPARα和SOD2的表达;进一步用SOD2基因启动子序列构建的荧光素酶报告质粒转染细胞后,经非诺贝特刺激,可以导致荧光素酶活性升高,说明非诺贝特调控SOD2的表达依赖于非诺贝特与SOD2基因间可能存在某种联系;而当SOD2基因启动子上PPRE结合序列的关键碱基发生突变后,即使给予非诺贝特刺激,pGL4 mu mSOD2的活性几乎没有改变,即由于SOD2基因启动子上的PPRE与PPARα结合的碱基发生突变,导致PPARα无法与SOD2基因启动子上的PPRE结合,从而非诺贝特激活SOD2基因启动子活性的作用消失,说明非诺贝特调节SOD2的表达依赖于PPARα与SOD2基因启动子区域上的PPRE结合,结合体内和体外实验研究得到非诺贝特具有促进PPARα和SOD2的表达功能,说明非诺贝特对SOD2表达的调控作用依赖于激活的PPARα结合到SOD2基因启动子的PPRE区域以促进SOD2基因启动子的活性,从而促进SOD2的表达。
[参考文献]
〔1〕江珊,李萍,李彦.过氧化物酶体增殖物激活受体的心血管保护作用〔J〕.中国现代医学杂志,2012,22(16):58-62.
〔2〕BALFOUR J A,MCTAVISH D,HEEL R C.Fenofibrate:A review of its pharmacodynamic and pharmacokinetic prop⁃erties and therapeutic use in dyslipidaemia〔J〕.Drugs,1990,40(2):260-290.
〔3〕赵晓燕,苏金林,温旭凯,等.非诺贝特对慢性心力衰竭患者心肌纤维化和心功能的影响〔J〕.中国现代医学杂志,2013,23(29):46-50.
〔4〕张元元,李正金,赵立仙,等.Fenofibrate与Apocinin在脑缺血中神经保护作用的机制〔J〕.广东医学,2015,36(16):2491-2494.
〔5〕LIOU W,CHANG L Y,GEUZE H J,et al.Distribution of CuZn superoxide dismutase in rat liver〔J〕.Free Radic Biol Med,1993,14(2):201-207.
〔6〕ST CLAIR D K,OBERLEY T D,MUSE K E,et al.Expres⁃sion of manganese superoxide dismutase promotes cellular differentiation〔J〕.Free Radic Biol Med,1994,16(2):275-282.
〔7〕WANG G,LIU X,GUO Q,et al.Chronic treatment with fi⁃brates elevates superoxide dismutase in adult mouse brain microvessels〔J〕.Brain Res,2010,1359:247-255.
〔8〕WANG G,NAMURA S.Effects of chronic systemic treat⁃ment with peroxisome proliferator-activated receptor α acti⁃vators on neuroinflammation induced by intracerebral injec⁃tion of lipopolysaccharide in adult mice〔J〕.Neurosci Res,2011,70(2):230-237.
〔9〕SCHOONJANS K,WATANABE M,SUZUKI H,et al.In⁃duction of the acyl-coenzyme A synthetase gene by fibrates and fatty acids is mediated by a peroxisome proliferator re⁃sponse element in the C promoter〔J〕.J Biol Chem,1995,270(33):19269-19276.
〔10〕BRAISSANT O,FOUFELLE F,SCOTTO C,et al.Differ⁃ential expression of peroxisome proliferator-activated re⁃ceptors(PPARs):tissue distribution of PPAR-α,-beta,and-gamma in the adult rat〔J〕.Endocrinology,1996,137(1):354-366.
〔11〕GUO Q,WANG G,NAMURA S.Fenofibrate improves ce⁃rebral blood flow after middle cerebral artery occlusion in mice〔J〕.J Cereb Blood Flow Metab,2010,30(1):70-78.
〔12〕RAMANAN S,KOOSHKI M,ZHAO W,et al.PPARα li⁃gands inhibit radiation-induced microglial inflammatory responses by negatively regulating NF-kappaB and AP-1 pathways〔J〕.Free Radic Biol Med,2008,45(12):1695-1704.
〔13〕TANG X N,CAIRNS B,KIM J Y,et al.NADPH oxidase in stroke and cerebrovascular disease〔J〕.Neurol Res,2012,34(4):338-345.
〔14〕SONG J W,KIM H J,LEE H,et al.Protective Effect of Peroxisome Proliferator-Activated Receptorα Activation against Cardiac Ischemia-Reperfusion Injury Is Related to Upregulation of Uncoupling Protein-3〔J〕.Oxidative Medicine and Cellular Longevity,2016,2016:3539649.
〔15〕MORAN E,DING L,WANG Z,et al.Protective and anti⁃oxidant effects of PPARα in the ischemic retina〔J〕.In⁃vest Ophthalmol Vis Sci,2014,55(7):4568-4576.
〔16〕DI PAOLA R,IMPELLIZZERI D,TORRE A,et al.Ef⁃fects of palmitoylethanolamide on intestinal injury and in⁃flammation caused by ischemia-reperfusion in mice〔J〕.J Leukoc Biol,2012,91(6):911-920.
〔17〕BOSHRA V,MOUSTAFA A M.Effect of preischemic treatment with fenofibrate,a peroxisome proliferator-acti⁃vated receptor-α ligand,on hepatic ischemia-reperfusion injury in rats〔J〕.J Mol Histol,2011,42(2):113-122.
〔18〕IBARRA-LARA L,HONG E,SORIA-CASTRO E,et al.Clofibrate PPARα activation reduces oxidative stress and improves ultrastructure and ventricular hemodynamics in no-flow myocardial ischemia〔J〕.J Cardiovasc Pharmacol,2012,60(4):323-334.
〔19〕XUAN A G,CHEN Y,LONG D H,et al.PPARα Agonist Fenofibrate Ameliorates Learning and Memory Deficits in Rats Following Global Cerebral Ischemia〔J〕.Mol Neuro⁃biol,2015,52(1):601-609.
〔20〕SUR A,KESARAJU S,PRENTICE H,et al.Pharmacolog⁃ical protection of retinal pigmented epithelial cells by su⁃lindac involves PPAR-α〔J〕.Proc Natl Acad Sci USA,2014,111(47):16754-16759.

