阿替美唑不同种属体外代谢产物鉴定比较及代谢通路研究
李 正,高 尤,杨春苗,仇晓燕,张天宏,张文鹏,苏瑞斌,庄笑梅
(1.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京100850;2.海军青岛特勤疗养中心,山东青岛266071)
阿替美唑(atipamezole)是具有咪唑结构的α2-肾上腺素受体拮抗剂[1],能迅速扭转由α2-肾上腺素受体激动剂诱导的镇静和麻醉作用,临床上常被用来拮抗α2-肾上腺素受体激动剂(尤其是右美托咪定)的麻醉作用,同时还能有效地缓解美托咪定-咪达唑仑-氯胺酮联合麻醉引起的不良反应[2]。近年来研究发现,阿替美唑还对疼痛具有调节作用,可阻断去甲肾上腺素能神经通路疼痛传导途径,导致疼痛相关反应的增加,但不影响持续性伤害性疼痛的刺激。肌内注射阿替美唑(0.01~0.03 mg·kg-1)可增强雄性猴的性行为,增加射精量及性交次数[3]。基于以上作用,阿替美唑的开发与临床应用前景相当广阔,但目前尚未见有关阿替美唑药物代谢特征研究的报道。
在早期药物-药物相互作用研究中,肝微粒体与重组人源细胞色素P450(cytochrome P450,CYP)同工酶体外孵育体系是研究药物代谢特征的重要体外模型,可用于鉴定代谢产物、研究代谢酶表型和代谢通路等[4]。本研究应用不同种属肝微粒体以及重组人源CYP同工酶体外温孵模型获得体外代谢产物;体外样品采用Thermo Q-Exactive型超高效液相色谱串联四极杆-静电场轨道阱高分辨质谱系统(ultra performance liquid chromatography coupled with linear ion trap-Orbitrap mass spectrometry,UPLC/LTQ-Orbitrap-MS检测分析[5],通过比对精确相对分子质量和二级碎片离子信息鉴定阿替美唑在不同种属肝微粒体以及重组人源CYP同工酶中的代谢产物,揭示其代谢转化的种属差异以及代谢通路,旨在为新药的进一步开发和可能的药物相互作用研究提供科学数据。
1 材料与方法
1.1 药品和试剂
阿替美唑,白色粉末,批号:S160801,纯度99.39%,军事科学院军事医学研究院毒物药物研究所合成;盐酸普萘洛尔,白色粉末,批号:318-98-9,纯度99.8%,购于(中国)北京百灵威科技有限公司。甲醇和乙腈(色谱纯),购于美国Fisher Scientific公司;甲酸购于赛默飞世尔科技(中国)有限公司;还原型辅酶Ⅱ(NADPH),批号:8516010103,购于美国Roche公司。
混合人肝微粒体(150人份,批号:38292)、大鼠肝微粒体(批号:7024004)和小鼠肝微粒体(蛋白浓度20 g·L-1,批号:7352001)购于美国BD Gentest公司。比格犬肝微粒体(蛋白浓度20 g·L-1,批号:1410114)购于美国Sekisui Xenotech公司;猴肝微粒体(蛋白浓度20 g·L-1,批号:NMZC)购于美国IVT公司。
重组人源CYP同工酶rCYP1A2+OR+b5(批号:3107807),rCYP2A6+OR+b5(批号:7116001),rCYP2B6+OR+b5(批号:626605),rCYP2C8+OR+b5(批号:8190001),rCYP2C9+OR+b5(批号:6257001),rCYP2C19+OR+b5(批号:6173002),rCYP2D6+OR+b5(批号:7114001),rCYP3A4+OR+b5(批号:5105002),rCYP2J2+OR+b5(批号:7311001),rCYP2E1+OR+b5(批号:6341001)和rCYP4F2+OR+b5(批号:8050001),购于美国BD Gentest公司(1000 nmol·L-1)。
1.2 主要仪器和设备
FRESCO21型离心机(美国Thermo Fisher公司);XW-80A型漩涡混合器(上海青浦沪西仪器厂);BS110S型电子分析天平(北京赛多利斯天平有限公司);Thermo Scientific Q Exactive质谱联用仪和Mass Frontier7.0软件分析系统(美国Thermo Fisher科技公司);UltiMate 3000型超高效液相色谱仪(美国戴安公司)。
1.3 肝微粒体与重组人源CYP同工酶体外温孵实验
不同种属肝微粒体与重组人源CYP同工酶孵育实验分为3组(n=3),依次为实验组、阳性对照组和阴性对照组。实验组为含阿替美唑的孵育体系;阳性对照组为含阳性探针底物(非那西丁、安非他酮、阿莫地奎、双氯芬酸、S-美芬妥英、右美沙芬和咪达唑仑)的孵育体系,以确定反应体系的活性;阴性对照组的孵育体系中不含NADPH,以确定阿替美唑在反应体系中的稳定性。
1.3.1 肝微粒体孵育实验
不同种属(大鼠、比格犬和人)肝微粒体溶液中加入阿替美唑,置37℃水浴预孵育5 min后,加入NADPH启动反应,孵育体系中各成分终浓度为:阿替美唑50 μmol·L-1,肝微粒体蛋白1 g·L-1,NADPH 1 mmol·L-1,总孵育体积为800 μL。分别于加入NADPH启动反应后0和60 min加入2倍体积冰冷的含普萘洛尔(内标)30 mg·L-1的乙腈溶液终止反应。将终止反应的孵育样品涡旋振荡2 min后,4℃下13 800×g离心10 min,将上清液全部取至1.5 mL离心管,用氮气吹干后用体积200 μL的流动相复溶,即为待检样品。
1.3.2 重组人源CYP同工酶孵育实验
各重组人源同工酶(rCYP1A2,rCYP2B6,rCYP2C8,rCYP2C9,rCYP2C19,rCYP2D6,rCYP3A4和rCYP2A6)加入阿替美唑,置37℃水浴预孵育5 min后,加入NADPH启动反应,反应体系中各成分终浓度为:阿替美唑50 μmol·L-1,重组酶浓度20 nmol·L-1,NADPH 1mmol·L-1,总体积800 μL。终止反应及制备待检样品的条件与步骤同1.3.1。
1.4 UPLC/LTQ-Orbitrap-MS分析条件
色谱条件:色谱柱为Phenomenex C1(8100 mm×2.1 mm,5 μm)柱;A相:0.1%甲酸水,B相0.1%甲酸乙腈;采用梯度洗脱(0~1 min,2%B;1~15 min,2%~95%B;15~17 min,95%B;17~20 min,2%B);流速0.5 mL·min-1;进样量5 μL。
质谱条件:质谱采用电喷雾离子化源(electrospray ionization,ESI)正离子电离模式;雾化温度300℃;离子传输管温度325℃;鞘气流速40 arb;辅助气流速10 arb;喷雾电压3.5 kV;碰撞电压20,40和60 eV;质荷比(mass-to-charge ratio,m/z)检测范围50~750;正离子检测模式;采用高分辨全离子扫描模式;一级全离子扫描(分辨率R=70 000,扫描质量范围m/z 50~750),二级全离子扫描(分辨率R=17500)。
1.5 数据分析处理
高分辨全离子扫描模式下的总离子流色谱(total ion chromatogram,TIC)图,运用MetWorksTM1.3 SP4软件进行多重质量亏损处理(multiple mass defect filters),发现新生成的代谢产物。利用Xcaliber4.0工作站,根据精确分子质量数据推测可能的元素组成,并结合质谱裂解碎片信息进行数据处理,采用分子式预测模块预测所有母离子和碎片离子的分子式,鉴定阿替美唑的体外代谢产物结构。
2 结果
2.1 各种属肝微粒体阿替美唑代谢产物谱比较
通过对比各种属肝微粒孵育实验中0和60 min的TIC图发现,阿替美唑的保留时间为6.5 min,经肝微粒体代谢酶体外代谢后出现3个产物峰(图1),其色谱行为一致,保留时间分别为4.9,5.4和8.0 min,依次命名为M1,M2和M3,其中M1和M2保留时间早于原型药物,M3的保留时间落后于原型药物。各种属肝微粒体中3个产物的响应强度不同,提示阿替美唑的代谢产物谱无种属差异,但产物生成比例有一定种属差异。
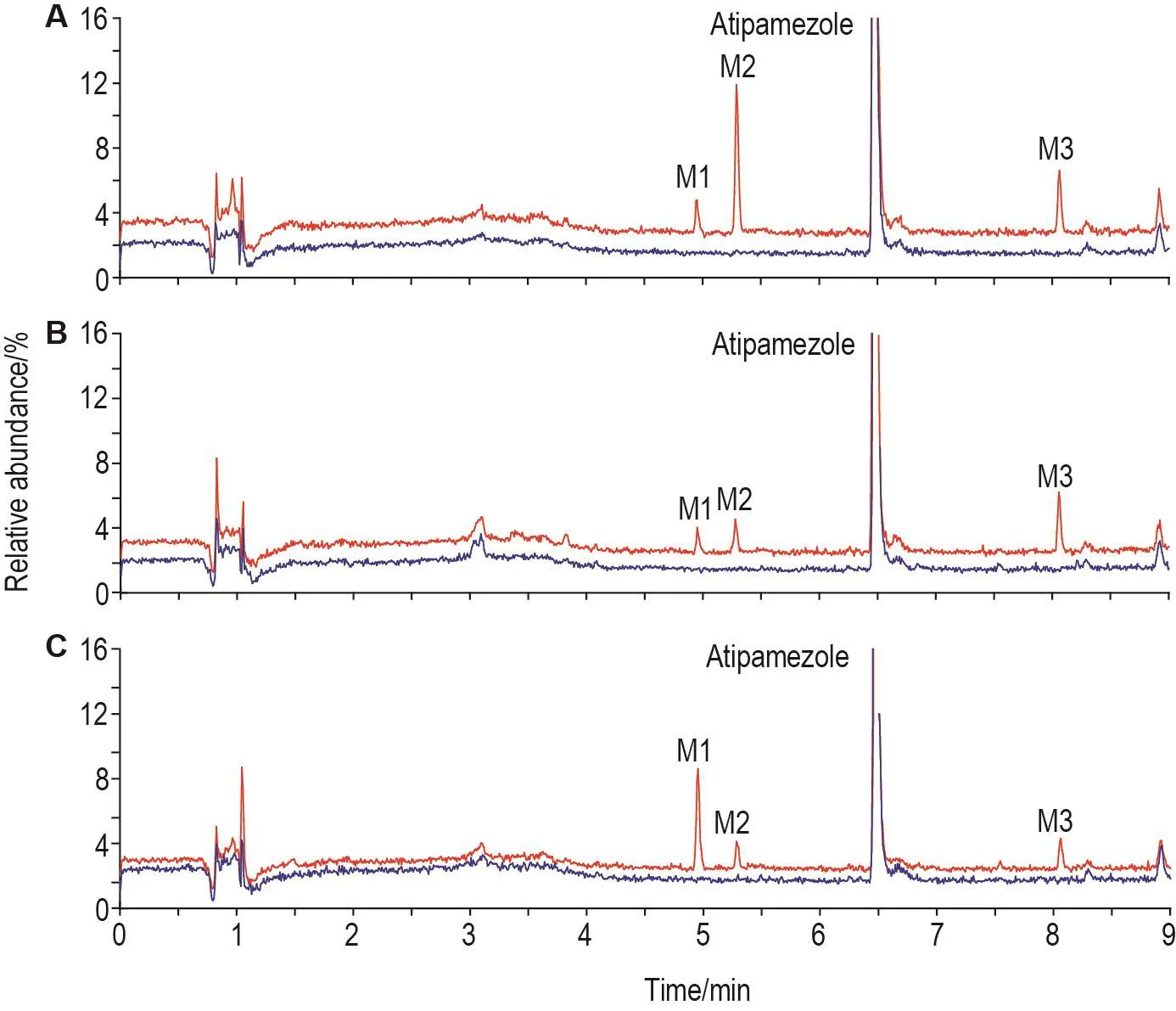
Fig.1 Comparative total ion chromatograms(TlCs)of atipamezole and its metabolites obtained from human(A),dog(B)and rat(C)liver microsomes before and after incubation.Blue curves represent incubation information obtained at 0 min,red curves represent incubation information obtained at 60 min.M1 is the metabolite of terminal ethyl hydroxylation,M2 is the metabolite of benzene epoxidation and M3 is the metabolite of imidazole epoxidation.
2.2 阿替美唑肝微粒体体外代谢产物鉴定
阿替美唑及其3个体外代谢产物的精确分子质量与二级质谱图见图2。图2A中包含阿替美唑和3个代谢产物的母离子和子离子的碎片结构解析;图2B为阿替美唑的质谱裂解综合图,数据见表1。由图1和表1可知,在正离子模式下,阿替美唑准分子离子峰[M+H]+为m/z 213.13786,经诱导碰撞解离(collision-induced dissociation,CID)裂解后,特征二级碎片离子包括m/z 69.04527,117.08976,145.10071和183.09106。其中碎片离子m/z183.09106为脱乙基的基峰,碎片离子m/z 145.10071为脱咪唑基峰,碎片离子m/z 117.08976为同时脱乙基和咪唑环后的苯并环戊基基峰,碎片离子m/z 69.04527为咪唑环基峰。
代谢产物M1的保留时间为4.9 min,准分子离子峰[M+H]+为m/z 229.13286,比阿替美唑[M+H]+多16 u,根据精确相对分子质量,分子式为C14H16ON2,推测可能为阿替美唑氧化产物。M1的二级特征碎片离子包括m/z 81.04514,95.04914,143.08505和211.12239。由特征碎片离子m/z 211.12239推测该碎片可能为M1脱水峰,因此M1的氧化位点很可能位于乙基,结合氧化代谢性质推测乙基末端发生羟基化的可能性较大,特征碎片离子m/z 143.08505为m/z 211.12239脱去咪唑环后末端形成乙烯结构的基峰。由特征碎片离子m/z 95.04914推测,M1为脱水后形成环戊烯结构后环戊烯开环形成咪唑环加乙烯结构。特征碎片离子m/z 81.04514为m/z 95.04914再脱去甲基形成。
代谢产物M2保留时间为5.3 min,准分子离子峰[M+H]+为m/z 229.13290,比阿替美唑[M+H]+峰多16 u,根据精确相对分子质量,分子式为C14H16ON2,推测M2也可能为阿替美唑氧化产物。M2的二级特征碎片离子包括m/z 69.04521,133.06451,161.09663和199.08592。由特征碎片离子m/z 69.04521推断M2的咪唑环结构不变;而M2的特征碎片离子m/z 133.06451和161.09663均比阿替美唑特征碎片离子m/z 117.08976和145.10071多16 u,推测M2氧化位点很可能位于苯环处;特征碎片离子m/z 199.08592为M2脱乙基形成的基峰。

Fig.2 Tandem mass spectrometry(MS/MS)spectra of atipamezole(A),and its metabolites M1(B),M2(C)and M3(D)in human liver microsomes and proposed fragmentation patterns of atipamezole(E).

Tab.1 Mass-to-charge ratio(m/z)of atipamezole and its major metabolites after incubation in liver microsomes
代谢产物M3保留时间为8.0 min,准分子离子峰[M+H]+为m/z 229.13292,比阿替美唑[M+H]+峰多16 u,根据精确相对分子质量,分子式为C14H16ON2,推测M3也可能为阿替美唑氧化产物。M3的特征碎片离子包括m/z 85.04004,117.08976,145.10071和199.08603。由特征碎片离子m/z 117.08976,145.10071与阿替美唑的二级特征碎片离子一致推断M3的苯环结构不变;由特征碎片离子m/z 85.04004比阿替美唑咪唑基峰m/z 69.04527增加16u,推测该碎片可能为咪唑环氧化的基峰。因此,M3氧化位点可能位于咪唑环处,特征碎片离子m/z199.08592为M3脱去乙基形成的基峰。
2.3 阿替美唑在各重组人源CYP同工酶中的代谢转化
在对比阿替美唑在各重组人源CYP同工酶孵育样品中0和60 min的TIC图中选择提取离子m/z 229.13286得到图3。结果显示,除在CYP2A6,2B6,2D6,2C19和3A4外,阿替美唑在其他3个主要同工酶(CYP1A2,2C8和2C9)中不发生代谢转化,并且不同重组人源CYP同工酶对应不同的代谢产物。M1由CYP2A6,CYP2D6和CYP3A4介导产生,M2由CYP2A6,CYP2D6和CYP2C19介导产生,M3由CYP2A6,CYP2B6和CYP3A4产生。综上,阿替美唑在肝重组人源CYP同工酶中的代谢通路如图4。
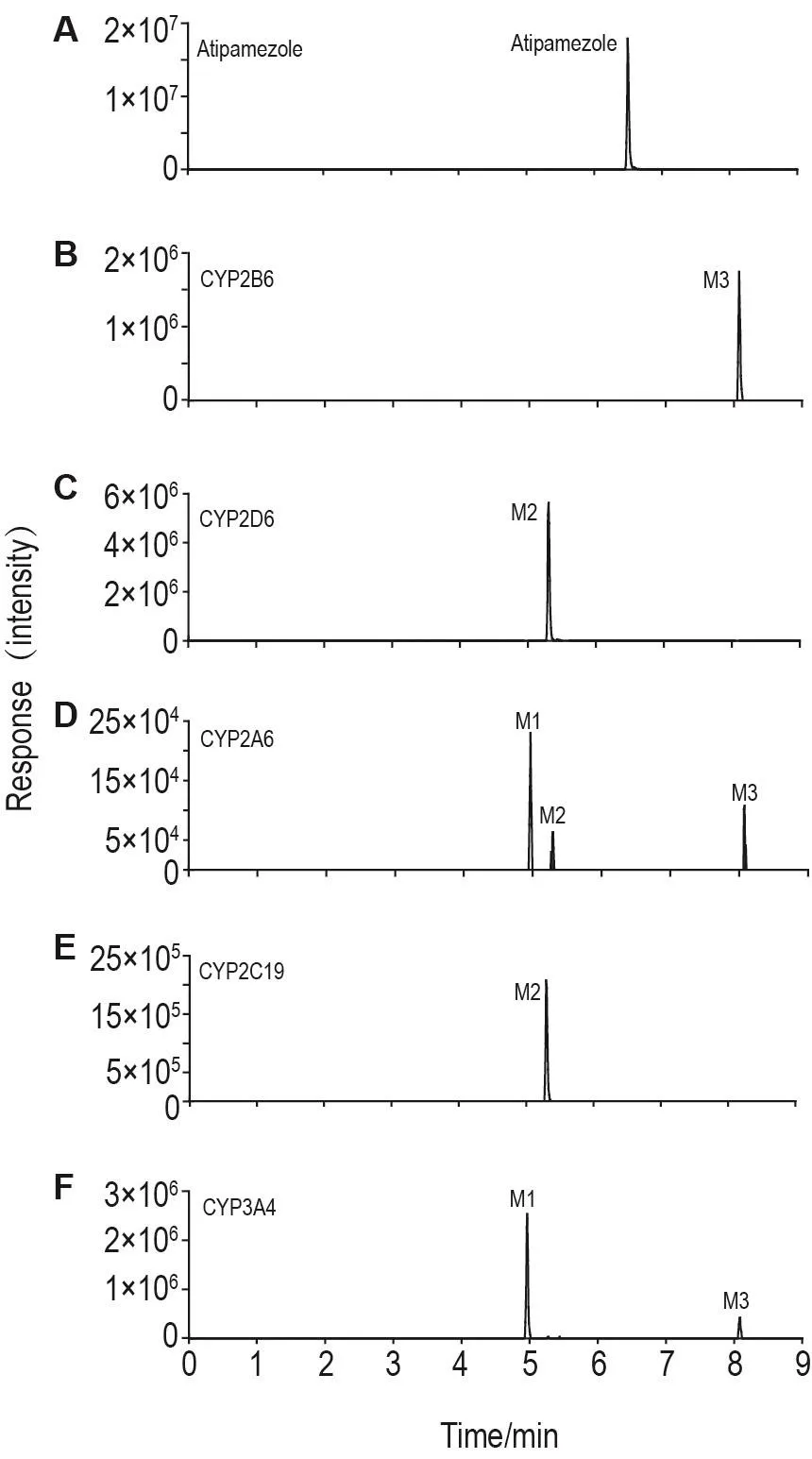
Fig.3 Extracted ion chromatograms of the major metabolites of atipamezole in recombinant human cytochrome P450 enzymes(CYPs)

Fig.4 Supposed metabolic pathway of atipamezole in recombinant human CYPs.
3 讨论
在新药非临床评价中,动物种属的选择非常重要。根据《FDA新药安全性评价指南》要求[6],化合物在非临床受试动物中的代谢产物谱尽量与人体代谢产物谱一致,或不遗漏人体代谢产物,才能保证非临床安全性评价结果的可靠性及临床相关性。因此,新药的代谢产物鉴定和产物谱的种属比较是非临床药动学及安全性评价的重要研究内容[7]。
3.1 阿替美唑Ⅰ相代谢产物谱的种属比较
不同种属体外肝微粒孵育实验是获得主要Ⅰ相代谢产物的重要手段,可以快速鉴定代谢产物并比较不同种属产物谱[8]。本研究基于灵敏的测定肝微粒孵育体系中阿替美唑及其代谢产物的UPLC/LTQ-Orbitrap-MS方法,发现阿替美唑经大鼠、比格犬和人肝微粒体孵育后都产生了3个主要代谢产物,特别是人肝微粒体孵育后产生的代谢产物在大鼠和比格犬中均有产生,提示大鼠和比格犬可作为非临床药物安全性评价的动物种属。虽各种属中生成3个产物的质谱响应不同,但由于缺乏产物标准品,且质谱检测对基质的敏感性较高[6],无法准确比较产物生成量。
3.2 阿替美唑Ⅰ相代谢产物初步鉴定
四极杆-静电场轨道阱高分辨质谱通过测定各离子的振荡频率,运用傅里叶变换计算m/z,其分辨率可达10万。采用精确质量数提取获得相应化合物的质谱响应,充分保证了方法的高选择性[9]。本研究采用UPLC/LTQ-Orbitrap-MS技术,基于多重质量亏损方法,在20 min内对盐酸阿替美唑的3个代谢产物进行了分离和鉴定。阿替美唑3个Ⅰ相代谢产物均为氧化产物,根据母药的质谱裂解规律,结合精确分子质量数据推测可能的元素组成,逐一解析了产物的氧化代谢位点,包括乙基末端羟基化、苯环羟基化及咪唑环氧化。
3.3 阿替美唑的Ⅰ相代谢通路
应用重组人源同工酶孵育后进一步明确了阿替美唑在各同工酶中的代谢转归。阿替美唑在CYP2A6,2B6,2D6,2C19和3A4中转化成不同的代谢产物(图4)。Ⅰ相代谢通路研究结果显示,CYP2A6,2B6,2D6,2C19和3A4均参与了盐酸阿替美唑的氧化代谢,并且每个代谢产物都是有多个代谢酶亚型介导的。CYP2A6,2D6和2C19虽均有明显的基因多态性[10-11],但由于阿替美唑的多通路代谢,这种因素的影响可能较小。
综上,本研究首次鉴定了阿替美唑的3个体外氧化产物,明确了参与Ⅰ相代谢的代谢酶亚型。由于阿替美唑代谢通路广泛,在临床与其他药物合用时可能不易发生作为CYP药物代谢酶底物介导产生的药物-药物相互作用[12-14]。在后期研究中还需要进一步明确阿替美唑对药物代谢酶的抑制和诱导作用,以评价基于代谢酶调节作用产生的药物相互作用。

