多柔比星体内外对心肌甲基化转移酶样3依赖的m6ARNA甲基化修饰的影响
孟祥雯,张雪洁,张 波,2,李彩蓉,杨晓松
(湖北科技学院1.医药研究院糖尿病心脑血管病变湖北省重点实验室,3.临床医学院,湖北咸宁437100;2.三峡大学第二人民医院,湖北宜昌443000)
蒽环类抗生素多柔比星(doxorubicin,DOX)具有非细胞周期依赖性的广谱抗肿瘤作用,是美国和欧洲癌症指南推荐的一线化疗药物,在临床上用于治疗各种实体瘤及血液肿瘤,如乳腺癌、结直肠癌、白血病和淋巴瘤等[1]。但因其具有累积性、剂量依赖性和不可逆性的心脏毒性作用而限制了它的临床应用,主要临床表现为血压降低、心动过速和心律不齐,最终导致充血性心衰,严重威胁癌症患者的生命[2]。然而,目前临床上尚无有效的预防手段来改善DOX的心肌毒性。因此,阐明其心肌毒性的分子机制,将为寻找及开发预防DOX心肌毒性的药物提供理论依据。近年研究发现,在许多真核生物中,RNA存在150余种化学修饰如N6甲基腺苷(N6-methyl adenosine,m6A),m5A和m1A甲基化修饰等[3],被修饰的RNA种类包括信使RNA(messenger RNA,mRNA),核糖体RNA(ribosomal RNA,rRNA),转运RNA(transfer RNA,tRNA),微小RNA(microRNA,mRNA)和长非编码RNA(long non-coding RNA,LncRNA)等[4],这些修饰通过调控RNA的拼接、出核、稳定性和翻译,最终调控机体生理生化过程,介导疾病的发生、器官和组织的发育[3]。m6A RNA甲基化修饰是真核生物中RNA化学修饰最为丰富的一种,约占总RNA修饰的80%[5]。随着RNA甲基化检测技术的进步m6A RNA甲基化修饰机制及功能也逐步阐明。介导m6A RNA甲基化修饰主要由RNA甲基化转移酶(读入)和去甲基化酶(擦除)2类功能蛋白的动态相互作用调控,而m6A甲基化结合蛋白(读取)直接调控靶RNA的拼接、稳定性和翻译,从而影响机体生理变化[4]。目前,有关m6A RNA甲基化修饰调控的研究主要集中在癌症研究领域。已有研究显示,在成胶质细胞瘤样干细胞内敲除甲基化转移酶样3(methyltransferase like 3,METTL3)和(或)METTL14,下调m6A甲基化修饰水平,导致癌基因如解整合素样金属肽酶19(ADAM metallopeptidase domain 19,AD-,AM19),促红细胞生成素肝细胞受体A3(erythropoietin-producing hepatocyte receptor A3,EPHA3),Krüppel样因子4(Krüppel-like factor 4,KLF4)的表达上调,而肿瘤抑制基因细胞周期蛋白依赖性激酶抑制剂2A(cyclin dependent kinase inhibitor 2A,CDKN2A),乳腺癌易感基因2(breast cancer susceptibility gene 2,BRCA2)和P53的表达下调,严重影响其生长、自我更新及肿瘤的发生[6]。体内外研究结果显示,METTL14的表达下调可降低mR-126的甲基化修饰水平,从而促进肝癌的发生及转移[7]。在心血管领域,首篇有关RNA甲基化修饰的报道认为,脂肪质量和肥胖相关基因(fat mass and obesity associated gene,FTO)在心重构与修复过程中发挥重要功能,FTO介导m6A去甲基化修饰能改善心收缩功能,从而抑制心衰的发生[8]DOX心肌毒性机制研究普遍认为,氧化应激应答介导的心肌细胞凋亡和坏死是DOX心肌毒性的主要因素之一,涉及的毒理机制包括DNA损伤、线粒体功能障碍和能量代谢失衡等信号通路的调控[9],而有关表观遗传修饰参与DOX心肌毒性调控机制的报道较少,特别是m6A RNA甲基化修饰是否参与DOX心脏毒性调控目前尚无报道。本研究拟用DOX诱导SD大鼠心肌损伤以及诱导心肌细胞H9C2损伤作为体内外模型,评价其诱导心肌损伤过程中对m6A RNA甲基化修饰水平的影响和可能的机制,探索干预DOX心肌毒性的可能新靶点。
1 材料与方法
1.1 动物、试剂和主要仪器
40只SD雄性大鼠,实验动物合格证号:SCXK(京)2016-0011,体质量180~200 g,购自北京维通利华实验动物技术有限公司。DOX粉末购自美国Sigma公司;大鼠心肌细胞H9C2购自上海复旦IBS细胞资源中心;DMEM购自美国Gibco公司;胎牛血清购自美国Hyclone公司;qRT-PCR试剂盒购自日本Takara公司;兔抗人源METTL14单克隆抗体(#51104S)、兔抗人源活化的胱天蛋白酶3多克隆抗体(#9661S)和兔抗人源METTL3单克隆抗体(#96391S)购自美国CST公司;大鼠抗小鼠β肌动蛋白单克隆抗体(ab6276)、兔抗人源超氧化物歧化酶(superoxide dismutase,SOD)多克隆抗体(ab13533)、兔抗人源核因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)多克隆抗体(ab137550)和兔抗人源叉头转录因子盒O3(forkhead transcription factor box O3,Foxo3a)单克隆抗体(ab109629)均购自英国Abcam公司;辣根过氧化物酶标记的羊抗兔IgG(bs-0295G-HRP)和辣根过氧化物酶标记的兔抗大鼠IgM(bs-0368RHRP)抗体购自北京博奥森公司;m6A RNA甲基化定量试剂盒(ab185912)购自英国Abcam公司;细胞裂解液(radio-immunoprecipitation assay,RIPA)、二喹啉甲酸(bicinchonininc acid,BCA)蛋白浓度检测试剂盒、苏木精-伊红(hematoxylin-eosin,HE)染色试剂、苯甲基磺酰氟(phenylmethanesulfonylfluoride,PMSF)、N-乙酰-L-半胱氨酸(N-acetyl-Lcysteine,NAC)和二硫苏糖醇(DTT)购自碧云天公司;TRIzol、化学发光(electro-chemi-luminescence,ECL)显影液和蛋白酶抑制剂(protease inhibitor cocktail)购自美国Thermo Fisher公司。
1.2 DOX诱导心肌损伤模型的构建和分组
大鼠随机分为2组,正常对照组10只,ip给予生理盐水5 mL·kg-1,DOX组30只,ip给予DOX 2 mg·kg-1,均为隔天给药1次,共给药7次。未次给药后,继续喂养7周。大鼠处死取心脏,切取心尖置4%多聚甲醛中固定用于HE和Masson染色及免疫荧光分析,取左心室置液氮中冻透后置-80℃冰箱保存备用。
1.3 HE染色检查大鼠心肌组织病理变化
将1.2中经多聚甲醛固定的心肌组织进行脱水处理,石蜡包埋、切片后置60℃烤箱中烘烤1 h,之后脱水、脱蜡,最后再采用HE染色,镜下观察心肌组织病理变化。
1.4 Masson染色检测心肌组织胶原纤维沉积
将1.3中制作的心肌组织切片脱蜡后用Weigert铁苏木精染液染核5~7 min,流水冲洗数分钟,1%盐酸乙醇分化数秒,流水冲洗5 min,丽春红酸性品红染液染色3~4 min,流水冲洗,再用1%磷钼酸溶液分化约5 min,甩干,直接用苯胺蓝染液复染5 min,1%冰醋酸冲洗切片1 min,快速水洗后,乙醇脱水,二甲苯透明、风干后中性树胶封片,显微镜下观察有胶原物质累积的部位,Masson染色为蓝色。通过Image-Pro Plus V6分析软件对染色结果进行半定量分析,结果以蓝色胶原区域的积分吸光度(integrated absorbance,IA)值与整个图像区域的面积比值表示胶原纤维累积。
1.5 Western蛋白印迹法检测大鼠心肌组织METTL3,METTL14,Foxo3a,SOD,Nrf2和活化的胱天蛋白酶3蛋白表达
从-80℃冰箱取出1.2中冻存的心肌组织,加入含蛋白酶抑制剂的RIPA,冰浴条件下采用电动匀浆机打碎组织,冰浴10~20 min,4℃条件下以12 000×g离心10 min,将上清转移至另一EP离心管,采用BCA法测定蛋白浓度;进行SDS-PAGE蛋白电泳,之后采用4℃条件下200 mA,3 h转膜。用TBST洗膜3次,室温用5%脱脂牛奶封闭2 h,加入一抗(1∶1000)4℃孵育过夜,室温条件下采用TBST洗膜3次,加入二抗(1∶5000)孵育2 h,TBST洗膜3次,用ECL显影液处理,经Bio-Rad凝胶成像系统进行图像采集,ImageJ软件进行半定量分析,用目的蛋白条带和内参蛋白条带IA值的比值表示目的蛋白相对表达水平。
1.6 荧光定量PCR法检测大鼠心肌组织和H9C2细胞METTL3和METTL14 mRNA表达
从-80℃冰箱中取出1.2中冻存的心肌组织,加入TRIzol用电动匀浆机打碎组织,然后加入1/5体积的氯仿,涡旋振荡混匀后静置10 min,4℃条件下12 000×g离心15 min,将上清转移至另一离心管内,加入等体积异丙醇,涡旋振荡后静置10 min,12 000×g,4℃条件下离心10 min,倒掉上清,加入1 mL 75%乙醇洗涤沉淀,12 000×g,4℃条件下离心5 min,吸干乙醇,通风橱内吹干,加入适量无RNA酶无菌水溶解沉淀,超微量核酸分光光度计测定RNA浓度及纯度,-20℃保存以备后续荧光定量分析。H9C2细胞分为细胞对照组(1%DMSO)和DOX 1 μmol·L-1组,孵育24 h后去除培养基,加入TRIzol裂解细胞,后续总RNA提取同上。
采用二步法进行荧光定量PCR分析mRNA表达水平。先将抽提的总RNA约500 ng,逆转录为cDNA,然后以cDNA为模板,SYBR Green作为荧光染料,β肌动蛋白作为内参,荧光定量PCR检测目的基因mRNA表达水平,用2-△△ct法计算目的基因mRNA的相对表达。
1.7 免疫荧光法检测大鼠心肌组织中METTL3蛋白表达
将1.3制备的心肌组织石蜡切片进行微波抗原修复(枸橼酸缓冲液,0.01 mol·L-1,pH6.0),然后滴加3%BSA室温封闭30 min,甩去多余液体,滴加稀释的一抗(1∶100),于4℃湿盒中孵育过夜。第2天用PBST冲洗切片3次,每次3 min,然后用吸水纸擦干,滴加稀释的荧光(CY3)标记的羊抗兔IgG(1∶100),湿盒中20~37℃孵育1 h。PBST冲洗切片4次,每次3 min,滴加DAPI避光孵育5 min;PBST冲洗切片4次,每次5 min,用吸水纸擦干,用含抗荧光淬灭剂的封片液封片,在倒置荧光显微镜下观察。通过Image-Pro Plus V6分析软件进行半定量分析,结果以阳性着色区域的IA与整个图像区域的面积的比值进行半定量分析。
1.8 Western蛋白印迹法检测H9C2细胞METTL3,METTL14,Foxo3a,SOD,Nrf2和活化的胱天蛋白酶3蛋白表达
大鼠心肌细胞H9C2以5×107L-1接种于6孔板,用含10%胎牛血清、青霉素100 kU·L-1、链霉素100 mg·L-1以及pH7.2的DMEM高糖培养基培养,置37℃,5%CO2恒温培养箱中。待细胞汇合度达约90%,吸去培养基,用无菌PBS洗2~3次,加入胰蛋白酶-EDTA消化细胞进行传代培养;待细胞处理结束后,从培养箱拿出培养皿,吸去培养基,用冰浴PBS洗涤细胞3次,加入含蛋白酶抑制剂的RIPA裂解细胞10~30 min,然后用细胞刮子将细胞刮下转入1.5 mL离心管内,4℃条件下以12 000×g离心10 min,将上清转移至另一EP离心管,采用BCA法测定蛋白浓度;采用终浓度为1 μmol·L-1的DOX处理H9C2细胞24 h,分别在DOX处理的0,3,6,12和24 h收集细胞,抽提总蛋白,Western蛋白印迹法分析METTL3、METTL14和活化的胱天蛋白酶3蛋白表达水平。H9C2细胞分为4组,细胞对照(0.1%DMSO)组,DOX 1 μmol·L-1组,NAC 0.5 mmol·L-1组和DOX 1 μmol·L-1+NAC 0.5 mmol·L-1组,处理H9C2 24 h后收集细胞,抽提总蛋白,分析SOD,Nrf2,Foxo3a,METTL3,METTL14和活化的胱天蛋白酶3的蛋白表达水平。后续蛋白表达检测方法同1.5。
1.9 大鼠心肌组织和H9C2细胞中m6A RNA甲基化定量分析
采用m6A RNA甲基化定量试剂盒对抽提的总RNA进行甲基化定量分析,根据试剂盒的说明进行操作。大体步骤如下:从试剂盒中取出8联管,每孔中加入80 μL结合缓冲液,然后加入约2 μL(200 ng)RNA溶液,轻轻混匀后置37℃孵育90 min;去上清,用150 μL的洗脱缓冲液洗涤3次,加入50 μL抗体,室温孵育60 min,洗涤3次;加入50 μL检测抗体,室温孵育30 min,洗涤3次;加入50 μL增强溶液,室温孵育30 min,洗涤5次;加入100 μL显色液,室温避光孵育10 min,加入100 μL终止溶液,在2~10 min内置于酶标仪检测450 nm波长的吸光度(A450nm)值。甲基化倍数关系计算公式:m6A(%)=〔(样品均值A450nm-阴性对照均值A450nm)/RNA质量(ng)〕/〔(阳性对照均值A450nm-阴性对照均值A450nm)/阳性对照RNA质量(ng)〕×100%
1.1 0统计学分析
2 结果
2.1 DOX致SD大鼠心肌损伤病理变化
图1结果显示,大鼠心尖组织HE染色结果显示,与正常对照组比较,DOX组心肌纤维排列出现紊乱,大量心肌细胞水肿,肌原纤维出现溶解,部分细胞核崩解;Masson染色结果显示,正常对照组心肌纤维表面呈红色,DOX组大鼠心尖组织中胶原纤维蛋白表面部分呈蓝色,DOX组胶原纤维累积量(10.7±4.8)%相较于对照组(4.3±1.3)%增加约2.5倍(P<0.05)。
2.2 DOX对大鼠心肌组织SOD,Nrf2和Foxo3a蛋白表达的影响
Western蛋白印迹法检测结果如图2所示,相较于正常对照组,DOX组大鼠心肌组织中SOD,Foxo3a和Nrf2蛋白表达水平明显下调(P<0.01,P<0.05)。

Fig.1 Pathological changes in myocardial tissue of rats induced by doxorubicin(DOX)by HE and Masson staining.Rats were ip injected with normal saline or DOX(2 mg·kg-1),once every other day,for seven times,and then were fed for another seven weeks after the last administration.Arrows show the morphological change and collagen accumulation of myocardial tissue.
2.3 DOX对大鼠心肌组织METTL3和METTL14 mRNA和蛋白及活化的胱天蛋白酶3蛋白表达的影响
荧光定量PCR检测结果发现,与正常对照组相比,DOX组METTL3的mRNA表达水平上升(3.1±0.8)倍(P<0.01),但METTL14 mRNA表达水平无显著差异(图3A和B)。Western蛋白印迹法检测结果显示,与正常对照组相比,DOX组METTL3和活化的胱天蛋白酶3表达水平上升显著(P<0.01),而METTL14蛋白表达水平无显著变化(图3C和D)。免疫荧光结果显示,与正常对照组比较,DOX组心肌组织中METTL3蛋白表达明显增加(P<0.05)(图3E和F)。以上结果表明,DOX诱导心肌凋亡的同时,上调METTL3蛋白表达而不影响METTL14蛋白表达。

Fig.2 Effect of DOX on protein expression of superoxide dismutase(SOD),nuclear factor-erythroid 2-related factor 2(Nrf2)and forkhead transcription factor box O3(Foxo3a)in myocardial tissue of rats by Western blotting.See Fig.1 for the rat treatment.B:semi-quantitative result of A.x±s,n=5.*P<0.05,compared with normal control group.

Fig.3 Effect of DOX on mRNA and protein expressions of methyltransferase like 3(METTL3),METTL14 and cleaved-caspase 3 in myocardicl tissue of rats.See Fig.1 for the rat treatment.A and B:mRNA expression was detected by qRTPCR;C:protein expression was detected by Western blotting;D:semi-quantitative result of C;E:protein expression of METTL3 was detected by immunofluorescence(IF,×200);F:semi-quantitative result of E.s,n=5.*P<0.05,**P<0.01,compared with normal control group.
2.4 DOX对H9C2细胞METTL3,METTL14和活化的胱天蛋白酶3 mRNA和蛋白表达的影响
荧光定量PCR检测结果表明,与细胞对照组比较,DOX 1 μmol·L-1组METTL3 mRNA表达水平约是细胞对照组的3倍(2.69±0.61,P<0.01),而METTL14 mRNA表达水平略高于细胞对照组(1.37±0.11,P<0.05)(图4A和B)。图4C和D结果表明,METTL3的蛋白表达水平呈现时间依赖性上升(r=0.8211,P<0.05),DOX处理24 h后,METTL3蛋白表达水平约是0 h的6倍(0 h:0.20±0.02,24 h:1.55±0.40,P<0.01),但METTL14蛋白表达水平无显著变化;活化的胱天蛋白酶3的表达也依时间的延长而明显增加(P<0.01)。

Fig.4 Effect of DOX(1 μmol·L-1for 24 h)on mRNA(A and B)of METTL3 and METTL14 and protein expression(C and D)of METTL3,METTL14 and cleaved-caspase 3 in H9C2 cells by qRT-PCR and Western blotting,respectively.D:semi-quantitative result of C.x±s,n=3.*P<0.05,**P<0.01,compared with cell control or 0 h group.
2.5 抗氧化剂NAC对DOX诱导H9C2细胞SOD,Nrf2,Foxo3a,METTL3和活化的胱天蛋白酶3蛋白表达的影响
Western蛋白印迹法检测结果(图5)表明,NAC 0.5 mmol·L-1单独或联合DOX(1 μmol·L-1)处理H9C2细胞24 h,与DOX组相比,联合处理组上调SOD,Nrf2和Foxo3a蛋白表达(P<0.05),抑制活化的胱天蛋白酶3的表达(P<0.05);另一方面,NAC也部分抑制DOX诱导的METTL3蛋白表达的上升(P<0.05)。
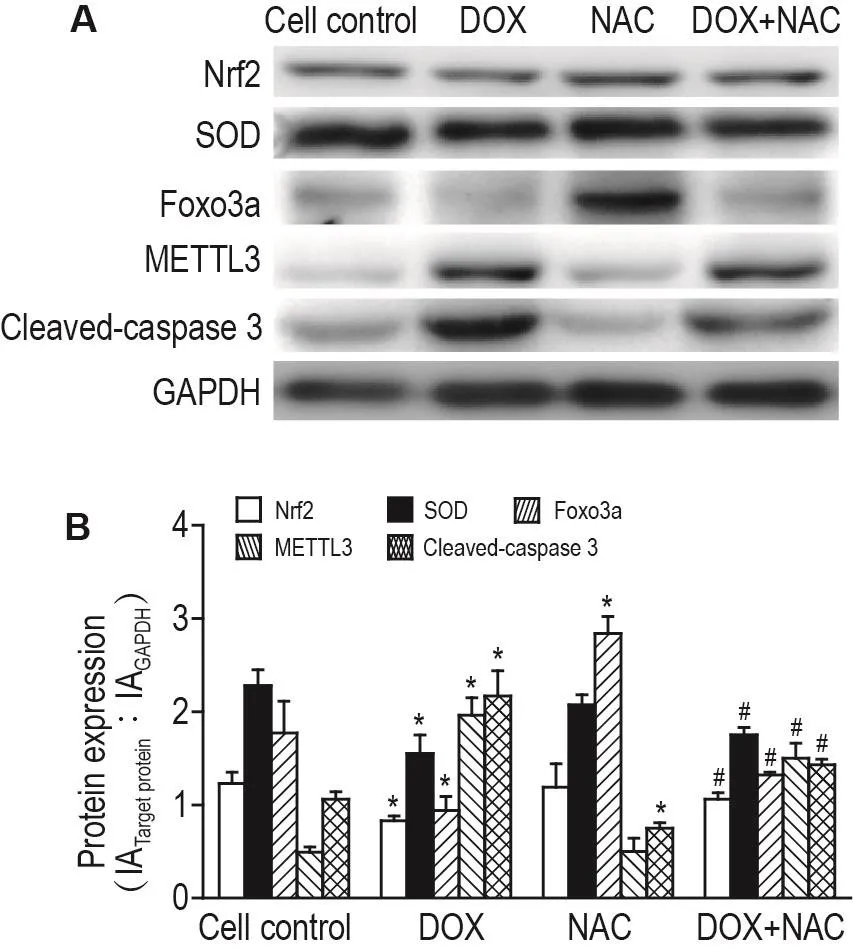
Fig.5 Effect of DOX or DOX+N-acetyl-L-cysteine(NAC)on protein expressions of Nrf2,SOD,Foxo3a,METTL3 and cleaved-caspase 3 in H9C2 cells by Western blotting.H9C2 cells were treated with DOX 1 μmol·L-1alone or in combination with NAC 0.5 mmol·L-1for 24 h.B:semi-quantitative result of A.,n=3.*P<0.05,compared with cell control group;#P<0.05,compared with DOX group.
2.6 DOX对心肌组织和H9C2细胞总m6A RNA甲基化修饰水平的影响
大鼠心肌组织m6A RNA甲基化检测结果显示(图6A),正常对照组m6A RNA甲基化修饰比例为(35±6)%,DOX组总m6A RNA甲基化修饰水平升高至(51±4)%(P<0.05)。DOX 1 μmol·L-1处理心肌细胞H9C2 24 h,并同时采用NAC 0.5 mmol·L-1进行干预,m6A RNA甲基化水平检测结果(图6B)显示,与DOX组相比,NAC与DOX联合处理组心肌细胞内总m6A RNA甲基化修饰水平从(55±5)%下降至(45±3)%(P<0.05),提示NAC能部分抑制DOX诱导的m6A RNA甲基化修饰水平升高。
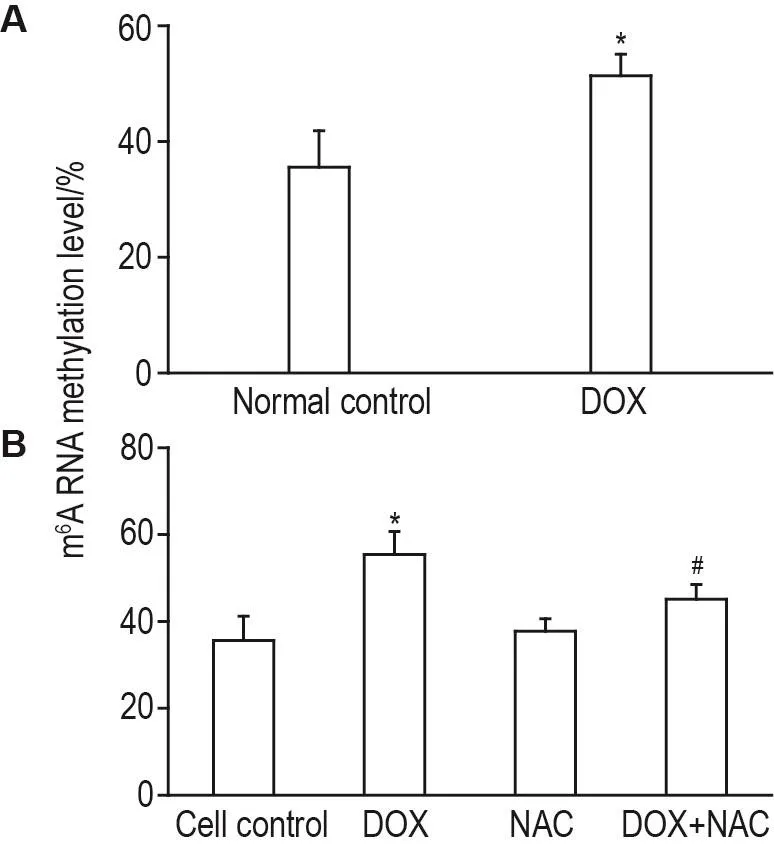
Fig.6 Effect of DOX or DOX+NAC on methylation modification of m6A RNA in total RNA of myocardial tissue of rats(A)and H9C2 cells(B).See Fig.1 for the rat treatment and see Fig.5 for H9C2 cell treatment.s,n=3.*P<0.05,compared with normal or cell control group;#P<0.05,compared with DOX group.
3 讨论
本研究结果显示,DOX致大鼠心肌形态结构发生明显改变,胶原纤维蛋白累积增加明显,提示DOX诱导大鼠心肌毒性模型的建立。进一步分析发现,DOX抑制SOD及其上游信号调控分子Nrf2和Foxo3a蛋白表达,同时心肌内凋亡信号分子活化的胱天蛋白酶3的累积增加,说明DOX诱导心肌氧化应激及胱天蛋白酶依赖的凋亡信号通路的活化可能是DOX心肌毒性的重要因素。但是,令人意外的发现,DOX能显著增加心肌METTL3 mRNA和蛋白表达水平及其依赖的m6A RNA甲基化修饰水平。因此,METTL3及其介导的m6A RNA甲基化修饰有可能参与DOX心肌毒性调控过程。
在细胞水平,本研究结果表明,DOX上调H2C9细胞METTL3的表达并呈现时间依赖性,但不影响METTL14的表达;而NAC不仅能明显改善DOX对抗氧化信号的抑制作用,还能减轻DOX诱导的METTL3表达上调以及METTL3依赖的m6A RNA甲基化修饰水平,提示METTL3及其介导的m6A RNA甲基化修饰可能与氧化应激信号通路的调控相关,METTL3可能介导氧化应激信号通路调控分子m6A RNA甲基化修饰水平及其表达,参与DOX心肌毒性的调控作用。
目前已有多篇报道显示,细胞内m6A RNA甲基化修饰动态平衡对维持细胞正常生理功能发挥重要作用,涉及细胞周期、炎症反应和存活等调控[10-12]。机制研究认为,m6A RNA甲基化修饰主要是通过调控关键基因转录产物RNA的稳定性、转运、半衰期和翻译等来发挥作用[11]。在心肌病研究方面,仅Mathiyalagan等[8]2018年首次报道,FTO依赖的m6A RNA去甲基化修饰调控心肌细胞内Serca2a mRNA表达及其依赖的胞内钙离子循环,在缺血性心衰及非缺血性心衰的发生中起重要调控作用,提示心肌细胞内m6A RNA甲基化修饰动态平衡在心肌病发生过程中有重要调控作用。因此,在DOX心肌毒性过程中,m6A METTL3可能介导氧化应激或抗氧化信号调控分子的RNA甲基化修饰,从而影响其表达而干扰氧化应激与抗氧化的动态平衡,最终导致心肌病的发生。
本研究结果显示,DOX抑制心肌细胞抗氧化信号分子表达,上调METTL3表达及其依赖的m6A RNA甲基化修饰水平,而NAC改善DOX介导的抗氧化信号分子下调及凋亡的同时,下调METTL3表达及其依赖的m6A RNA甲基化修饰水平。这一结果表明,在心肌细胞内,METTL3可能参与氧化应激反应介导的凋亡过程,而METTL3依赖的m6A RNA甲基化修饰可能在mRNA水平调控氧化应激或抗氧化信号通路关键分子的表达而发挥调控作用,但METTL3调控的靶基因目前还不清楚。该结果为后期深入研究m6A RNA甲基化修饰调控心肌病的机制研究提供新的思路。

