丙烯酰胺母源性暴露对仔鼠海马齿状回DCX和GAP⁃43表达的影响
杨德慧 赖胜敏 古梓婷 刘鸿庆 马宇昕 罗利 李国营 刘靖
广东药科大学基础学院人体解剖学教研室(广州 510006)
丙烯酰胺(acrylamide,ACR)是一种可溶于水的乙烯基单体,其复合体聚丙烯酰胺广泛应用于化工行业[1]。业已证实ACR对人和动物具有神经毒性,能够选择性地损害中枢神经和周围神经的神经元终末,出现共济失调、肢体乏力、四肢麻木、感觉障碍等一系列临床症状[2]。然而关于ACR神经发育毒性报道较少,胎儿和婴儿正处于神经系统发育重要阶段,特别是血脑屏障尚未发育成熟,可能更容易受到各种有害因素的损伤,特别是神经毒物。在中枢神经系统发育过程中,双皮质素(doublecortin,DCX)和生长相关蛋白⁃43(growth associated protein⁃34,GAP⁃43)共同参与了神经元生成和发育的全过程。其中,DCX是一种微管相关蛋白,在神经元分化和迁移过程中阶段性地表达于神经元的突起和胞体上,其阳性细胞的数量可以反映海马齿状回新生神经元的增殖情况[3]。另外,GAP⁃43是一种促进神经元修复与合成的胞膜上的特异性磷酸蛋白,能够促进神经元轴突的延伸[4]。
因此,本实验通过建立ACR母源性暴露,检测仔鼠海马齿状回DCX和GAP⁃43的表达情况进行探讨ACR对神经元的生长发育的影响,为研究ACR的神经发育毒性提供理论和实验依据,有利于优生优育。
1 材料与方法
1.1 主要试剂ACR(美国Sigma公司,纯度99.9%)、Rabbit Anti⁃DCX(美国 Abcam 公司)、Rabbit Anti⁃GAP⁃34(武汉博士德生物公司)、HRP标记山羊抗兔(美国Ear thox公司)。
1.2 实验动物6周龄级SD大鼠由广东省医学实验动物中心提供,许可证号SCXK(粤)2013⁃0002。雌鼠32只,雄鼠16只,体质量140~160 g,所有实验动物在SPF级的条件下自由摄食和饮水,雌鼠怀孕后单笼饲养。
1.3 动物分组及染毒SD大鼠体成熟后,雌雄以1∶1进行交配,孕鼠随机分为4组,分别为对照组(0 mg/kg)、低(4.5 mg/kg)、中(9 mg/kg)和高(18 mg/kg)剂量组,每组8只。于母鼠妊娠第15天开始灌胃给药,连续给药至分娩后第13天,分娩后第14天,对仔鼠进行取材。
1.4 动物取材仔鼠出生后第14天,在4%水合氯醛腹腔注射麻醉下,以0.9%生理盐水冲洗和4%多聚甲醛溶液灌注,灌注固定后取脑置于4%多聚甲醛中固定48 h,组织常规脱水和石蜡包埋,用于免疫组织化学检测。
1.5 免疫组织化学检测切片常规脱蜡至水,在0.01 mol/L pH 6.0柠檬酸缓冲液中微波修复20 min,3%H2O2⁃PBS室温处理30 min,5%BSA封闭液37℃封闭30 min,于4℃冰箱孵育一抗过夜。次日滴加HRP标记的二抗在37℃孵育40 min。DAB显色4.5 min,切片置于ddH2O终止显色。苏木素染色15 s,自来水返蓝2 min。切片继续脱水后用中性树脂封片。封片后选取每组每只大鼠2张切片,随机选取3个视野,用Image pro⁃plus 6.0图像分析软件计算免疫阳性表达物积分光密度值(IOD)。
1.6 统计学方法利用Image pro⁃plus 6.0图像分析软件进行光密度值分析,阳性表达物的平均光密度值,以表示,结果采用统计软件SPSS 17.0进行统计学分析,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 ACR对P14仔鼠海马齿状回GAP⁃43表达的影响 见图1,GAP⁃43阳性表达物为黄棕色物质,环绕细胞核分布,呈中空状。GAP⁃43能够调节轴突的生长,是神经元发育过程中的标志位之一。与对照组和低剂量组相比较,中、高剂量组仔鼠海马齿状回GAP⁃43均明显有减少(P<0.01)。见图2。
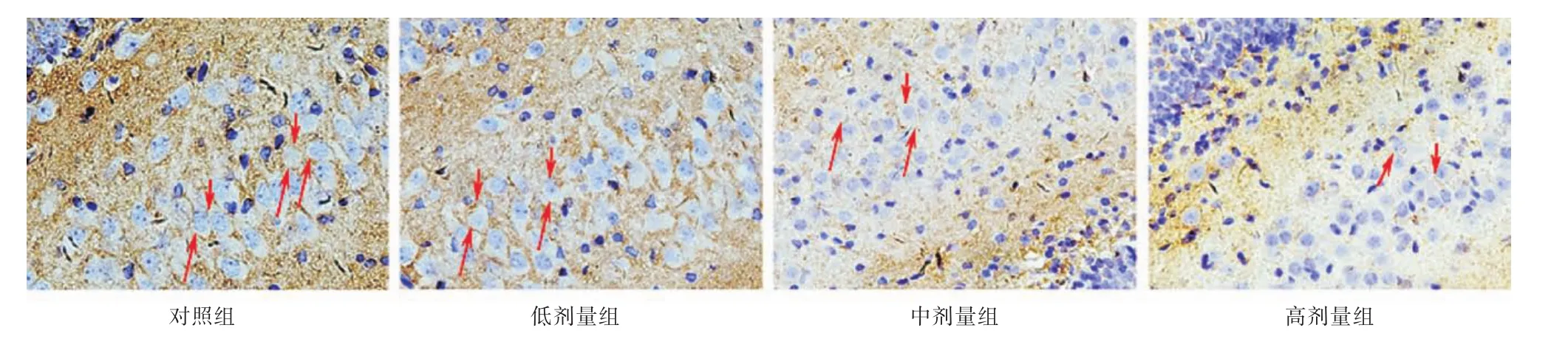
图1 各实验组仔鼠海马GAP⁃43的表达情况(IHC×400)Fig.1 Effect of ACR on expression of GFAP in the hippocampal mother rats

表1 ACR染毒对仔鼠海马齿状回GAP⁃43表达的影响Tab.1 Effect of ACR on expression of GAP⁃43 in the hippocampal dentate of offsprings(n=8) x± s
2.2 ACR对P14仔鼠海马齿状回DCX表达的影响本实验通过免疫组织化学方法检测P14仔鼠海马齿状回中DCX的阳性表达来检测神经元突起形成的情况。与对照组相比较,ACR中、高剂量组仔鼠海马齿状回DCX的阳性表达物均显著减少(P<0.01)。
3 讨论

图2 各实验组仔鼠海马DCX的表达情况(IHC×400)Fig.2 Effect of ACR on expression of DCX in the hippocampal mother rats
表2 ACR染毒对仔鼠海马齿状回DCX表达的影响Tab.2 Effect of ACR on expression of DCX in the hippocampal dentate of offsprings(n=8)±s

表2 ACR染毒对仔鼠海马齿状回DCX表达的影响Tab.2 Effect of ACR on expression of DCX in the hippocampal dentate of offsprings(n=8)±s
注:与对照组相比较,*P<0.05,**P<0.01
组别对照组低剂量组中剂量组高剂量组IOD of DCX 9.37±0.70 7.75±0.39 6.21±0.33*4.43±0.56**
ACR是生产聚丙烯酰胺的原材料,广泛应用于各行业。动物实验业已证实ACR具有多种毒性,并在人体发现其神经毒性。ACR可以通过多种途径进行传播,胎盘和哺乳亦是ACR传播的方式[1]。ACR的神经毒性具有累积性,低剂量长期染毒和高剂量短期染毒均可导致明显的神经毒性[5]。ACR母源性暴露后,胎儿和婴儿的健康与安全受到威胁[6]。海马属于边缘系统的一部分,不但与学习、记忆、情绪等相关,其中齿状回颗粒下层(subgranular zone,SGZ)更是神经发生和神经再生的重要部位之一。神经干细胞位于海马门区与颗粒细胞层之间的颗粒下层,新生成的神经元从颗粒下层移入颗粒层,接受突触传入冲动,把轴突伸进苔状纤维通路,整合到海马功能的神经环路中,参与海马的学习记忆等功能活动[7]。有研究显示,母鼠通过饮水摄入ACR后,仔鼠海马齿状回Reelin免疫反应细胞和谷氨酸脱羧酶67免疫反应细胞呈剂量依赖性的增加,ACR干扰了海马齿状回神经元的迁移和定位[8]。而在中枢神经系统的发育过程中,神经元所分泌的蛋白GAP⁃43和DCX共同参与调节神经元的生长与发育。因此,我们通过检测仔鼠海马GAP⁃43和DCX表达情况,研究ACR对神经元发育的影响。
在本研究中,ACR暴露后,与对照组相比较,中、高剂量组仔鼠海马齿状回GAP⁃43的表达明显下降。GAP⁃43是一种磷酸蛋白,特异性地表达于神经元胞膜上,调节轴突的生长、突触的形成和神经递质的释放[9-10]。在神经元发育过程中,GAP⁃43引导轴突生长和调节突触联系中发挥着重要作用[9]。GAP⁃43表达的含量与轴突的生长、突触的塑造状态相一致[11]。在神经系统发育过程中,GAP⁃43有较高的表达,被认为是神经元发育和再生的一个内在决定因子,能够促进神经元轴突的生长[12]。GAP⁃43的减少将降低轴突结构的可塑性,包括轴突与树突的发芽,其表达与神经元轴突和树突的功能呈正相关[13⁃14]。由此笔者推测,GAP⁃43表达减少后,神经元轴突和树突的发育受到了抑制。另外,本研究通过免疫组织化学法检测发现,ACR暴露后仔鼠海马齿状回DCX亦显著表达减少。DCX是一种微管相关蛋白,在神经元分化、迁移过程中阶段性地表达于神经元周围的突起和胞体上,参与神经元突起的形成与发育[3]。DCX可促进微管聚合并稳定其网络结构,在神经元迁移过程中控制着神经元的聚合,稳定细胞骨架[15]。DCX表达下降,提示ACR母源性暴露可能导致仔鼠海马神经发生、分化受到抑制。有实验报道,把ACR注射到小鼠体内后,能够抑制其海马齿状回增殖活性,新生神经元减少[16]。ACR母源性暴露后,仔鼠海马齿状回GAP⁃43和DCX的表达均下降,提示ACR可能影响海马神经元的增殖、分化以及神经元轴突的延伸。ACR的神经发育毒性作用可能是多因素的,其作用机制尚有待进一步研究。
综上所述,母源性暴露后ACR能够减少仔鼠大脑GAP⁃43和DCX的表达,可能抑制了海马神经元的生长发育。而海马区与学习、记忆等高级功能密切相关,ACR母源性暴露后可能会影响到仔鼠空间学习和记忆能力发展[17]。
[1]ERKEKOGLU P,BAYDAR T.Acrylamide neurotoxicity[J].Nutr Neurosci,2014,17(2):49⁃57.
[2]LOPACHIN R M,GAVIN T.Acrylamide⁃induced nerve termi⁃nal damage:relevance to neurotoxic and neurodegenerative mechanisms[J].J Agric Food Chem,2008,56(15):5994⁃6003.
[3]FRANCIS F,KOULAKOOF A,BOUCHER D,et al.Double⁃cortin is a developmentally regulated,microtubule⁃associated protein expressed in migrating and differentiating neurons[J].Neuron,1999,23:247⁃256.
[4]陈庆友,师岩,王中华.丁苯酞改善血管性痴呆大鼠认知功能及其对海马区GAP⁃43和突触素表达的影响[J].中国老年学杂志,2016(8):1830⁃1831.
[5]LOPACHIN R M.Acrylamide neurotoxicity: neurological,morhological and molecular endpoints in animal models[J].Adv Exp Med Biol,2005,561:21⁃37.
[6]FRIEDMAN M A,TYL R W,MARR M C,et al.Effects of lac⁃tational administration of acrylamide on rat dams and offspring[J].Reprod Toxicol,1999,13(6):511⁃520.
[7]ZHAO C,DENG W,GAGE F H.Mechanisms and functional implications of adult neurogenesis[J].Cell,2008,132(4):645⁃660.
[8]OGAWA B,OHISHI T,WANG L,et al.Disruptive neuronal development by acrylamide in the hippocampal dentate hilus af⁃ter developmental exposure in rats[J].Arch Toxicol,2011 ,85(8):987⁃994.
[9]DONNEIIL C J,PARK M,SPILLANE M,et al.Axonally syn⁃thesized β⁃actin and GAP⁃43 proteins support distinct modes of axonal growth[J].J Neurosci,2013,33(8):3311⁃3322.
[10]MUTTUCUMARU N,POWERS S J,ELMORE J S,et al.Acrylamide⁃forming potential of potatoes grown at different loca⁃tions,and the ratio of free asparagine to reducing sugars at which free asparagine becomes a limiting factor for acrylamide⁃formation[J].Food Chem,2017,220:76⁃86.
[11]GUPTA S K,MISHRA R,KUSUM S,et al.GAP⁃43 is essen⁃tial for the neurotrophic effects of BDNF and positive AMPA re⁃ceptor modulator S18986[J].Cell Death Differ,2009,16(4):624⁃637.
[12]张征宇,袁宝莉,邓素娟.1,6⁃二磷酸果糖对脑白质损害大鼠皮质生长相关蛋白43表达的影响[J].实用医学杂志,2011,27(13):2330⁃2333.
[13]CHEN M Y,WANG E H,WOODSON W J,et al.Optogenetic neuronal stimulation promotes functional recovery after stroke[J].Proc Natl Acad Sci USA,2014,111(35):12913⁃12918.
[14]SHAH A M,ISHIZAKA S,CHENG M Y,et al.Optogenetic neuronal stimulation of the lateral cerebellar nucleus promotes persistent functional recovery after stroke[J].Sci Rep,2017,7:46612.
[15]MERZ K,LIE D C.Evidence that Doublecortin is dispensable for the development of adult born neurons in mice[J].PLoS One,2013,8(5):e62693.
[16]PARK H R,KIM M S,KIM S J,et al.Acrylamide induces cell death in neural progenitor cells and impairs hippocampal neurogenesis[J].Toxicol Lett,2010,193(1):86⁃93.
[17]刘富,兵尹力,朱宇航,等.异氟醚对老年大鼠学习记忆能力及海马NMDAR1表达的影响[J].实用医学杂志,2016,32(1):34⁃37.

