掺锶透钙磷石骨水泥修复骨质疏松家兔牙槽骨缺损的实验研究
方俊 董伟 彭宏峰 徐艳丽 贾婉萍 梁立硕 梁永强
华北理工大学口腔医学院1正畸科,2颌面外科(河北唐山 063000)
2000年我国卫生部门的统计显示,我国骨质疏松症的发生率占全国总人口的7%左右。有研究显示,骨质疏松患者发生骨折的概率高且愈合更加困难[1]。与正常骨组织相比,骨质疏松患者的成骨细胞的数量和活性均有降低,骨缺损修复较慢[2]。
透钙磷石复合材料是一种具有良好生物相容性和成骨作用的骨修复材料,但因其降解速度过快,常导致骨修复作用并不明显。锶可以影响骨基质的形成,促进新骨生成,并且锶还可以抑制骨的吸收[3-4]。将锶元素加入透钙磷石中,利用透钙磷石良好的溶解性可以将锶元素很好地释放到缺损部位,从而促进骨缺损的愈合。实验将探究掺锶5%透钙磷石骨水泥对骨质疏松家兔骨缺损的修复效果,以期在修复中能起到一定的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组健康成年雌性家兔18只,体质量2.5~2.7 kg,由华北理工大学动物实验中心提供,随机分为3组,分别为空白对照组、透钙磷石组和掺锶5%透钙磷石组,每组各6只。所有实验操作均遵循动物伦理委员和管理委员会的规定。
1.1.2 主要试剂二水合磷酸氢钙,碳酸钙,无水乙醇,磷酸二氢钙,焦磷酸钠,氯化锶,乙醇酸。
1.2 方法
1.2.1 骨水泥的制备将250 g二水合磷酸氢钙和72.7 g碳酸钙充分溶解于500 mL超纯水中,样品充分干燥后研磨,在1 100℃的马弗炉中煅烧10 h。将煅烧后的样本以无水乙醇为介质充分研磨,将分散液离心除去乙醇,在60℃的烘干箱中干燥48 h,将样本磨碎得到β⁃磷酸三钙粉末。用β⁃磷酸三钙、磷酸二氢钙和焦磷酸钠制备成透钙磷石骨水泥,以锶/(锶+钙)为10%在透钙磷石中加入氯化锶制得掺锶5%透钙磷石骨水泥,将制得的骨水泥在模具中固化定型,24 h后取出,紫外线消毒备用。
1.2.2 骨质疏松模型的制备用2 mL/kg的水合氯醛从耳缘静脉给药进行麻醉,在无菌环境下,从腹白线处切开腹膜约2 cm,在子宫上方寻找两侧卵巢,切除两侧卵巢,关闭腹腔,伤口撒青霉素。术后每日肌注青霉素160万U。术后1周,骨质疏松组开始肌注地塞米松,0.5 mg/kg,每周2次,共8周。
1.2.3 骨水泥的植入用2 mL/kg的水合氯醛从耳缘静脉给药进行麻醉,在无菌环境下沿兔口角下紧贴下颌骨上缘、口角后10 mm处皮肤,向磨牙方向做一长约20 mm的切口,暴露下颌骨骨面用低速手机在颏孔前1 mm处做一长10 mm、宽4 mm、高3 mm的骨缺损,取消毒好的骨水泥块,生理盐水冲洗后置于骨缺损处,缝合伤口,术后3 d每日肌注青霉素40万U[5]。
1.2.4 观察指标和方法(1)骨质疏松模型的测定:随机选取9只家兔用于骨密度的测量,分别在术前3 d、术后8、12周进行家兔腰椎骨密度(bone mineral density,BMD)的测量。术后BMD小于术前BMD减去2倍标准差则表示造模成功[6]。(2)骨损修复的测定:于术后4、8周处死各组动物3只,分离取出下颌骨,生理盐水冲洗,于固定液中固定12 h后拍摄X线片,观察骨缺损的修复情况。将分离的下颌骨完全浸入脱钙液中,每3天更换一次脱钙液,4℃下保存8周,充分清洗后,常规石蜡包埋、切片。免疫组化观察b⁃FGF的表达,用Image⁃Pro Plus6.0软件测量各组的光密度值(MOD值)进行比较。
1.3 统计学方法采用SPSS 20.0分析数据,采用单因素方差分析,检验水准α=0.05。
2 结果
2.1 骨质疏松模型的建立BMD结果显示术前3 d、术后8、12周家兔BMD值有差异(P<0.05);12周时术后BMD小于术前BMD减去2倍标准差,提示造模成功。
2.2 X线表现根据新骨形成的X线评价系统对修复情况进行评价,计算各组的平均得分[7],新生骨占缺损底部到顶部距离的0%~25%,记1分;新生骨占缺损底部到顶部距离的26%~50%,记2分;新生骨占缺损底部到顶部距离的51%~75%,记3分;新生骨占缺损底部到顶部距离的76%~100%,记4分;未见新生骨生成,记0分。术后4周,空白组呈明显的缺损低密度影,平均得分0;透钙磷石组缺损区可见明显的高密度块状影,为骨水泥未吸收影像,有少量新生骨生成,平均得分0.3;5%掺锶透钙磷石组缺损区有雾状高密度影出现,提示骨水泥大部分溶解,可见缺损底部有新骨生成,平均得分1。术后8周,空白组缺损区域修复呈浅凹坑状,平均得分1.7;透钙磷石组缺损区大部分修复,缺损表面有凹陷,平均得分3.2;5%掺锶透钙磷石组缺损区基本修复,可见明显的骨小梁结构,平均得分4。见图1、2。2.3 免疫组化结果利用Image⁃Pro Plus 6.0分析得出其MOD值来评价其阳性率。4周时,3组的阳性表达率均较高,5%掺锶透钙磷石组>透钙磷石组>空白组,空白组缺损边缘有少量的成纤维细胞;透钙磷石组缺损区有成纤维细胞和成骨细胞聚集;5%掺锶透钙磷石组中可见大量的成骨细胞、成纤维细胞和血管内皮细胞。8周时,3组阳性表达率有所降低,5%掺锶透钙磷石组>透钙磷石组>空白组,空白组未见新骨形成;透钙磷石组有骨小梁存在,周围有少量基质呈阳性表达;5%掺锶透钙磷石组有骨性结构存在,b-FGF阳性表达部位较少。见图3、4、表1。
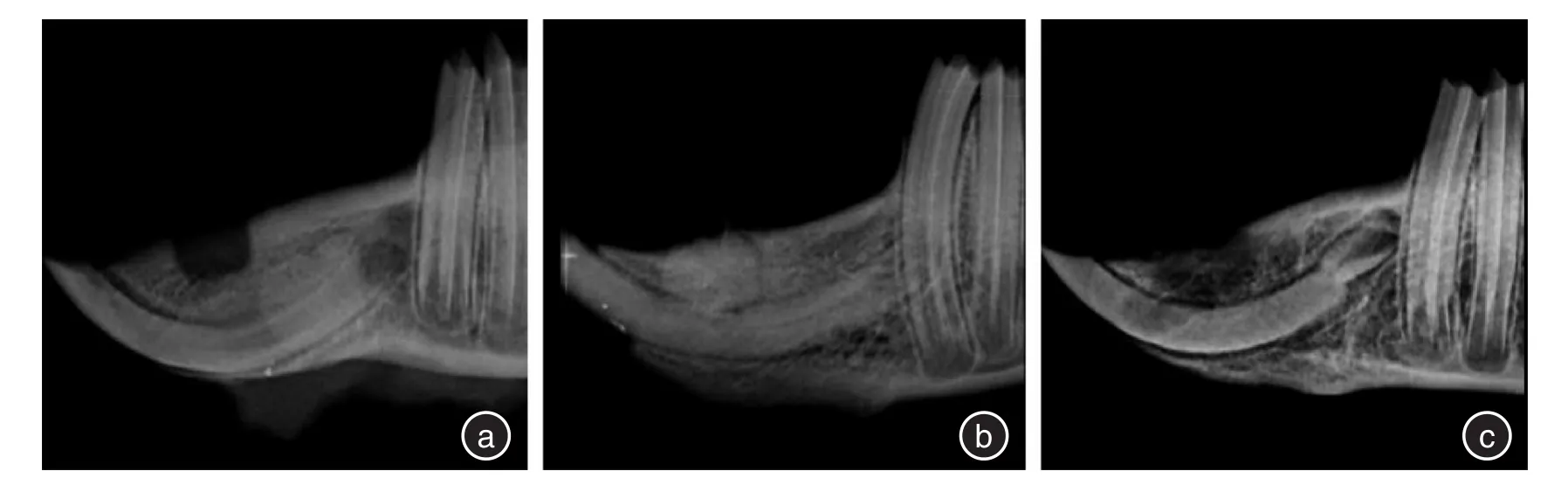
图1 4周时3组X线结果Fig.1 The X⁃ray results of the 3 groups at 4 weeks
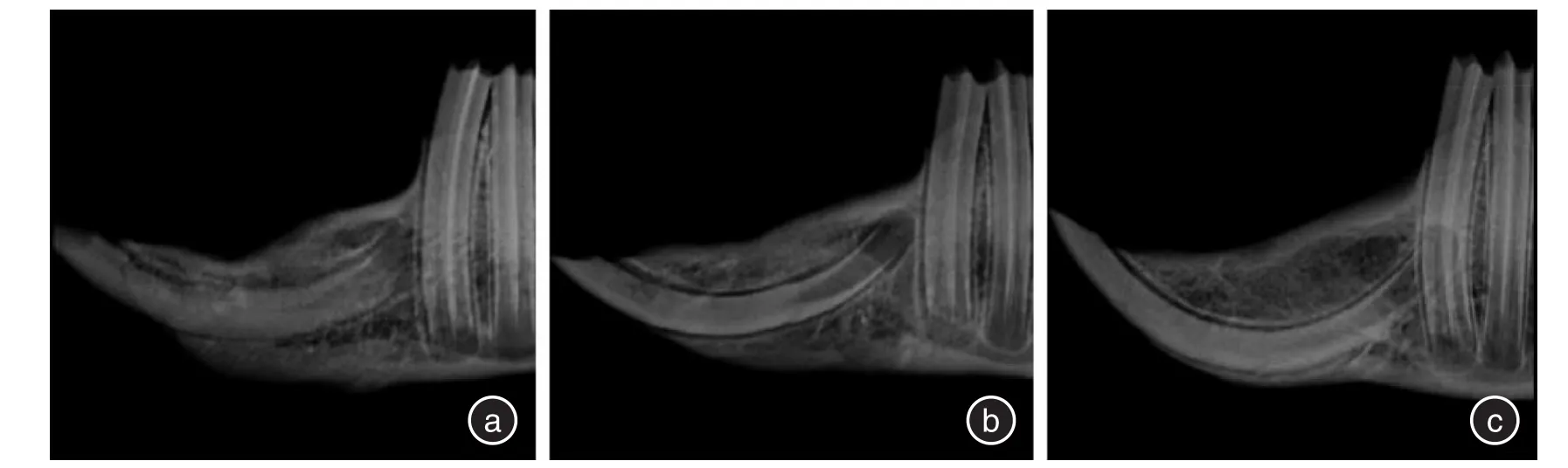
图2 8周时3组X线结果Fig.2 The X⁃ray results of the 3 groups at 4 weeks
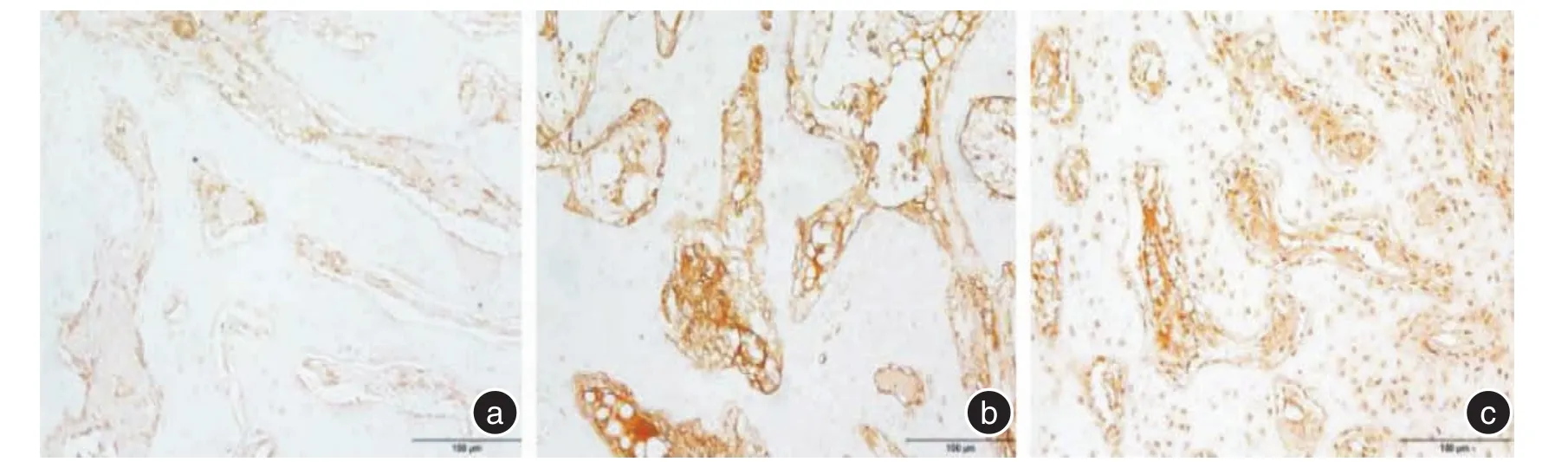
图3 4周时3组b⁃FGF的表达情况(× 200)Fig.3 The expression of the 3 groups of b⁃FGF at 4 weeks(× 200)
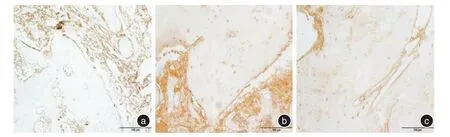
图4 8周时3组b⁃FGF的表达情况(× 200)Fig.4 The expression of the 3 groups of b⁃FGF at 8 weeks(× 200)
3 讨论
透钙磷石骨水泥是临床常用的一种骨修复材料,具有良好的生物相容性、溶解性和生物活性[8]。本实验为了能够同时观察骨水泥的溶解情况和新骨的生成情况,从而判断掺锶透钙磷石在体内是否会加速溶解,并且能够促进新骨的生成,故采用X线片来观察缺损区的修复情况。黄旋平等[9]的实验说明了通过X线评判新生骨的可行性。ZHAO等[7]的实验提供了一种通过X线评判新生骨的方法。实验中X线片结果显示:4周时,透钙磷石组骨水泥基本未溶解吸收,而5%掺锶透钙磷石组骨水泥大部分溶解吸收,且新骨生成的量平均要大于透钙磷石组,说明在加入5%的锶后,透钙磷石的溶解性更好。原因可能是锶元素和钙元素相近,但离子半径要大于钙离子,透钙磷石中的钙被锶替换后,其单位体积变大,原有晶格发生畸变,从而改变原有材料的结晶性和生物降解性,所以掺锶透钙磷石的降解性会更好,更有利于骨组织的修复[11,17]。8周时,5%掺锶透钙磷石组的骨修复能力优于透钙磷石组,原因可能是加入锶元素后的透钙磷石骨水泥溶解速度加快,锶元素被大量释放,而锶元素具有增强前成骨细胞的复制和成骨细胞的功能性活动,并且可以抑制破骨细胞的吸收,从而促进了新骨的形成[12,18]。LUO等[10]的实验表明掺锶透钙磷石骨水泥在体外模拟实验中有很好的溶解性,且能诱导新骨的生成。本实验表明掺锶透钙磷石骨水泥在动物体内也能有很好的溶解性和诱导新骨形成,为以后临床的应用提供了进一步的依据。
表1 各组b⁃FGF阳性表达部位MOD值的比较Tab.1 Comparison of MOD values of positive expression sites of b⁃FGF in each group(n=3) ±s

表1 各组b⁃FGF阳性表达部位MOD值的比较Tab.1 Comparison of MOD values of positive expression sites of b⁃FGF in each group(n=3) ±s
注:与空白组比较,*P<0.05;与透钙磷石组比较,#P<0.05
组别空白组透钙磷石组5%掺锶透钙磷石组F值P值4周0.166 5±0.019 3 0.208 2±0.018 2*0.243 6±0.015 1*#75.008<0.001 8周0.136 7±0.018 7 0.158 7±0.015 4*0.184 7±0.017 6*#37.924<0.001
b⁃FGF是人体内重要的生长因子之一,可由骨髓基质细胞和成骨细胞等分泌,储存于细胞外基质中[13]。实验4、8周时,5%透钙磷石组中的b⁃FGF阳性表达率均高于其他两组,可能原因是锶元素促进成骨细胞的生成,成骨细胞分泌大量的b⁃FGF,而b⁃FGF通过刺激毛细血管内皮细胞的迁移和增殖,促进毛细血管的形成,缺损区大量毛细血管的生成,又给其带来丰富的营养物质和钙元素,供其修复,且还可以带来大量的间充质细胞,间充质细胞进一步转化为成骨细胞,参与新骨的形成[14,16]。这可能就是免疫组化结果中观察到大量血管内皮细胞和成纤维细胞的原因。在8周时,5%掺锶透钙磷石组的b⁃FGF的阳性表达率较4周时要低,原因可能是8周时新骨趋于成熟,其中的毛细血管会相应减少,成骨细胞和成纤维细胞活动减少,导致了b⁃FGF的阳性表达率有所降低。有学者认为b⁃FGF在缺损修复的后期会失去作用[15],但实验中8周时5%掺锶透钙磷石组的阳性表达率依旧较其他两组高,说明锶元素在修复的后期依旧能对骨质疏松骨缺损的修复起到一定的促进作用。
总之,5%掺锶透钙磷石可以很好地修复骨质疏松家兔下颌骨的缺损,为骨质疏松骨缺损的修复提供了一些借鉴价值,其可能原因是促进了b⁃FGF的大量生成,但未从分子机制方面得到印证,今后的实验可以从具体的信号途径进行更深入的研究。
[1]GOURLAY M L,OVERMAN R A,FINE J P,et al.Time to Osteoporosis and Major Fracture in Older Men:The MrOS Study[J].Am J Prevent Med ,2016,50(6):727⁃736.
[2]COIPEAU P,ROSSET P,LANGONNE A,et al.Impaired dif⁃ferentiation potential of human trabecular bone mesenchymal stromal cells from elderly patients[J].Cytotherapy,2009,11(5):584.
[3]CHOUDHARY S,HALBOUT P,ALANDER C,et al.Stron⁃tium Ranelate Promotes Osteoblastic Differentiation and Miner⁃alization of Murine Bone Marrow Stromal Cells:Involvement of Prostaglandins[J].J Bone Miner Res,2007,22(7):1002⁃1010.
[4]FONSECA J E.Rebalancing bone turnover in favour of forma⁃tion with strontium ranelate:implications for bone strength[J].Rheumatology,2008,47(4):17⁃19.
[5]荣子杰,杨联军,张赞杰,等.载ADM⁃PLGA微球的纳米羟基磷灰石/胶原支架修复兔骨缺损的实验研究[J].实用医学杂志,2014,30(22):3559⁃3562.
[6]ZHANG Z,REN H,SHEN G,et al.Animal models for gluco⁃corticoid⁃induced postmenopausal osteoporosis:An updated re⁃view.[J].Biomed Pharmacother,2016,84:438⁃446.
[7]ZHAO M D,HUANG J S,ZHANG X C,et al.Construction of radial defect models in rabbits to determine the critical size De⁃fects[J].PLoS One,2016,11(1):e0146301.
[8]ALGE D L,GOEBEL W S,CHU T M.Effects of DCPD ce⁃ment chemistry on degradation properties and cytocompatibili⁃ty:comparison of MCPM/β ⁃TCP and MCPM/HA formulations[J].Biomed Mater,2013,8(2):025010.
[9]黄旋平,周诺,杨媛媛,等.hBMP⁃2基因修饰自体BMSCs移植促进兔下颌骨牵张成骨新骨形成的X线分析[J].实用口腔医学杂志,2012,28(4):457⁃460.
[10]LUO X,BARBIERI D,ZHANG Y,et al.Strontium⁃Contain⁃ing Apatite/Poly lactide composites favoring osteogenic differen⁃tiation and in vivo bone formation[J].Acs Biomater Sci Eng,2015,1(2):150126133543001.
[11]ALKHRAISAT M H,RUEDA C,CABARCOS E L.Strontium ions substitution in brushite crystals:the role of strontium chlo⁃ride[J].J Funct Biomat,2011,2(2):31⁃38.
[12]SCHUMACHER M,WAGNER A S,KOKESCH⁃HIMMEL⁃REICH J,et al.Strontium substitution in apatitic CaP cements effectively attenuates osteoclastic resorption but does not inhibit osteoclastogenesis[J].Acta Biomaterialia,2016,37:184⁃194.
[13]NISSEN N N,GAMELLI R L,POLVERINI P J,et al.Differ⁃ential angiogenic and proliferative activity of surgical and burn wound fluids[J].J Trauma Acute Care Surg,2003,54(6):1205⁃1210.
[14]尹飚,苏增贵,彭杰,等.碱性成纤维细胞生长因子影响兔成骨细胞增殖与分化的实验研究[J].广州医学院学报,2001,29(1):22⁃25.
[15]RIVERA J C,STROHBACH C A,WENKE J C,et al.Beyond osteogenesis:anin vitrocomparison of the potentials of six bone morphogenetic proteins[J].Front Pharmacol,2013,4:125.
[16]EL BACKLY R M,ZAKY S H,MURAGLIA A,et al.A plate⁃let⁃rich plasma⁃based membrane as a periosteal substitute with enhanced osteogenic and angiogenic properties:a new concept for bone repair[J].Tissue Engineering Part A,2013,19(1⁃2):152.
[17]TAHA A,AKRAM M,JAWAD Z,et al.Strontium doped in⁃jectable bone cement for potential drug delivery applications[J].Mater Sci Eng C Mater Biol Appl,2017,80:93⁃101.
[18]SINGH S S,ROY A,LEE B,et al.Murine osteoblastic and os⁃teoclastic differentiation on strontium releasing hydroxyapatite forming cements[J].Mater Sci Eng C Mater Biol Appl,2016,63:429⁃438.

