敲低及过表达G6PD对肝癌细胞增殖和迁移的影响
冯笑 刘兆宇 胡腊 陈纪涛 曾子成 刘季芳
广州医科大学附属第五医院(广州510710)
自 1956 年 WARBURG[1]提出肿瘤细胞中的Warburg现象以来,迄今已有许多研究证明在肿瘤中存在多种代谢途径的变化,代谢改变已被归纳为肿瘤的特征之一[2]。有研究证明,致瘤性损伤能够诱导葡萄糖流量进入磷酸戊糖途径(PPP)[3],肿瘤中PPP的改变是肿瘤代谢特征的重要部分。而6-磷酸葡萄糖脱氢酶(G6PD)作为PPP的关键酶,控制着经PPP的糖流量,对PPP的研究重点在于对G6PD的研究。
G6PD的基因位于Xq28.1,长18 kd,含13个外显子和12个内含子,近年研究表明,G6PD的表达与肿瘤存在密切关联,其在胃癌[4]、黑色素瘤[5]、膀胱癌[6]、肾透明细胞癌[7]多种肿瘤组织标本中表达量上升,在胃癌[4]、食管鳞癌[8]、乳腺癌[9]中 G6PD的表达量与肿瘤患者的临床预后及生存期呈负性相关,也有研究发现G6PD可通过促进血管生成促进肿瘤生长[10]。G6PD如今被视为一种与临床预后相关的癌基因及肿瘤标志物,在肿瘤的生存、增殖、转移中都发挥着重要作用。原发性肝癌作为一种常见癌症,与机体的糖代谢异常存在相关性[11],用于治疗代谢性疾病糖尿病的二甲双胍能够改变肝癌细胞的线粒体形态及功能[12],这提示肝癌细胞中的代谢也存在异常。过往对肝癌中G6PD基因的研究较少,有研究证实在HBV相关肝癌细胞中,G6PD通过HBV提高自身表达量来促进肿瘤发展[13]。之前的研究往往认为G6PD是一种促癌基因,因而忽略了对于已经发生癌变的癌细胞,高水平G6PD可能产生的后果。本研究补充了肝癌这一方面的研究,以肝癌细胞株PLC/PRF/5同时建立了G6PD敲低及过表达的细胞株,并对它们进行了增殖及迁移生物学功能的初步探索,为之后深度研究G6PD及PPP对肝癌的影响打下了基础。
1 材料与方法
1.1 材料
1.1.1 菌株与细胞株大肠杆菌DH5α、293T细胞株、过表达、干扰质粒及慢病毒包装质粒购自广州复能有限公司,PLC/PRF/5细胞株购自中国科学院细胞库。
1.1.2 试剂质粒提取试剂盒购自Omega公司、G6PD活性检验试剂盒购自Biovison公司、NADP/NADPH含量测定试剂盒购自Sigma公司、Trizol及Lipofectamine 3000购自Invitrogen公司,G6PD、GAPDH抗体及二抗均购自CST,反转录试剂盒、RTPCR试剂盒购自Takara,EDU试剂盒购自广州锐博生物科技有限公司。
1.1.3 仪器实时荧光定量PCR仪(ABI7500)、化学发光成像系统(伯乐ChemiDoc XRS+),超微量分光光度计(BioTeKEpoch2)、倒置荧光显微镜(莱卡DMi8)、双模块PCR仪(伯乐S100048/48双模)、细胞计数仪(Countstar IC⁃1000)、RealTime Cellular Analysis(RTCA)System来自美国艾森公司。
1.2 实验方法
1.2.1 细胞培养从液氮罐中取出冻存细胞PLC/PRF/5及293T,37℃水浴锅快速复苏,以DMEM+10%FBS培养,置于37℃5%CO2孵箱培养,定时换液、传代。
1.2.2 Real⁃time PCR检测以Trizol提取细胞总RNA,以此检测各组细胞中G6PD mRNA表达,G6PD real⁃time PCR 的引物为 Forward:5′⁃CGCCT⁃CACAGTGGCTGACATC⁃3′,Reverse:5′⁃ACCCCAG⁃GTGGAGGGCATT ⁃3′,GAPDH的引物为:Forward:5′⁃ATCACCATCTTCCAGGAGCGAG⁃3,Reverse:′5′⁃GGGCAGAGATGATGACCCTTTTG⁃3′,按说明书配制反应体系,反应体系20 μL,以95℃反应10 min,再以 95℃ 15 s、60℃ 60 s扩增40个循环。
1.2.3 Western blot检测以冷冻PBS清洗6孔板中细胞2次,每孔加入400 mL RIPA细胞裂解液,置于冰上裂解15 min,4℃13 000g离心10 min,取上层澄清液体,加入5×loading buffuer,留取部分以BCA法测定总蛋白浓度。以1×loading buffer调节两组蛋白浓度至一致,取约50 μg的总蛋白经10%SDS⁃PAGE 胶,经80 V 30 min、120 V 60 min电泳后,以200 mA恒流转膜2 h,经封闭2 h和抗体孵育,通过化学发光成像系统曝光成像。
1.2.4 慢病毒包装、浓缩及滴度测定转染前1 d 293T细胞传代,使次日转染时细胞融合度达70%~80%。在离心管中按量将lipo3000溶于Opti培养基中,于另一管中以3∶2∶1比例将目的质粒、PsPAx2、PVSVg三种质粒溶于Opti培养基并加入p3000,将两管液体轻柔混合,静止5 min后将质粒-脂质体混合液加入293T细胞中并补加完全培养基,之后置于培养箱中培养。于24 h倒置显微镜下观察转染效率(重组慢病毒质粒携带绿色GFP荧光蛋白基因),48及72 h后收集含慢病毒颗粒的培养基,以10 KD超滤离心管浓缩病毒液,检测病毒颗粒滴度,-80℃保存。
1.2.5 细胞株的感染及药物筛选将所收集慢病毒液加入PLC/PRF/5,并加入Polybrene协助感染,观察细胞形态及生长状态无明显异常。48 h观察细胞感染效率。根据前期实验所得PLC/PRF/5细胞株的Puro最小致死浓度(3 μg/mL)加入Puro进行药筛。药筛时间2周,按需换液传代。
1.2.6 EDU增殖实验取对数生长期各组细胞接种至12孔板中,使得次日细胞密度适中(50%~80%)。次日先以配制好的EDU培养基37℃培养2 h,经清洗、细胞固定化、Apollo染色、DNA染色后,置于倒置荧光显微镜下先后以紫光、绿光为激发光曝光,分别得到全细胞及处于复制阶段的细胞核图像,10倍镜及20倍镜下每孔拍照10张,计算处于复制阶段的细胞比例并统计差异。
1.2.7 迁移及增殖曲线记录取对数生长期细胞计数,以无血清DMEM调整细胞密度至1×105个/mL,接种至与仪器配套的12孔迁移板上室中(200 μL/孔),下室中加入100 μL血清,位于孔板底部的金属电极将记录穿室细胞的电阻以反映细胞迁移能力,记录观察48 h内的迁移曲线。增殖曲线依同理记录100 h内细胞生长指数数据。
1.2.8 克隆形成实验取对数生长期细胞消化吹打成单细胞,以细胞计数仪计算细胞悬液中细胞密度,每组细胞以100个每孔接种至6孔板中,加入完全培养基至2 mL,吹打细胞使其分布均匀,置于培养箱中培养2~3周。按时观察,至出现肉眼可见克隆时,终止培养,弃上清PBS清洗,以4%多聚甲醛固定细胞15 min,后以0.1%结晶紫染色液染色15 min,清水浸洗直至洗净,拍照记录克隆形成情况,计算各组克隆形成率(克隆数/接种细胞数×100%)。
1.3 统计学方法所有实验至少重复3次,数据采用SPSS 13.0软件进行分析,数据以表示,组间数据比较采用t检验,P<0.05视为差异有统计学意义。
2 结果
2.1 PLC/PRF/5稳转细胞株的建立鉴定包装G6PD敲低及过表达慢病毒颗粒,经慢病毒感染、Puro药筛PLC/PRF/5细胞株获得荧光稳定的PLC/PRF/5敲低细胞株(PLC⁃G6PD shRNA)及其对照组(PLC⁃Scramble shRNA)、过表达细胞株(PLC⁃Lv201⁃G6PD)及其对照组(PLC⁃Lv201⁃Con)。定量PCR检验mRNA水平变化,敲低效果达92.5%,过表达效果达13.89倍。Western检验蛋白水平变化量,过表达同时明显过表达了G6PD的2种亚型;由灰度值计算,敲低效果则达95.2%(图1)。

图1 RT⁃PCR及Western blot检测敲低及过表达PLC/PRF/5中G6PD的表达情况Fig.1 Detection of mRNA and protein expression of G6PD in G6PD knockdown and overexpression cells PLC/PRF/5 via RT⁃PCR and Western blotting assays
2.2 增殖生长能力的检验据细胞生长曲线可知,PLC⁃G6PD shRNA、PLC⁃Scramble shRNA、PLC⁃Lv201⁃G6PD、PLC⁃Lv201⁃Con四株细胞在接种后第3天进入对数生长期(图2A)。但细胞株PLC⁃G6PD shRNA较对照组倍增时间延长,生长速率明显下降,增殖受到抑制,与PLC⁃Scramble shRNA相比,在培养的第48~ 100小时,PLC⁃G6PD shRNA细胞指数较对照组降低了50.2%~61.25%(图2A),EDU显示的增殖细胞比例较对照组低43.2%(图2B),平均克隆形成率降低了67.2%(P< 0.05)(图2C)。而过表达细胞株PLC⁃Lv201⁃G6PD较对照组PLC⁃Lv201⁃Con增殖及克隆形成实验差异无统计学意义(图A2~C)。
2.3 迁移能力检测由RTCA系统所测的48 h内细胞迁移曲线可知,过表达组细胞与对照组间差异无统计学意义,而敲低细胞株较其对照组,迁移能力显著降低(图3)。
3 讨论
磷酸戊糖途径不论在正常细胞还是肿瘤细胞中都发挥着重要作用,一方面,PPP可通过其氧化分支产生烟酰胺腺嘌呤二核苷酸(nicotinamide adeninedinucleotide phosphate,NADPH),NADPH 是细胞内重要的还原当量,通过还原性谷胱甘肽(GSH)对细胞内生成的氧自由基、过氧化物清除,避免氧化损伤,是细胞生长和增殖的必要条件;另一方面,PPP通过非氧化分支产生核苷酸合成的重要前体五磷酸核糖(ribose⁃5⁃phosphate,R⁃5⁃P),R⁃5⁃P是细胞增殖分裂的必需物质,对细胞的生长十分重要,尤其对肿瘤细胞而言,在肿瘤细胞中PPP为DNA合成提供了约85%的戊糖[14]。
在本研究中,通过shRNA敲低PPP关键酶G6PD的表达,测得G6PD活性、细胞中NADPH的产量均下降(未发表数据),这与随后实验中细胞增殖、克隆形成及迁移能力显著下降的实验结果相符合。如上所述,PPP的主要产物是NADPH,NADPH可维持细胞中重要还原物质谷胱甘肽GSH的水平,用以减少细胞中的活性氧ROS,减少细胞氧化损伤及凋亡程度,故当G6PD蛋白的功能不足以维持细胞内的氧化还原平衡时,细胞的增殖及克隆形成能力受到抑制,同时,PPP非氧化分支的减弱,减少了肿瘤细胞中磷酸戊糖的供应,也足以抑制细胞的分裂增殖。另一方面,本研究中发现过表达G6PD时,虽然活性G6PD的量相应增加,但是从细胞中的NADPH含量直至细胞的增殖、迁移均未发生存在统计学差异的变化,这也许因为细胞正常生长中G6PD的量已然足够维持细胞中的氧化还原平衡,故而虽然细胞中的G6PD总量以及活化形式的G6PD含量上升,却不会改变细胞中氧化还原的底物、产物间的平衡。
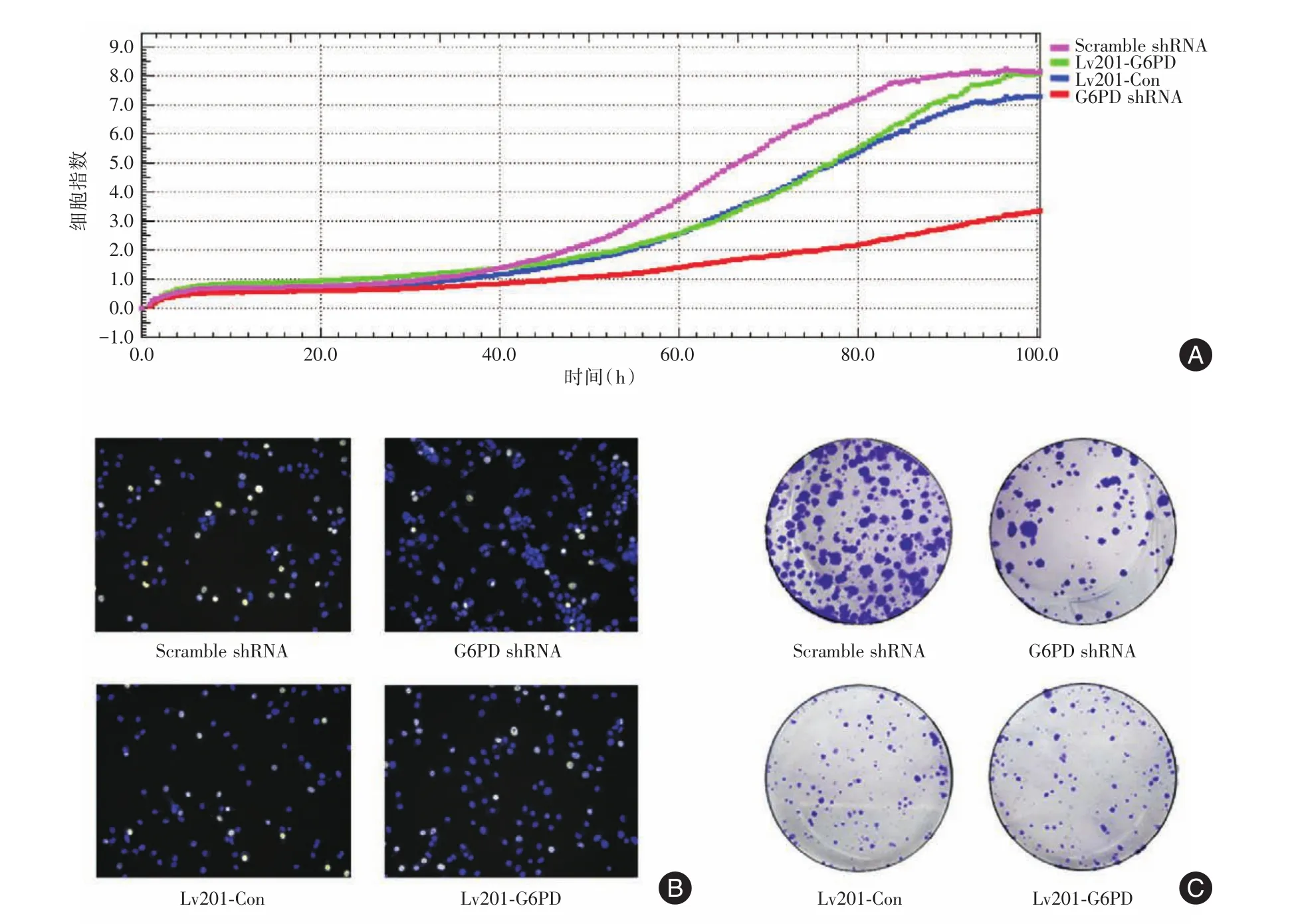
图2 G6PD敲低及过表达细胞增殖及生长情况Fig.2 Cell proliferation and growth in G6PD knockdown and overexpression cells
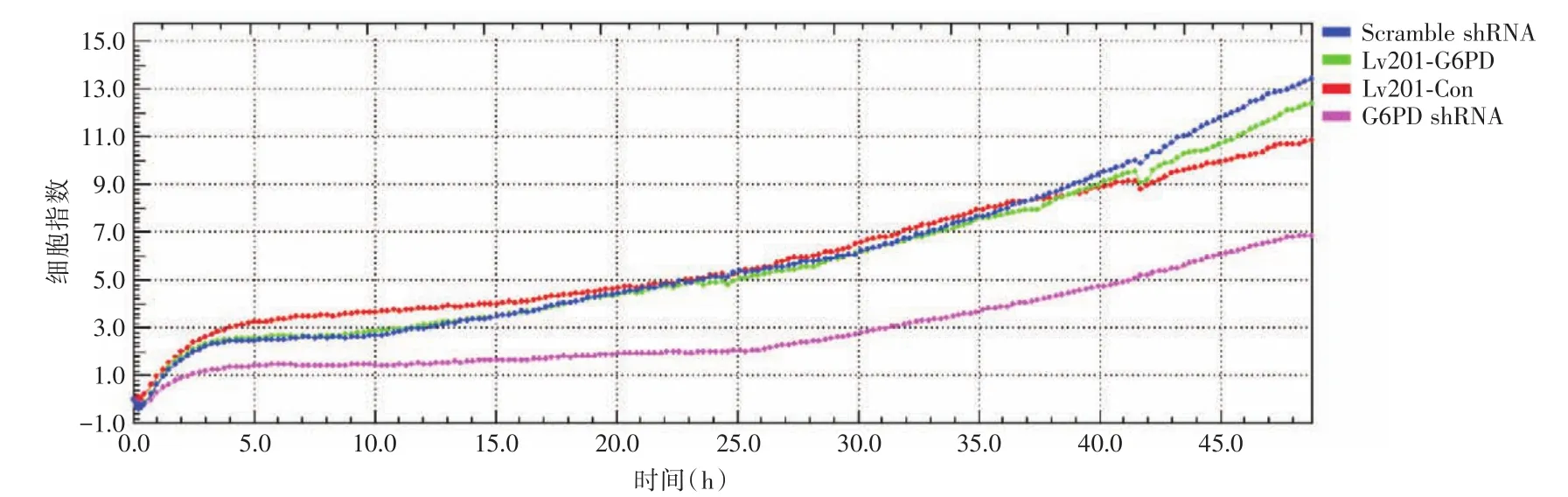
图3 G6PD敲低及过表达细胞迁移情况Fig.3 Migration curve analyses in G6PD knockdown and overexpression cells
本研究初步证实了G6PD在肝癌细胞株PLC/PRF/5中发挥着类似癌基因的作用,能够促进肝癌细胞的增殖、生长、迁移,为了探索肝癌细胞的代谢特征及PPP在肝癌细胞代谢中的地位,我们将对所建细胞株中糖消耗、乳酸含量、脂质等代谢物进行检测,研究G6PD及PPP对肿瘤代谢的全面影响;同时深入探讨G6PD发挥作用的机制,现已有研究表明p53可通过与G6PD的直接结合降低活性G6PD的含量而发挥抑癌作用[15],白血病细胞中SIRT2通过对G6PD的乙酰化修饰提高G6PD的活性而促进肿瘤生长[16],在肝癌细胞中PTEN可通过Tcl1/hnRNPK通路抑制G6PD前体mRNA的剪接发挥抗癌作用[17],可见多种信号通路影响着G6PD的表达、活性,为了寻找其他影响G6PD的上游基因以及受G6PD影响的下游基因,我们已将表型变化明显的G6PD敲低组与对照组样品进行全基因组芯片检测,以期挖掘与G6PD相关的功能基因,深入探索G6PD及PPP的改变在肝癌发生发展中所发挥的机制。
[1]WARBURG O.On the origin of cancer cells[J].Science,1956,123(3191):309⁃314.
[2]HANAHAN D,WEINBERG R A.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646⁃674.
[3]PATRA K C,HAY N.The pentose phosphate pathway and can⁃cer[J].Trends Biochem Sci,2014,39(8):347⁃354.
[4]WANG J,YUAN W,CHEN Z,et al.Overexpression of G6PD is associated with poor clinical outcome in gastric cancer[J].Tumour Biol,2012,33(1):95⁃101.
[5]HH T,ZHANG C,TANG Q,et al.Variant G6PD levels pro⁃mote tumor cell proliferation or apoptosis via the STAT3/5 path⁃way in the human melanoma xenograft mouse model[J].BMC Cancer,2013,13:251.
[6]WANG X,WU G,CAO G,et al.Zoledronic acid inhibits the pentose phosphate pathway through attenuating the Ras⁃TAp73⁃G6PD axis in bladder cancer cells[J].Mol Med Rep,2015,12(3):4620⁃4625.
[7]ZHANG Q,YI X,YANG Z,et al.Overexpression of G6PD Represents a Potential Prognostic Factor in Clear Cell Renal Cell Carcinoma[J].J Cancer,2017,8(4):665⁃673.
[8]WANG X,LI X,ZHANG X,et al.Glucose⁃6⁃phosphate dehy⁃drogenase expression is correlated with poor clinical prognosis in esophageal squamous cell carcinoma[J].Eur J Surg Oncol,2015,41(10):1293⁃1299.
[9]PU H,ZHANG Q,ZHAO C,et al.Overexpression of G6PD is associated with high risks of recurrent metastasis and poor pro⁃gression⁃free survival in primary breast carcinoma[J].World J Surg Oncol,2015,13:323.
[10]VIZAN P,SANCHEZ⁃TENA S,ALCARRAZ⁃VIZAN G,et al.Characterization of the metabolic changes underlying growth fac⁃tor angiogenic activation:identification of new potential thera⁃peutic targets[J].Carcinogenesis,2009,30(6):946⁃952.
[11]陈立曙,郑雪瑛,何娟,等.肝细胞性肝癌和糖代谢关系的病例对照研究[J].实用医学杂志,2012,28(17):2904⁃2906.
[12]陈纪涛,陈良才,贾小婷,等.低浓度二甲双胍对肝癌细胞线粒体形态结构及功能的影响[J].实用医学杂志,2016,32(6):875⁃878.
[13]LIU B,FANG M,HE Z,et al.Hepatitis B virus stimulates G6PD expression through HBx⁃mediated Nrf2 activation[J].Cell Death Dis,2015(6):e1980.
[14]HU H,DING X,YANG Y,et al.Changes in glucose⁃6⁃phos⁃phate dehydrogenase expression results in altered behavior of HBV⁃associated liver cancer cells[J].Am J Physiol Gastroin⁃test Liver Physiol,2014,307(6):G611⁃G622.
[15]JIANG P,DU W,WANG X,et al.p53 regulates biosynthesis through direct inactivation of glucose⁃6⁃phosphate dehydroge⁃nase[J].Nat Cell Biol,2011,13(3):310⁃316.
[16]XU S N,WANG T S,LI X,et al.SIRT2 activates G6PD to en⁃hance NADPH production and promote leukaemia cell prolifera⁃tion[J].Sci Rep,2016,6:32734.
[17]HONG X,SONG R,SONG H,et al.PTEN antagonises Tcl1/hnRNPK⁃mediated G6PD pre⁃mRNA splicing which contributes to hepatocarcinogenesis[J].Gut,2014,63(10):1635⁃1647.

