少精子症患者精子鱼精蛋白表达及染色质包装质量
洪丹,楼哲丰,郑九嘉,黄学锋,金龙金
(1.温州医科大学 检验医学院、生命科学学院,检验医学教育部重点实验室,浙江省医学遗传学重点实验室,浙江 温州 325035;2.温州医科大学附属第一医院 生殖医学中心,浙江 温州 325015)
全球有近15%的不孕不育夫妇,男性因素约占50%[1],其中男性不育患者中有14%~15%伴有精子数量或质量异常[2]。鱼精蛋白作为成熟精子中主要的核蛋白,包括鱼精蛋白1和鱼精蛋白2家族,分别由PRM1和PRM2编码[3],其转录、翻译及翻译后修饰均涉及复杂的调控机制[4-5],与精子形成、精子染色质结构异常、男性不育密切相关[6-7]。TBP相关因子2(TBP related factor 2,TRF2)是哺乳动物睾丸组织中特异性表达的调控因子,对精子形成过程中某些特异性基因的转录调控起关键作用[8]。本研究通过检测PRM1、PRM2、TRF2的表达以及精子染色质包装质量,探讨成熟精子中转录因子TRF2、鱼精蛋白和染色质包装质量与少精子症的相关性。
1 对象和方法
1.1 对象 28例少精子症患者、16例畸形精子症患者和15例正常对照者标本来自温州医科大学附属第一医院生殖中心。所有标本在采集前禁欲3~5 d,采集后在37 ℃、20~30 min完全液化,采用计算机辅助精液分析系统(CASA)分析和改良巴氏染色法,按WHO(第五版)标准进行诊断。此外,入选的所有标本经镜检验证无圆细胞及白细胞污染,同时均需符合:无生殖系统感染、无内分泌和免疫系统疾病、无隐睾和精索静脉曲张、抗精子抗体阴性。所有标本来源经本人知情同意并签署知情同意书。收集的标本分装后用于后续各项实验。
1.2 主要试剂 Trizol购自美国Invitrogen公司,反转录试剂盒和qPCR试剂盒购自日本Takara公司,色霉素A3(chromomycin A3,CMA3)染料购自美国Sigma公司,DEPC水购自上海生工生物工程股份有限公司,其他试剂均为国产分析纯。
1.3 方法
1.3.1 精子纯化:精液标本离心后弃上清,PBS吹打混匀,离心,弃上清;重复2~3次。
1.3.2 精子RNA提取:重悬纯化好的精子沉淀,加入Trizol,混匀后静置;加入氯仿混匀后静置再离心;吸取上层水相后加入等体积的异丙醇,混匀静置后离心;弃上清,用75%乙醇洗涤沉淀,混匀后离心,弃上清,重复1次;沉淀干燥至半透明,用DEPC水溶解;检测RNA浓度、纯度及完整性。
1.3.3 反转录反应:配置反应体系,37 ℃ 15 min、85 ℃ 5 s反应,产物作为后续实验的模板。
1.3.4 qPCR:通过Primer bank搜索或Primer Premier5.0软件设计目的基因引物,使用NCBI数据库进行blast比对后,交由华大基因公司合成。引物序列(5’→3’)如下:PRM1 F:CAGCCCACAGAGTTCCA CCT,R:GCACCTCATGGCTCTCCTC;PRM2 F:GCAAGAGC AAGGACACCAC,R:AGCCTCTGCGATGCCTCCT;TRF2 F:AACAACAAAGCAAGGAAGACGGAGT,R:AAGGAGAAGCTGGA GGACAAGGAT;GAPDH F:GCCAGTGGACTCCACGAC,R:CAACTACATGGTTTACATGTTC。配置反应体系,95 ℃预变性30 s,95 ℃变性5 s、60 ℃退火30 s、循环40次。
1.3.5 CMA3染色:配置CMA3染料,纯化的精子沉淀调成40×106/mL的精子悬液混匀后均匀地涂在洁净的载玻片上;干燥后固定液(甲醇∶冰乙酸=3∶1)中固定10 min;PBS反复冲洗,干燥后加50 μL CMA3染料均匀覆盖涂片,避光染色20 min;PBS反复冲洗,干燥后普通荧光显微镜观察。以发出明亮黄色荧光的精子为阳性,暗淡荧光或是无荧光的为阴性。每例标本至少计数200个精子,CMA3阳性率=阳性精子数/(阳性精子数+阴性精子数)×100%。
1.4 统计学处理方法 采用SPSS16.0统计软件进行分析。计量资料以±s表示,采用单因素方差分析,组间两两比较采用Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 标本资料 少精子症组平均年龄为(30.36±0.97)岁,畸形精子症组为(32.50±1.28)岁,正常对照组为(30.00±1.07)岁。各组精液参数见表1。
表1 少精子症组、畸形精子症组和正常对照组精液参数(±s)
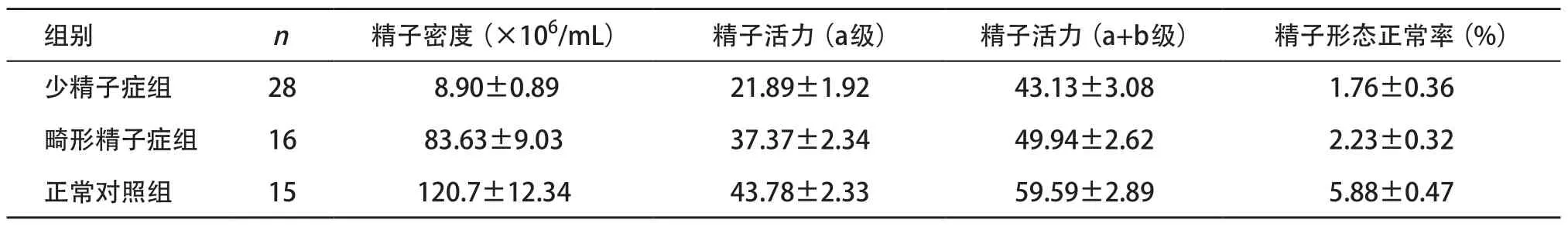
表1 少精子症组、畸形精子症组和正常对照组精液参数(±s)
2.2 qPCR结果 以GAPDH为内参基因,用2-ΔΔCq法分别计算3组PRM1、PRM2和TRF2 mRNA相对表达水平,结果显示,少精子症组PRM1和PRM2 mRNA相对表达量分别为正常对照组的25%(P<0.05)和20%(P<0.05);畸形精子症组PRM1和PRM2 mRNA相对表达量分别为正常对照组的66%和69%,差异无统计学意义(P>0.05),见图1A-B。与正常对照组相比,少精子症组和畸形精子症组TRF2 mRNA相对表达量分别为正常对照组的128%和119%,差异均无统计学意义(P>0.05),见图1C。
2.3 CMA3染色结果与阳性率计算 CMA3染色结果显示少精子症组CMA3阳性率为(20.47±1.19)%,畸形精子症组为(14.31±2.01)%,正常对照组为(10.69±1.45)%;少精子症组阳性率是正常对照组的191%(P<0.001);畸形精子症组阳性率是正常对照组的134%(P>0.05)。见图2。

图1 3组PRM1、PRM2和TRF2 mRNA相对表达量比较
3 讨论
超过一半的男性不育患者病因尚不明确,先天或后天因素都能导致不育的发生。辅助生殖技术尤其是胞浆内单精子注射技术,已能帮助部分由男性因素引起不育的夫妇获得子代[9-10]。然而该技术可能逃避受精过程中对潜在具有遗传缺陷的异常精子的自然选择机制,没有对潜在的遗传缺陷进行全面的筛查,因此有必要深入研究精子功能。
精子质量低下是造成精子功能异常和男性不育的重要原因。研究表明,前来就诊的男性不育患者中约有30%为不明原因的少精子症或无精子症[11],由于本研究收集的精液标本中少精子症常伴随畸形精子症,因此本研究分别检测少精子症组、畸形精子症组和正常对照组中鱼精蛋白表达情况并初步探讨其中可能的发生机制。
精子发生包括精原细胞的有丝分裂、精母细胞的减数分裂和精子形成。精子形成的特征性事件之一是核蛋白组型转换,与核DNA结合的组蛋白被过渡蛋白取代,最终被睾丸特异性的鱼精蛋白取代,这一过程能够使细胞核浓缩形成精子特殊的染色质结构,从而保证遗传信息的传递[12]。研究表明,鱼精蛋白2表达水平降低导致的雄性小鼠不育与PRM1和PRM2突变有关,二者任一等位基因突变都会导致单倍型的缺乏[13]。本研究针对鱼精蛋白(PRM1和PRM2)转录水平的研究发现,少精子症组中PRM1和PRM2 mRNA相对表达量分别为正常对照组的25%与20%,表达显著降低;而畸形精子症组则无统计学差异。提示PRM1和PRM2 mRNA表达量减少可能是成熟精子数量减少而非成熟精子形态异常的原因。
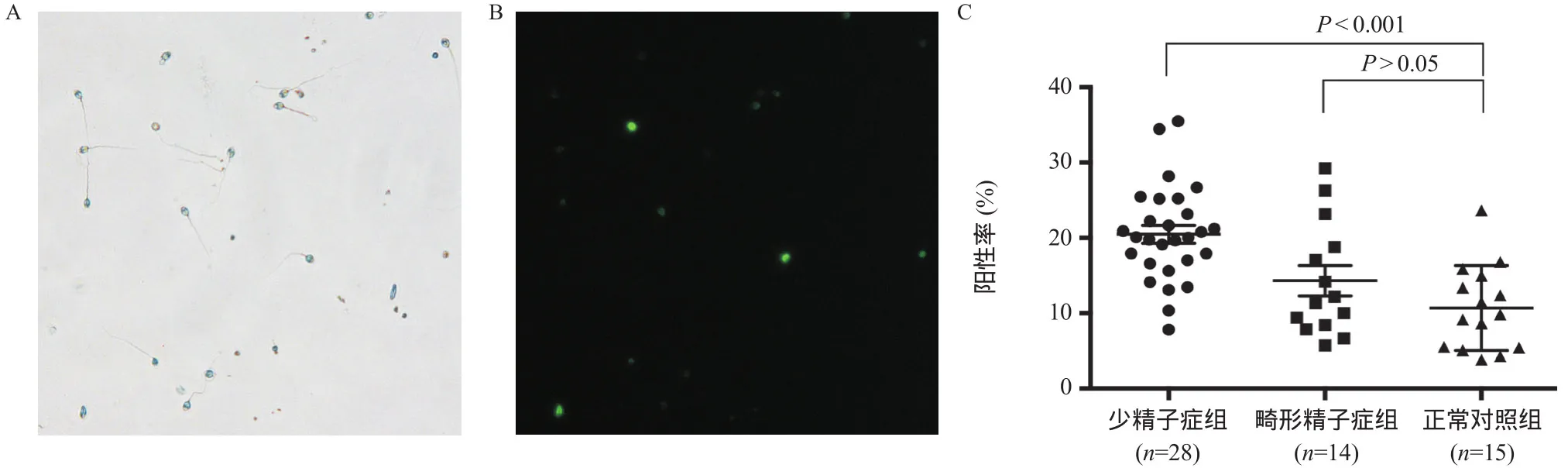
图2 CMA3染色结果及阳性率比较(×400)
那么鱼精蛋白表达异常是如何影响下游水平,又是如何受到上游调控,从而使得成熟精子数量减少?一方面,鱼精蛋白对于精子核结构的稳定和核染色质的浓集具有重要作用[14]。本研究通过CMA3染色检测精子染色质包装质量,评估精子内鱼精蛋白的表达水平[15],发现少精子症组中CMA3阳性率显著高于正常对照组,畸形精子症组与正常对照组之间则无统计学差异,说明染色质包装异常可能是成熟精子数量减少而非成熟精子形态异常的原因。鱼精蛋白是染色质结构成分之一,其表达减少使得核蛋白与DNA亲和力降低,从而影响DNA-鱼精蛋白复合体的形成;更有研究表明,PRM2敲除小鼠精子细胞染色质浓缩不全、DNA损伤加剧,即使通过胞浆内单精子注射技术都无法生育[16]。结合本研究结果提示,鱼精蛋白表达减少可能是通过影响精子染色质包装结构,使得精子形成过程异常,而这可能是成熟精子数量减少的原因。另一方面,精子形成中(除基本转录因子之外)许多睾丸特异性的转录因子和一些基本转录因子的特异转录本形式,或通过调节PRMs转录活性,或在转录后修饰等方面发挥重要作用[17-18]。睾丸特异性调控因子TRF2能够结合转录因子 IIA和TF IIB形成大分子蛋白复合体,抑制RNA聚合酶 II的转录[19]。我们的结果显示,少精子症组与正常对照组、畸形精子症组与正常对照组的TRF2 mRNA表达水平均无统计学差异。MARTIANOV等[20]对基因敲除小鼠的研究显示,单倍体精子中TRF2 mRNA表达有2个高峰期:圆形精子细胞和延长形精子细胞。本研究检测到成熟精子中TRF2 mRNA表达量明显低于PRM1和PRM2 mRNA的含量,提示在成熟精子中对TRF2的检测可能没有实际意义。
综上所述,鱼精蛋白(PRM1和PRM2)mRNA表达量减少,可能影响精子染色质包装,使得精子形成过程异常,这可能是成熟精子数量减少的原因。成熟精子中TRF2 mRNA表达量较低,可能与其仅在精子形成过程早期表达有关,可通过检测生精细胞中TRF2以及其他阶段特异性表达基因[21]表达,研究其与少精子症、鱼精蛋白的相关性,从而进一步探讨调控鱼精蛋白表达的相关机制。
参考文献:
[1] HIRSH A. Male subfertility[J]. BMJ, 2003, 327(7416): 669-672.
[2] DADA R, GUPTA NP, KUCHERIA K. Molecular screening for Yq microdeletion in men with idiopathic oligozoospermia and azoospermia[J]. J Biosci, 2003, 28(2): 163-168.
[3] BALHORN R. The protamine family of sperm nuclear proteins[J]. Genome Biol, 2007, 8(9): 227.
[4] BRUNNER A M, NANNI P, MANSUY I M. Epigenetic marking of sperm by post-translational modification of histones and protamines[J]. Epigenetics Chromatin, 2014, 7(1):2.
[5] BAO J, BEDFORD M T. Epigenetic regulation of the histone-to-protamine transition during spermiogenesis[J]. Reproduction, 2016, 151(5): R55-70.
[6] AOKI V W, LIU L, CARRELL D T. Identification and evaluation of a novel sperm protamine abnormality in a population of infertile males[J]. Hum Reprod, 2005, 20(5): 1298-1306.
[7] AOKI V W, CHRISTENSEN G L, ATKINS J F, et al. Identification of novel polymorphisms in the nuclear protein genes and their relationship with human sperm protamine deficiency and severe male infertility[J]. Fertil Steril, 2006, 86(5):1416-1422.
[8] ZHANG D, PENTTILA T L, MORRIS P L, et al. Spermiogenesis deficiency in mice lacking the Trf2 gene[J]. Science,2001, 292(5519): 1153-1155.
[9] BACH P V, SCHLEGEL P N. Sperm DNA damage and its role in IVF and ICSI[J]. Basic Clin Androl, 2016, 26: 15.
[10] MAŁGORZATA K, DEPA-MARTYNÓW M, BUTOWSKA W, et al. Human spermatozoa ultrastructure assessment in the infertility treatment by assisted reproduction technique[J]. Arch Androl, 2007, 53(6): 297-302.
[11] DOHLE G R, HALLEY D J, VAN HEMEL J O, et al. Genetic risk factors in infertile men with severe oligozoospermia and azoospermia[J]. Hum Reprod, 2002, 17(1): 13-16.
[12] OLIVA R. Protamines and male infertility[J]. Hum Reprod Update, 2006, 12(4):417-435.
[13] CHO C, WILLIS W D, GOULDING E H, et al. Haploinsufficiency of protamine-1 or -2 causes infertility in mice[J].Nat Genet, 2001, 28(1): 82-86.
[14] GILL-SHARMA M K, CHOUDHURI J, D’SOUZA S.Sperm chromatin protamination: an endocrine perspective[J].Protein Pept Lett, 2011, 18(8): 786-801.
[15] 谷龙杰, 陈振文, 许剑锋. 不育男性精子染色质结构与精液常规参数的关系[J]. 中国男科学杂志, 2009, 23(3): 29-32.
[16] CHO C, JUNG-HA H, WILLIS W D, et al. Protamine 2 deficiency leads to sperm DNA damage and embryo death in mice[J]. Biol Reprod, 2003, 69(1): 211-217.
[17] OKADA Y, SCOTT G, RAY M K, et al. Histone demethylase JHDM2A is critical for Tnp1 and Prm1 transcription and spermatogenesis[J]. Nature, 2007, 450(7166): 119-123.
[18] OKADA Y, TATEISHI K, ZHANG Y. Histone demethylase JHDM2A is involved in male infertility and obesity[J]. J Androl, 2010, 31(1): 75-78.
[19] SUGIURA S, KASHIWABARA S, IWASE S, et al. Expression of a testis-specific form of TBP-related factor 2 (TRF2)mRNA during mouse spermatogenesis[J]. J Reprod Dev,2003, 49(1): 107-111.
[20] MARTIANOV I, BRANCORSINI S, GANSMULLER A,et al. Distinct functions of TBP and TLF/TRF2 during spermatogenesis: requirement of TLF for heterochromatic chromocenter formation in haploid round spermatids[J]. Development, 2002, 129(4): 945-955.
[21] 张亚亚, 覃琼玉, 林冲, 等. 亚慢性苯吸入暴露抑制小鼠单倍体精子核蛋白基因的表达[J]. 温州医科大学学报, 2016,46(4): 249-253.

