雌激素对人乳头状瘤病毒16型E6基因转染人永生化表皮细胞效率的影响
卢晓声,陈菁,赵军招,吕杰强
(1.温州医科大学附属第二医院 生殖中心,浙江 温州 325027;2.温州医科大学 第二临床医学院,浙江 温州 325035)
人乳头状瘤病毒(human papilloma virus,HPV)是一种嗜上皮病毒,可导致人类皮肤和黏膜病变[1]。尽管HPV型别众多,但流行病学研究表明HPV 16感染为全球宫颈癌致病主要型别[2]。HPV早期癌蛋白E6在宫颈上皮细胞癌变过程中起着重要作用。有研究认为宫颈癌是一种激素依赖性的疾病,雌激素在HPV致癌的过程中有协同作用[3]。但是,雌激素水平的升高是否与HPV感染有关目前尚存在争议。本研究采用不同浓度的雌二醇(17-β-E2,E2)作用于单层培养的人类永生化表皮细胞系HaCat,向细胞内转染HPV 16型的主要致癌基因E6,模拟HPV感染人类上皮细胞的生物过程,探讨雌激素对宿主细胞感染HPV的影响。
1 材料和方法
1.1 细胞与质粒 HaCaT细胞系购于中国典型培养物保藏中心(武汉大学细胞库),以10% FBS+1%青霉素/链霉素双抗+高糖型DMEM培养基(美国Gibco公司),于37 ℃,5% CO2,饱和湿度条件下常规培养,隔天换液,7 d 1∶3传代;含HPV l6 E6的真核表达质粒由本实验室保存。
1.2 主要试剂与仪器 E2购于美国Sigma公司;D6922-01质粒提取试剂盒购于美国OMEGA生物技术公司;Lipofectione 2000转染试剂盒购于美国Invitrogen公司;实时荧光定量PCR试剂盒购于美国MBI Fermentas公司;APO-BRDU™试剂盒购于美国eBioscience公司。
1.3 方法
1.3.1 细胞生长曲线绘制(细胞计数法):取对数生长期的HaCat细胞制备细胞悬液,调整细胞浓度为10000个/孔接种于24孔板。细胞贴壁后,分别采用含有10-5,10-6,10-7,10-8,10-9,0 mol/L的E2培养液培养,每48 h换液1次。每24 h取不同浓度的细胞制备细胞悬液。使用血细胞计数板进行细胞计数(3次/孔并取均值),共计数7 d。
1.3.2 细胞活性测定(MTT法):制备细胞悬液,以2000个细胞/孔的密度接种于96孔板中。细胞贴壁后分7组,分别加入含10-5,10-6,10-7,10-8,10-9,0 mol/L(对照组)的E2的培养基以及PBS液(Control)200 μL。在培养24 h、48 h、72 h三个节点,采用MTT试剂盒说明书操作,在酶联免疫检测仪上选择波长490 nm检测吸光度(A)。
1.3.3 细胞周期分布检测:取生长对数期HaCaT细胞制备悬液,以2×105个细胞/孔布6孔板,细胞贴壁后用含10-5,10-6,10-7,10-8,10-9, 0 mol/L的E2的培养基以及PBS 3 mL培养72 h。再加入终浓度0.01 mmol的5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine,BrdU),按照BrdU试剂盒步骤操作并上流式细胞仪检测。
1.3.4 细胞周期时相检测:制备细胞悬液,向培养液中加入BrdU,使最终浓度为10 μg/mL。44 h加秋水仙素,使终浓度为0.1 μg/mL。48 h后消化细胞染色体制片。镜检100个分裂相,计第1、2、3、4细胞期分裂指数。细胞周期(Tc)=48/[(M1+2M2+3M3+4M4)/100](h)。
1.3.5 细胞转染:使用大肠杆菌DH5α感受态细胞将含HPV 16 E6的质粒扩增,按质粒提取试剂盒抽提质粒,以紫外分光光度计测定DNA浓度。将HaCat细胞以5×105个/皿接种,贴壁后以含有10-5,10-6,10-7,10-8,10-9,0 mol/L的E2培养基培养。在细胞生长丰度达到80%时开始按照转染试剂盒说明转染。
1.3.6 Real-time PCR:质粒转染36 h后收集细胞,采用RNA提取试剂盒提取RNA,按照Real-time PCR试剂盒说明书操作并上机测定RNA。HPV 16 E6引物序列(由大连TAKARA有限公司合成)如下:上游:5’-GCGACCCAGAAAGTTACCACA-3’,下游:5’-GCATAAA TCCCGAAAAGCAAAG-3’。
1.4 统计学处理方法 采用SPSS13.0软件对数据进行分析。正态分布计量资料用±s表示,各组间比较用单因素方差分析,组间两两比较用q检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度E2作用下HaCat细胞生长情况 在无E2作用时,HaCat细胞的倍增时间约为24 h。而经过10-7~10-5mol/L的E2作用细胞倍增时间明显缩短,差异有统计学意义(P<0.05)。与对照组相比,低浓度(10-9~10-8mol/L)E2对HaCat细胞增长的作用差异无统计学意义(P>0.05)。见图1。
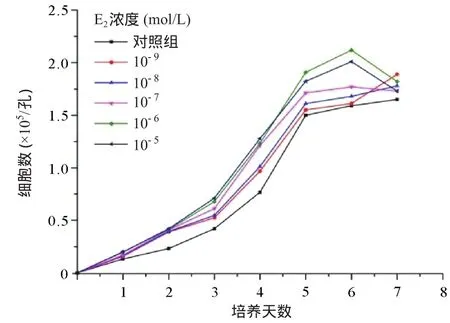
图1 不同浓度E2作用下HaCat细胞的生长曲线
2.2 不同浓度E2作用下HaCat细胞活性情况 当E2浓度在10-7~10-5mol/L范围时,HaCat细胞活性与对照组相比,差异有统计学意义(P<0.05)。当浓度为10-9~10-8mol/L时,细胞活性与对照组比,差异无统计学意义(P>0.05)。见图2。

图2 不同浓度E2作用下不同时间点HaCat细胞的细胞活性测定
2.3 不同浓度E2作用下HaCat细胞周期分布 各组细胞均以G1期的细胞为主,S期次之,G2期最少,提示E2不改变HaCat细胞的周期时项的比例。见图3。
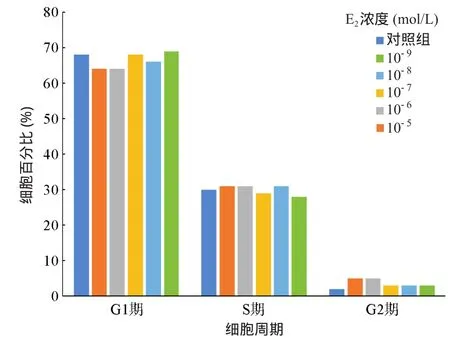
图3 不同浓度E2作用下HaCat细胞周期分布的变化
2.4 不同浓度E2作用下HaCat细胞时相变化 对照组HaCat细胞的平均细胞周期是(18.21±1.09)h。在E2浓度为10-7~10-5mol/L的范围内细胞周期比对照组短,差异有统计学意义(P<0.05)。见图4。
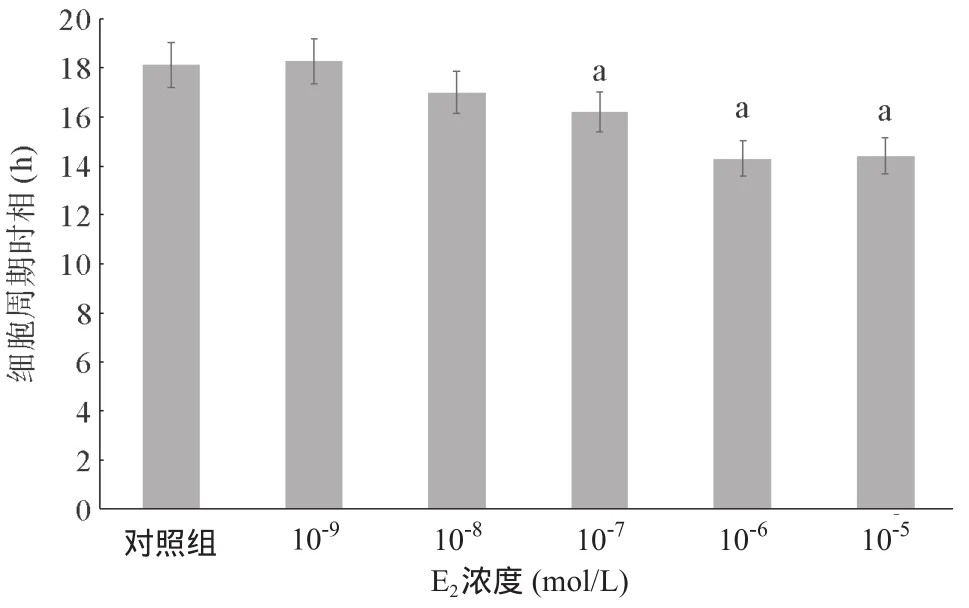
图4 不同浓度E2作用下HaCat细胞周期时相的变化
2.5 不同浓度E2作用下HaCat细胞转染HPV 16 E6的mRNA表达情况 与对照组比,在10-7~10-5mol/L的E2作用下,转染HPV 16 E6基因后的HaCat细胞内E6 mRNA表达增高(P<0.05)。见图5。

图5 不同浓度E2作用下HaCat细胞转染HPV 16 E6的mRNA表达
3 讨论
临床上HPV感染受到性伴侣、性观念、生育、性传播疾病、吸烟等多种因素影响,使流行病学调查对外源性雌激素的接触很难进行独立的分析,因此许多调查会得出不同的结论。
有研究认为口服避孕药是HPV感染的危险因素[4-5];一项追踪了9年的队列研究显示:服用避孕药超过15年的女性,罹患宫颈癌及癌前病变的相对危险度分别达到1.8和1.6[6]。然而也有大样本病例对照研究表明口服避孕药与HPV感染无明显关系。2006年的一项队列研究认为,口服避孕药的长期使用(10年)并不增加HPV感染的风险,但可能使HPV持续性感染的细胞向恶性转化[7]。另一项队列研究也指出:长期口服性激素没有增加HPV相关的恶性肿瘤风险[8],采用口服避孕药和使用宫内节育器进行避孕的2组女性之间的HPV感染率也并无统计学差异[9]。
较多组织学、病理学上的研究则支持性激素与HPV感染有关。既往文献通过检测正常宫颈上皮、非典型增生及宫颈癌组织中雌激素受体(estrogen receptor,ER)及HPV的表达情况,发现ER阳性患者更易发生HPV感染[10]。也有研究显示雌、孕激素可增强HPV 16癌基因E6和E7的转录活性[11]。最有力的证据来自于HPV 16 E6/E7转基因小鼠,它们在胚胎时期就开始表达HPV 16 E6/E7基因,但很少自发宫颈癌。在使用E2干预6周后,这些小鼠均出现了宫颈癌[12]。
本研究将单层体外培养的细胞加以E2的刺激,观察其对HPV 16 E6基因转染影响,发现一定浓度的外源性雌激素可使宿主细胞的生长加速,活性增加,转染后HPV 16 E6的表达也相应增加。表明雌激素水平的升高可能会增加HPV感染的风险。
HPV E6蛋白会与抑癌基因p53结合,使之降解,导致细胞周期的调控失常而诱使恶性肿瘤的发生[13]。细胞周期蛋白Cyclin D1是细胞周期G1/S期的关键调控因子[14]。雌激素可上调Cyclin D1的表达,促进细胞增殖[15]。本研究中,雌激素促进HaCat细胞的增殖,使其细胞周期缩短,与雌激素对细胞周期的正性调控因子的促进作用相符。但雌激素并没有改变该细胞细胞周期的时相,其作用机制仍有待于进一步研究。
HPV只能感染复层上皮的基底层细胞,而无法感染分化终末期的细胞,提示HPV感染与宿主细胞的细胞周期有关[16]。PYEON等[17]的研究发现:宿主细胞必须进入M期才能启动HPV衣壳基因的转录。本研究中,将HaCat细胞暴露在一定浓度范围内的E2中,HaCat细胞的数目和活性增加,证明E2具有促进靶细胞增殖的能力。当细胞周期的进程缩短,数目增加,进入M期的细胞数目增多,活性增强,则受到HPV感染的几率也就越大。因此E2作用后HaCat细胞转染HPV 16 E6的效率会随着E2浓度的升高而增加。
雌激素还可通过调整多种炎症因子和抗原递呈复合物的表达,促使G1期的细胞生长,促进病灶的增殖[18]。雌激素对HPV 16 E6整合进入宿主DNA的过程是否也存在着对炎症因子的调节有待进一步探索。
参考文献:
[1] GOODMAN A. HPV testing as a screen for cervical cancer[J]. BMJ, 2015, 350: h2372.
[2] 侯柏龙, 杜王琪, 熊一融, 等. 人宫颈癌SiHa细胞荷瘤裸鼠模型的建立及鉴定[J]. 温州医科大学学报, 2016, 46(2): 92-96.
[3] RINALDI S. PLUMMER M, BIESSY C, et al. Endogenous sex steroids and risk of cervical carcinoma: results from the EPIC study[J]. Cancer Epidemiol Biomarkers Prev, 2011, 20(12): 2532-2540.
[4] LUHN P, WALKER J, SCHIFFMAN M, et al. The role of co-factors in the progression from human papillomavirus infection to cervical cancer[J]. Gynecol Oncol, 2013, 128(2):265-270.
[5] SALAZAR E L, GONZALEZ J L, OLMOS A, et al. Influence of the use of oral contraceptives as risk factors for human papillomavirus infection and cervical intraepithelial neoplasia[J]. Ginecol Obstet Mex, 2005, 73(2): 83-89.
[6] ROURA E, TRAVIER N, WATERBOER T, et al. The influence of hormonal factors on the risk of developing cervical cancer and pre-cancer: results from the EPIC cohort[J].PLoS One, 2016, 11(1): e0147029.
[7] VACCARELLA S, HERRERO R, DAI M, et al. Reproductive factors, oral contraceptive use, and human papillomavirus infection: pooled analysis of the IARC HPV prevalence surveys[J]. Cancer Epidemiol Biomarkers Prev, 2006,15(11): 2148-2153.
[8] LONGATTO-FILHO A, HAMMES L S, SARIAN L O, et al.Hormonal contraceptives and the length of their use are not independent risk factors for high-risk HPV infections or high-grade CIN[J]. Gynecol Obstet Invest, 2011, 71(2): 93-103.
[9] GAVRIC-LOVREC V, TAKAC I. Use of various contraceptives and human papillomavirus 16 and 18 infections in women with cervical intraepithelial neoplasia[J]. Int J STD AIDS, 2010, 21(6): 424-427.
[10] SON J, PARK J W, LAMBERT P F, et al. Requirement of estrogen receptor alpha DNA-binding domain for HPV oncogene-induced cervical carcinogenesis in mice[J]. Carcinogenesis, 2013, 35(2): 489-496.
[11] GARCIA C, HERNANDEZ-GARCIA D, VALENCIA C,et al. E6/E7 oncogenes in epithelial suprabasal layers and estradiol promote cervical growth and ear regeneration[J]. Oncogenesis, 2017, 6(8): e374.
[12] CHUNG S H, SHIN M K, KORACH K S, et al. Requirement for stromal estrogen receptor alpha in cervical neoplasia[J]. Horm Cancer, 2013, 4(1): 50-59.
[13] MARTINEZ-ZAPIEN D, RUIZ F X, POIRSON J, et al.Structure of the E6/E6AP/p53 complex required for HPV-mediated degradation of p53[J]. Nature, 2016, 529(7587):541-545.
[14] INOUE K, FRY E A. Aberrant expression of Cyclin D1 in cancer[J]. Sign Transduct Insights, 2015, 4: 1-13.
[15] AHLIN C, LUNDGREN C, EMBRETSEN-VARRO E, et al. High expression of cyclin D1 is associated to high proliferation rate and increased risk of mortality in women with ER-positive but not in ER-negative breast cancers[J]. Breast Cancer Res Treat, 2017, 164(3): 667-678.
[16] GRIFFIN L M, CICCHINI L, XU T, et al. Human keratinocyte cultures in the investigation of early steps of human papillomavirus infection[J]. Methods Mol Biol, 2014, 1195:219-238.
[17] PYEON D, PEARCE S M, LANK S M, et al. Establishment of human papillomavirus infection requires cell cycle progression[J]. PLoS Pathog, 2009, 5(2): e1000318.
[18] MORA-GARCIA M L, ÁVILA-IBARRA L R, GARCIAROCHA R, et al. Cervical cancer cells suppress effector functions of cytotoxic T cells through the adenosinergic pathway[J]. Cell Immunol, 2017, 320: 46-55.

