长链非编码RNA FENDRR在子宫颈癌中的作用
兰霄霄,周志阳,徐欣欣,吴雪清
(温州医科大学附属第一医院 妇产科,浙江 温州 325015)
宫颈癌是女性生殖系统最常见的恶性肿瘤,虽然近年来宫颈癌疫苗和早期筛查的开展使得宫颈癌的发病率有所下降,但是宫颈癌仍然在女性癌症相关性死亡中占据一定的比例[1]。FENDRR(FOXF1 adjacent non-coding developmental regulatory RNA)是位于第13号染色体的一段长链非编码RNA(long non-coding RNA,lcnRNA),能与多梳蛋白复合物2(polycomb repressive complex 2,PRC2)或TrxG/MLL复合物结合[2],对小鼠心脏和体壁的正常发育具有重要作用[3]。已有研究表明FENDRR能通过影响纤连蛋白1的表达进而调控胃癌细胞的转移[4],但目前尚未见关于其在宫颈癌中的研究。本研究通过在宫颈癌细胞中应用小干扰RNA(small interfering RNA,siRNA)介导的基因干扰技术特异性干扰FENDRR的表达,结合实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)、细胞增殖CCK-8、Transwell以及裸鼠成瘤实验,探讨FENDRR在宫颈癌发病中的作用。
1 材料和方法
1.1 材料 宫颈癌细胞株(SiHa和HeLa,美国ATCC细胞库),Advanced MEM培养基(美国Gibco公司),胎牛血清(FBS,美国Gibco公司),siRNA(上海吉玛生物公司),转染试剂(美国SignaGen公司),CCK-8试剂盒(日本Dojindo公司),Transwell小室、Matrigel基质胶(美国Corning公司),Trizol(美国Invitrogen公司),氯仿和异丙醇(美国Sigma公司),PCR引物(北京擎科生物技术公司)(见表1),反转录试剂盒(PrimeScript™ RT reagent Kit)、qRTPCR试剂盒(SYBR®Premix Ex Taq™,日本Takara公司),裸鼠(上海斯莱克实验动物有限责任公司),实验动物使用许可证号:SYXK(浙)2015-0009。

表1 qRT-PCR引物的基因序列
1.2 方法
1.2.1 细胞培养:宫颈癌细胞株用含10% FBS、100 ng/mL链霉素、100 U/mL青霉素以及2 μmol/mL谷氨酸钠的Advanced MEM细胞培养基于5% CO2、37 ℃条件下培养,细胞生长至80%~90%融合度时进行传代。
1.2.2 siRNA转染实验:转染前1 d接种适当数量的细胞至6孔板,使转染时细胞融合度接近50%。转染特异性干扰FENDRR的siRNA为实验组,转染空白对照siRNA为对照组。具体转染步骤如下:①转染前30 min在上述铺好细胞的6孔板中换上1 mL新鲜细胞培养基;②用100 μL稀释好的1×转染缓冲液溶解5 μL siRNA,混匀后再加入4 μL转染试剂,充分混匀后室温孵育15 min;③将配好的含有siRNA的试剂加入6孔板的相应孔中,轻轻混匀;④培养6 h后更换新鲜培养基,继续将6孔板置于5% CO2、37 ℃培养箱中培养;⑤转染24~48 h后进行siRNA干扰沉默效果及细胞功能检测。
1.2.3 qRT-PCR:①提取细胞总RNA:运用Trizol一步法提取细胞总RNA。测定RNA浓度及OD260/OD280在1.8~2.0之间,符合要求。RNA保存于-80 ℃冰箱用于后续实验。②反转录:每组各取1000 ng总RNA按照反转录试剂盒说明书进行操作,反转录成的cDNA置于-20 ℃冰箱保存。③qRT-PCR:利用qRT-PCR试剂盒对反转录的cDNA进行PCR扩增,具体扩增体系为:SYBR®Premix Ex Taq II(2×)5 μL,ddH2O 3.4 μL,上下游引物混合液0.4 μL,ROX Reference Dye II 0.2 μL,cDNA 1 μL。
1.2.4 CCK-8实验:96孔板每孔种植SiHa细胞2000个,HeLa细胞2500个,分别于细胞贴壁后的0、24、48、72、96 h向每孔加入10 μL CCK-8试剂,37 ℃孵育3 h后用酶标仪检测每孔450 nm波长的吸收值。
1.2.5 Transwell实验:①细胞迁移实验:Transwell小室的下室中加入500 μL含10% FBS的完全细胞培养基,上室接种300 μL不含FBS的细胞悬液(内含细胞25000个),37 ℃培养24 h后取出小室,弃上室残存培养基,待自然凉干后用甲醇固定10 min,0.1%结晶紫染色10 min,用棉签擦去小室内表面残留的细胞及染料,显微镜观察穿过小室滤膜的细胞并计数(10倍镜下随机选择5个视野);②细胞侵袭实验:将存于-20 ℃的Matrigel置于4 ℃解冻,用预冷的无FBS培养基按1∶30稀释Matrigel,在小室的上室中均匀铺上100 μL稀释好的Matrigel,37 ℃放置约2 h使其凝结成胶体。后续实验步骤同细胞迁移实验。以上实验分别至少重复3次。
1.2.6 裸鼠成瘤实验:2~3周的雌性裸鼠,每组5只。收集指数增长期的细胞用无FBS的培养基和Matrigel按1∶1的比例制备细胞悬液,在每只裸鼠的腋下皮下种植含2.5×106个HeLa细胞的细胞悬液100 μL(左侧种植对照组细胞,右侧种植实验组细胞)。种植细胞1周后,每3 d检测1次肿瘤的大小和裸鼠的体质量,4周后取出肿瘤,测量肿瘤质量并拍照记录。
1.3 统计学处理方法 应用GraphPad Prism 5和SPSS12.0软件进行统计学分析。计量资料采用±s表示,组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 转染siRNA后FENDRR的表达 qRT-PCR结果显示,转染了特异性靶向FENDRR的siRNA后,宫颈癌细胞中FENDRR的表达水平明显下降,在SiHa细胞中FENDRR相对表达水平由(1.013±0.120)降为(0.226±0.024),在HeLa细胞中FENDRR相对表达水平由(1.001±0.025)降为(0.099±0.010),差异均有统计学意义(P<0.01)。
2.2 FENDRR抑制宫颈癌细胞体外增殖 CCK-8实验显示,干扰FENDRR的表达后,宫颈癌细胞株SiHa和HeLa的增殖能力明显增强,SiHa细胞在48、72和96 h实验组和对照组的OD分别为: (0.932±0.014)、(1.603±0.012)、 (2.282±0.024)和(0.780±0.005)、 (1.150±0.011)、 (1.693±0.019),差异有统计学意义(P<0.01),见图1A。HeLa细胞在72和96 h实验组和对照组的OD分别为: (1.175±0.017)、(1.983±0.021)和(0.889±0.014)、 (1.483±0.017),差异均有统计学意义(P<0.01),见图1B。
2.3 FENDRR抑制宫颈癌细胞体外运动能力 为了验证FENDRR对宫颈癌细胞体外迁移以及侵袭能力的影响,应用Transwell小室实验检测各组细胞的迁移和侵袭能力。用Leica荧光正置显微镜进行拍照,结果显示,干扰FENDRR后,宫颈癌细胞系的迁移和侵袭能力明显增强(见图2A-B)。SiHa迁移细胞数从(95.2±2.9)增至(212.4±7.4),HeLa迁移细胞数从(130.2±6.2)增至(433.8±13.1),差异均有统计学意义(P<0.01)。SiHa侵袭细胞数从(39.6±1.9)增至(97.2±7.2),HeLa侵袭细胞数从(109.2±4.6)增至(252.4±18.2),差异均有统计学意义(P<0.01)。
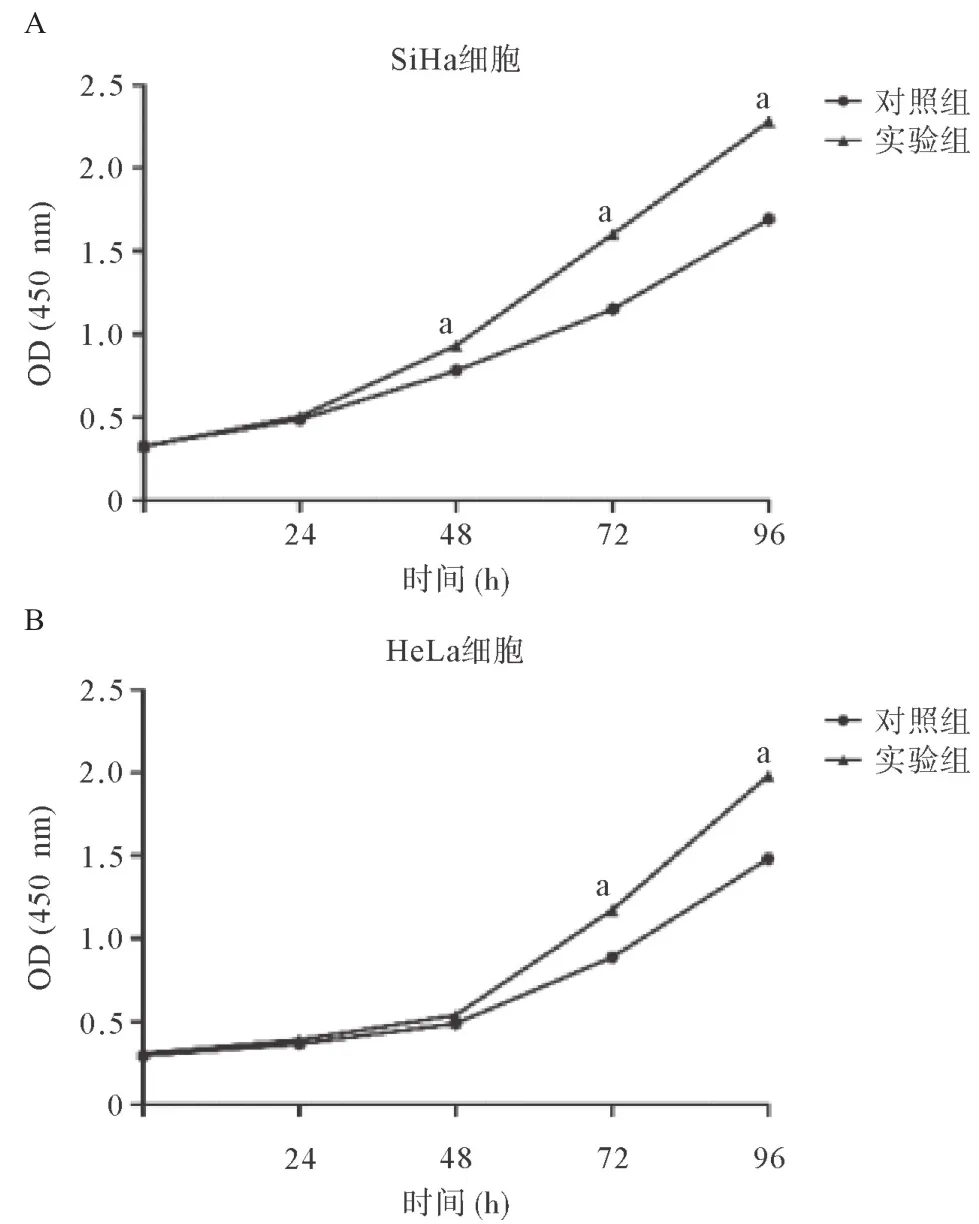
图1 FENDRR抑制宫颈癌细胞SiHa(A)和HeLa(B)体外增殖

图2 FENDRR抑制宫颈癌细胞迁移能力(A)和侵袭能力(B)(×10)
2.4 FENDRR抑制宫颈癌细胞体内增殖 为了进一步验证FENDRR在宫颈癌中的作用,采用HeLa细胞进行了裸鼠体内成瘤实验。连续监测肿瘤大小和裸鼠体质量,根据体积计算公式(体积=1/2长×宽2),发现干扰FENDRR后HeLa细胞的成瘤能力增强,肿瘤体积与对照组比从(853.2±59.4)mm3增加到(1155.0±51.5)mm3,差异有统计学意义(P<0.01),见图3A。肿瘤质量从(0.544±0.053)g增加到(0.814±0.061)g,差异有统计学意义(P<0.05),见图3B。

图3 FENDRR抑制宫颈癌细胞体内增殖
3 讨论
随着基因芯片和高通量测序等生物信息学技术的发展,我们逐渐认识到在人类全基因组以及转录组中蛋白编码基因仅占了不到2%,超过75%的基因不具备蛋白编码功能,但后者在各种生物学过程中同样发挥着重要的作用[5]。LncRNA是长度大于200个核苷酸并且不具备蛋白编码功能的RNA,占据非编码RNA的主要部分。近几年,越来越多的研究发现lncRNA参与许多生物学进程[6-7]。在癌症中,lncRNA的表达具有一定的组织或者肿瘤特异性,并且能与其他生物分子发生相互作用影响细胞周期调节、细胞生存、免疫反应以及细胞干性等过程,进而影响癌症细胞的表型转化[8]。部分lncRNA也受一些关键抑癌基因或者促癌基因的转录调节[9-10]。随着研究的进一步深入,我们发现lncRNA能作为一种信号分子反映特异性细胞状态以及作为区分癌症等细胞病理状态的标志物[11],为癌症提供一定的预后价值,甚至还可以作为一种新的治疗选择。BUSSEMAKERS等[12]对前列腺癌组织和正常组织进行比较分析发现了首个与癌症相关的异常表达的lncRNA-PCA3(prostate cancer associated 3,PCA3),PCA3在前列腺癌组织中明显高表达并且具有很强的组织特异性,在前列腺癌的进展中具有重要的作用。目前PCA3已经成为临床上前列腺癌诊断的重要生物学标志物,并且与血清前列腺特异性抗原(PSA)检测相比具有非侵袭性、高特异性等优点[13]。
FENDRR基因是2009年最先鉴定,定位于染色体3q13.31,毗邻FOXF1,有4个外显子,编码一个长3099个核苷酸的lncRNA[2]。目前对FENDRR的研究较少,其表达和功能异常与肿瘤相关的报道更是罕见,其在子宫颈癌中的作用也尚不清楚。XU等[4]研究发现,与正常组织和细胞相比,FENDRR在胃癌组织和细胞系中的表达均呈现显著下调,并且其低表达与胃癌的高分期、深侵袭和高转移相关。进一步研究发现FENDRR通过降低纤维连接蛋白1和MMP2/MMP9的表达进而增强胃癌的迁移和侵袭能力,提示FENDRR在胃癌中具有一定的预后预测价值,并且还可能成为治疗的新靶点。MIAO等[14]对非小细胞肺癌(nonsmall cell lung cancer,NSCLC)及其正常对照组织进行基因芯片分析发现FENDRR在NSCLC中明显低表达,而过表达FENDRR使得肺癌细胞的迁移和侵袭能力下降。此外,FENDRR还能诱导肺癌细胞的凋亡[15]。为了探索FENDRR对宫颈癌细胞生物学特性的影响,本研究通过siRNA介导的基因干扰技术特异性干扰FENDRR在宫颈癌细胞中的表达,结合细胞增殖和Transwell实验,发现干扰FENDRR后宫颈癌细胞的体外增殖和迁移、侵袭能力均有所增强。此外,本研究还通过裸鼠成瘤实验进一步证实了干扰FENDRR能增强宫颈癌细胞的体内成瘤能力,说明FENDRR在宫颈癌中确实发挥了一定的抑癌作用,但具体机制目前还不清楚。PRC2是一种甲基转移酶,能甲基化H3K27以抑制特异性基因的转录,在染色质结构修饰和基因活性调节中具有重要作用[16-18]。研究表明,许多lncRNA功能的发挥都在一定程度上依赖于其与染色质修饰复合物PRC2之间的相互联系,其中研究得比较深入的是lncRNA HOTAIR。GUPTA等[19]通过对正常人类乳腺上皮细胞、原发性乳腺癌以及远处转移组织进行生物信息学分析,发现HOTAIR在原发性乳腺癌和转移性乳腺癌中表达水平增高,并且HOTAIR高表达与乳腺癌患者后期的转移和死亡密切相关,进一步研究发现HOTAIR主要通过结合PRC2发挥促进肿瘤侵袭和转移作用。同样地,近期研究发现FENDRR能够结合PRC2或TrxG/MLL复合体,后两者均为染色质修饰复合物,能促进靶基因启动子的甲基化,沉默靶基因的表达进而发挥相应的作用[3,20],还有研究表明FENDRR可能通过与PRC2复合物中的EZH2发生相互作用进而调节肺癌细胞的上皮-间质转化、多能性以及转移功能[14]。因此,我们推测FENDRR可能也是通过与染色质修饰复合物PRC2结合,沉默相应的靶基因,进而改变宫颈癌细胞的表型,但具体的调节机制还有待于进一步研究。
综上,本研究发现FENDRR对宫颈癌细胞的生物学特性具有抑制作用,干扰FENDRR的表达能增强宫颈癌细胞的体内外增殖能力和体外迁移、侵袭潜能,说明FENDRR可能在宫颈癌的进展中具有重要的抑癌作用。结合目前关于lncRNA的研究,我们推测FENDRR有可能成为一个新的生物标志物,为将来宫颈癌的诊断和治疗提供新的思路。
参考文献:
[1] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2] KHALIL A M, GUTTMAN M, HUARTE M, et al. Many human large intergenic noncoding RNAs associate with chromatin-modifying complexes and affect gene expression[J]. Proc Natl Acad Sci U S A, 2009, 106(28): 11667-11672.
[3] GROTE P, WITTLER L, HENDRIX D, et al. The tissuespecific lncRNA Fendrr is an essential regulator of heart and body wall development in the mouse[J]. Dev Cell, 2013,24(2): 206-214.
[4] XU T P, HUANG M D, XIA R, et al. Decreased expression of the long non-coding RNA FENDRR is associated with poor prognosis in gastric cancer and FENDRR regulates gastric cancer cell metastasis by affecting fibronectin1 expression[J]. J Hematol Oncol, 2014, 7: 63.
[5] DJEBALI S, DAVIS C A, MERKEL A, et al. Landscape of transcription in human cells[J]. Nature, 2012, 489(7414):101-108.
[6] PRENSNER J R, CHINNAIYAN A M. The emergence of lncRNAs in cancer biology[J]. Cancer Discov, 2011, 1(5):391-407.
[7] 孙祥威, 胡盈盈, 徐剑峰, 等. 长链非编码RNA AL049452在直肠癌组织中的表达及临床意义[J]. 温州医科大学学报, 2017, 47(8): 566-570.
[8] GUTTMAN M, AMIT I, GARBER M, et al. Chromatin signature reveals over a thousand highly conserved large noncoding RNAs in mammals[J]. Nature, 2009, 458(7235):223-227.
[9] HUARTE M, GUTTMAN M, FELDSER D, et al. A large intergenic noncoding RNA induced by p53 mediates global gene repression in the p53 response[J]. Cell, 2010, 142(3):409-419.
[10] ZHENG G X, DO B T, WEBSTER D E, et al. Dicer-microRNA-Myc circuit promotes transcription of hundreds of long noncoding RNAs[J]. Nat Struct Mol Biol, 2014, 21(7):585-590.
[11] WANG K C, CHANG H Y. Molecular mechanisms of long noncoding RNAs[J]. Mol Cell, 2011, 43(6): 904-914.
[12] BUSSEMAKERS M J, VAN BOKHOVEN A, VERHAEGH G W, et al. DD3: a new prostate-specific gene, highly overexpressed in prostate cancer[J]. Cancer Res, 1999, 59(23):5975-5979.
[13] WEI J T, FENG Z, PARTIN A W, et al. Can urinary PCA3 supplement PSA in the early detection of prostate cancer?[J].J Clin Oncol, 2014, 32(36): 4066-4072.
[14] MIAO L, HUANG Z, ZENGLI Z, et al. Loss of long noncoding RNA FOXF1-AS1 regulates epithelial-mesenchymal transition, stemness and metastasis of non-small cell lung cancer cells[J]. Oncotarget, 2016, 7(42): 68339-68349.
[15] 徐然, 尚超, 石文君. 长链非编码RNA FENDRR对非小细胞肺癌细胞增殖及凋亡的影响[J]. 现代肿瘤医学, 2016,24(17): 2667-2669.
[16] BRACKEN A P, DIETRICH N, PASINI D, et al. Genomewide mapping of Polycomb target genes unravels their roles in cell fate transitions[J]. Genes Dev, 2006, 20(9): 1123-1136.
[17] KU M, KOCHE R P, RHEINBAY E, et al. Genomewide analysis of PRC1 and PRC2 occupancy identifies two classes of bivalent domains[J]. PLoS Genet, 2008, 4(10):e1000242.
[18] SCHUETTENGRUBER B, CHOURROUT D, VERVOORT M, et al. Genome regulation by polycomb and trithorax proteins[J]. Cell, 2007, 128(4): 735-745.
[19] GUPTA R A, SHAH N, WANG K C, et al. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J]. Nature, 2010, 464(7291): 1071-1076.
[20] GROTE P, HERRMANN B G. The long non-coding RNA FENDRR links epigenetic control mechanisms to gene regulatory networks in mammalian embryogenesis[J]. RNA Biol,2013, 10(10): 1579-1585.

