菌株CICC 33077的鉴定及培养基组分的响应面优化
孙思佳,翟 磊,白飞荣,于学健,冯慧军,姚 粟*
(中国食品发酵工业研究院 中国工业微生物菌种保藏管理中心,北京 100015)
芝麻香型白酒是我国传统白酒的创新香型[1],也是鲁酒的代表香型,其介于浓香、清香、酱香之间,兼具多种香型白酒的风味特色[2-4],既有浓香型白酒的绵柔浓郁,酱香型白酒的幽雅细腻,清香型白酒的清净爽冽,同时还具有馥郁的芝麻香气,风格独特,自成一格[5],深受广大消费者的喜爱,具有广阔的市场发展前景。
芝麻香型白酒的生产离不开高温大曲,品质优级的高温大曲具有多菌系、多酶系的特点,能够维持芝麻香型白酒“芝麻香突出,诸味协调,丰满细腻,回味悠长”的风格特征[6-7]。淀粉酶在高温大曲的制备过程中发挥着重要的作用,该酶能将淀粉分解成小分子糖,不仅能够供微生物生长利用,形成复杂的微生物群落结构,还能够参与美拉德反应,形成白酒风味成分或前体物质,对白酒品质具有重要影响[8]。目前对大曲中产淀粉酶菌株的研究多集中于细菌和霉菌,而对高产淀粉酵母进行系统研究的较少[9-12]。
因此,本研究对分离于扳倒井芝麻香型白酒高温大曲中的一株高产淀粉酶的酵母菌株CICC 33077进行多相鉴定学分析,通过响应面法[13]对其培养基组分进行优化,并测定该菌株的最适生长温度与生长pH,旨在确定该菌株的分类学地位和最佳的培养条件,为后续该菌株的近一步研究和开发奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
菌株CICC 33077分离于扳倒井芝麻香型白酒高温大曲,保藏于中国工业微生物菌种保藏管理中心(Chinacenter of industrial culturecollection,CICC)。
1.1.2 培养基
麦芽浸粉琼脂(malt extract agar,MEA)培养基、麦芽浸粉肉汤(malt extract broth,MEB)培养基:北京陆桥技术有限公司;C培养基:生物梅里埃公司。
1.1.3 化学试剂
硝酸铵、磷酸氢二钾、硫酸镁、氯化钠(均为分析纯):北京化学试剂公司;酵母菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国OMEGA公司;溶壁酶(40 mg/mL):美国Sigma公司;蛋白酶(20 mg/mL):德国Merck公司;Taq DNA聚合酶、脱氧核糖核苷三磷酸(deoxyribonucleosidetriphosphate,dNTP)和DL2 000 Marker:北京天根生物有限公司。
1.2 仪器与设备
Olympus BH-2光学显微镜:奥林巴斯有限公司;FE20型pH计:梅特勒-托利多仪器(上海)有限公司;TProfessional standard 96 Gradient聚合酶链式反应(polymerasechain reaction,PCR)仪:德国Biometra公司;BHG-8082型恒温培养箱、THZ-98C恒温振荡培养箱:上海一恒科学仪器有限公司;Multiskan FC型酶标仪:赛默飞世尔(上海)仪器有限公司;BAL-TECCPD 030临界冷冻干燥仪、BAL-TECSCD005喷金-离子溅射仪:瑞士BAL-TEC公司;Hitachi SU8010扫描电镜:日本HITACHI公司;紫外分光光度计7200:尤尼科(上海)仪器有限公司。
1.3 试验方法
1.3.1 菌株CICC 33077多相分类学鉴定
采用多相分类学技术,从菌株的形态学、生理生化特征和分子生物学特性方面对菌株CICC 33077进行鉴定。
形态学鉴定:接种菌株CICC 33077于MEA固体培养基中,25℃培养48 h后,观察菌落形态特征;并挑取少许菌体置于载玻片蒸馏水中,盖好盖玻片,利用光学显微镜观察菌株显微形态。收集新鲜菌体,加入质量分数为2.5%的戊二醛于4℃条件下固定过夜,并离心收集菌体,使用pH 7.2、浓度为100 mmol/L磷酸盐缓冲液漂洗3次。分别使用体积分数为50%、70%、85%、95%乙醇溶液梯度脱水,无水乙醇脱水3次后,利用临界冷冻干燥仪进行二氧化碳临界点干燥,再通过喷金-离子溅射仪进行喷金后,使用Hitachi SU8010扫描电镜进行菌体形态观察。
生理生化试验:使用API20CAUX试剂条对菌株CICC 33077碳源底物利用特征进行测定[14]。具体操作过程:首先将新鲜培养的菌体加到0.85%NaCl中,制备成2 McFarland菌悬液。准确吸取100μL上述菌悬液,加到C培养基中混匀后,滴加到API20CAUX试剂条中,30℃培养72h后读取结果,O孔为阴性对照,出现浑浊即为阳性结果,说明菌株能够以该碳源作为生长的碳源。
分子生物学鉴定:利用酵母菌基因组DNA提取试剂盒提取菌株CICC 33077基因组DNA,利用引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)对26SrRNAD1/D2区基因进行扩增。PCR反应体系:10×PCRbuffer 5μL、dNTP(2.5mmol/L)4μL、模板2μL、Taq DNA聚合酶1μL、引物各1μL,补充双蒸水至50μL。反应条件:94℃预变性1 min;循环:94℃变性1 min,52℃退火1 min,72℃延伸90 s,36个循环;72℃后再延伸10 min。扩增产物用1%的琼脂糖进行检测后,送至北京诺赛基因组研究中心有限公司进行测序。将所得的26SrRNA D1/D2区基因序列测序结果用基本本地队列搜索工具(basic local alignment search tool,BLAST)软件与美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库进行相似性比对,使用MEGA 5.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树[15]。
1.3.2 菌株CICC 33077培养基优化
(1)培养方法
菌种活化:将甘油保藏的菌株CICC 33077接种到MEA斜面培养基,于28℃培养24 h进行活化。
种子培养:挑取一环活化好的菌株接种到MEB液体培养基中,于30℃、200 r/min条件下培养24 h,制备成种子液。
生长培养基:按照2%接种量将种子液接种于装液量为50 mL/250 mLMEB液体培养基中,于30℃、200 r/min条件下培养24 h后于波长600 nm处测定吸光度值。
(2)Plackett-Burman试验设计
选取麦芽浸粉(A)、可溶性淀粉(B)、大豆蛋白胨(C)、硝酸铵(D)、蛋白胨(E)、磷酸氢二钾(F)、氯化钠(G)和硫酸镁(H)8个因素制备液体培养基,根据单因素试验结果,每个因素设置两个水平,各因素及水平取值见表1。以菌株生物量(OD600nm值)为响应值,运用N=12的Plackett-Burman(PB)试验设计快速筛选对菌株CICC 33077生长影响显著的因素。
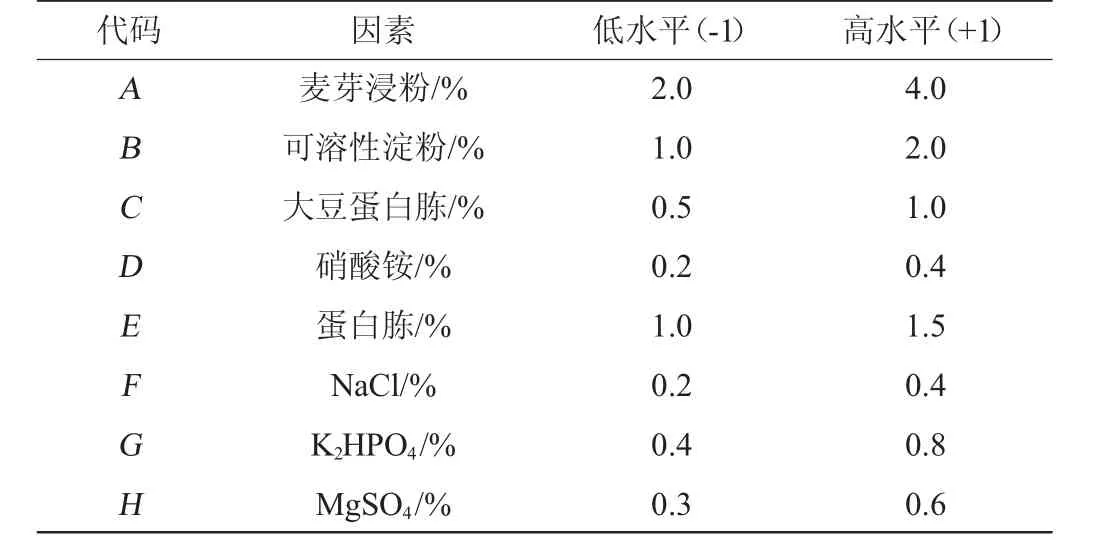
表1 Plackett-Burman试验设计因素与水平Table 1 Factors and levels of Plackett-Burman experiments design
(3)最陡爬坡试验
根据PB试验结果筛选出的显著因素设计最陡爬坡试验,确定各因素水平变化的方向和梯度,并以此确定响应面设计的中心点[16]。
(4)Box-Behnken试验设计
采用Box-Behnken试验设计对由PB试验筛选出的麦芽浸粉(A)、大豆蛋白胨(B)、蛋白胨(C)、磷酸氢二钾(D)4个显著因素进行优化,以最陡爬坡试验中最大响应值所对应的各因素水平为参考,设计响应面试验的中心点,并利用Design Expert 10.0.3软件对试验结果进行回归分析,试验因素与水平设计见表2。
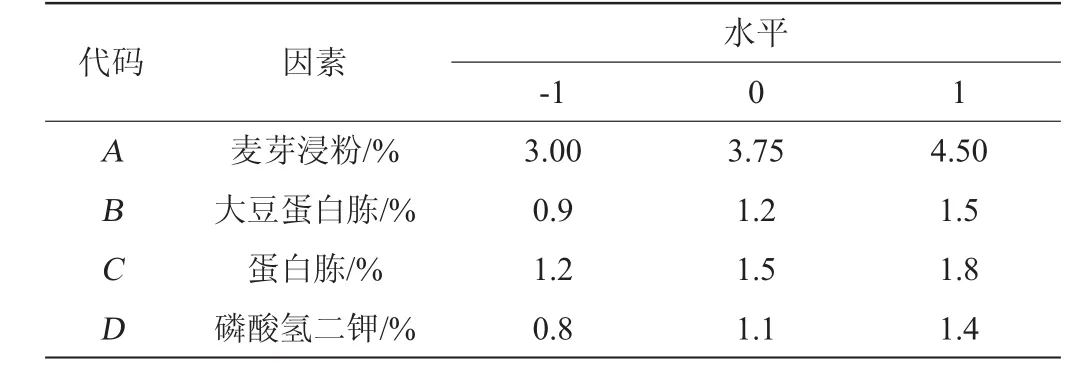
表2 Box-Behnken试验设计因素与水平Table 2 Factors and levels of Box-Behnken experiments design
1.3.3 菌株CICC 33077生长pH及温度的测定
在250 mL三角瓶中配制50 mL优化后的液体培养基,使用HCl和NaOH调节培养基的pH值为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0,培养温度分别于20 ℃、25℃、28℃、30℃、37℃、45℃,接种2%种子液后于30℃,200 r/min振荡培养24 h,测定培养物在波长600 nm处的吸光度值,以空白培养基为对照。
2 结果与分析
2.1 菌株CICC 33077多相分类学鉴定
2.1.1 菌株CICC 33077的形态学鉴定
菌株CICC 33077在MEA琼脂培养基上于25℃培养48 h,进行菌落形态鉴定及镜检测定,结果见图1。由图1a可知,菌落为乳白色,平伏,质地绒状,符合典型的酵母菌特征。由图1b及1c可知,在光学显微镜下和扫描电镜下观察,菌株CICC 33077的菌落直径为9.0~11.0μm,能够产生大量菌丝,细胞呈椭圆形或漏滴状,芽殖,部分菌丝产生大量的椭圆形芽孢子。

图1 菌株CICC 33077形态学观察结果Fig.1 Morphological observation results of strain CICC 33077
2.1.2 菌株CICC 33077的生理生化试验鉴定
菌株能够以D-葡萄糖、甘油、肌醇、山梨醇、纤维二塘、D-麦芽糖、D-蔗糖、D-棉子糖为碳源生长,不能以2-酮基-葡萄糖酸盐、L-阿拉伯糖、D-木糖等结果为唯一碳源生长,具体碳源利用情况见表3。
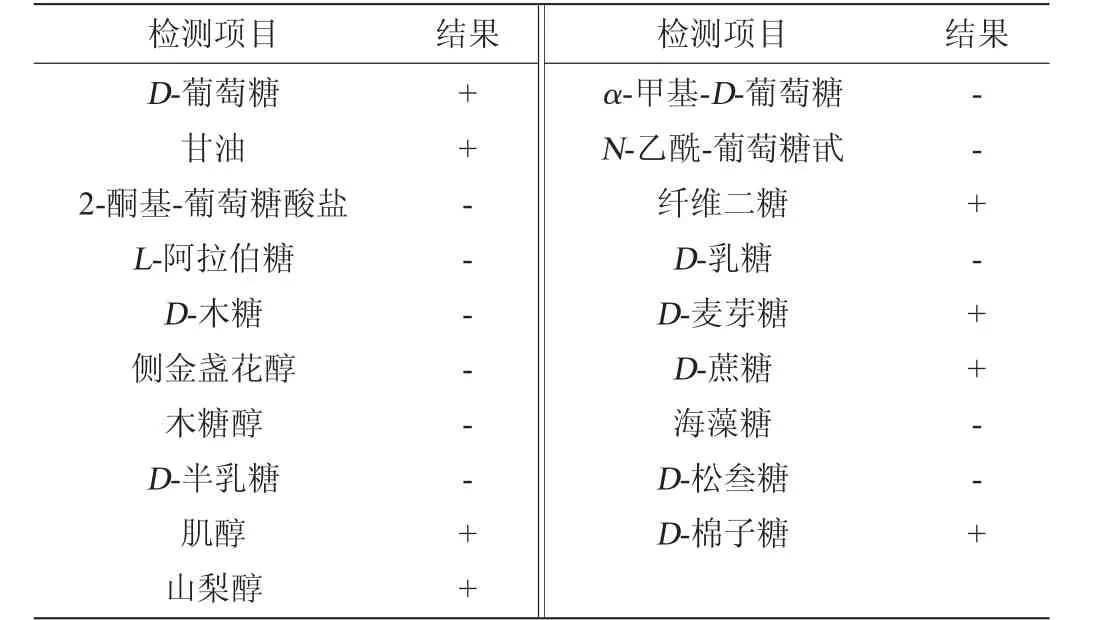
表3 菌株CICC 33077的生理生化试验结果Table 3 Results of physiological and biochemical tests of strain CICC 33077
2.1.3 菌株CICC 33077的分子生物学鉴定
将菌株CICC 33077 26SrRNA D1/D2区基因序列测序后递交数据库比对,发现与其亲缘最近的是Saccharomycopsis fibuligera NRRL Y-2388T,相似性达到100%,而与其他菌种的相似性均在99%以下;结合形态学特征及生理生化试验结果,将其鉴定为扣囊复膜孢酵母(Saccharomycopsis fibuligera),其26SrRNA D1/D2区基因序列登录号为MF324892。

图2 菌株CICC 33077 26S rRNA基因系统发育树Fig.2 26S rRNA gene phylogenetic tree of strain CICC 33077
2.2 响应面试验优化培养基组分
2.2.1 Plackett-Burman试验设计结果及分析
PB试验设计及结果见表4,对变量效应进行方差分析,结果见表5。由表5可知,8个因素中对响应值影响的显著性顺序为K2HPO4>麦芽浸粉>蛋白胨>大豆蛋白胨>MgSO4>NaCl>硝酸铵>可溶性淀粉,其中麦芽浸粉、大豆蛋白胨、蛋白胨及磷酸氢二钾为显著影响因素。麦芽浸粉、大豆蛋白胨及蛋白胨均属于复合营养物质,含有多种单糖、多聚糖及氨基酸、矿物质、维生素及微量元素等,这可能是促进菌体生长迅速的原因之一[17]。此外,磷酸氢二钾对菌株生长的显著促进作用可能是因为其提供了磷、钾两种元素,两者都能参与到菌株物质代谢或能量代谢过程中去[18-20],起到促进菌体生长的作用。根据试验结果,初步认为适当增加培养基中麦芽浸粉、大豆蛋白胨、蛋白胨以及磷酸氢二钾的含量有利于菌体生长,其他因素则无显著性影响。因此,选择麦芽浸粉、大豆蛋白胨、蛋白胨以及磷酸氢二钾为后续最陡爬坡试验和Box-Behnken试验设计的关键因素。

表4 Plackett-Burman试验设计及结果Table 4 Design and results of Plackett-Burman experiments
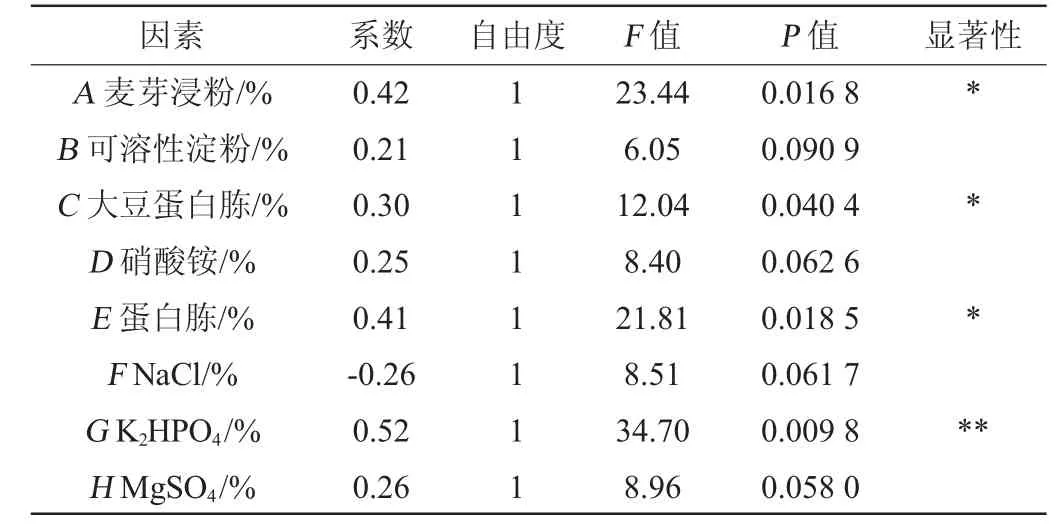
表5 Plackett-Buramn试验各因素效应分析Table 5 Effect analysis of each factor of Plackett-Burman experiments
2.2.2 最陡爬坡试验结果及分析
最陡爬坡法可以确定主要影响因素的水平,其以试验值变化的梯度方向为爬坡方向,根据各因素效应值的大小确定变化步长,能快速、经济地逼近最佳值区域[21]。最陡爬坡试验结果见表6。由表6可知,麦芽浸粉含量为4%,大豆蛋白胨含量为1.3%,蛋白胨含量为1.6%,磷酸氢二钾含量为1.2%的试验组合5的响应值(OD600nm值)达到最高,此后响应值(OD600nm值)开始降低,这说明适当增加培养基中碳源、氮源以及钾盐的含量有助于菌体的生长,但过多的添加反而造成不利影响,因此选择适宜的添加量尤为重要。考虑到序号4的试验组合响应值为7.96,序号5的试验组合响应值为8.03,两者相差不足0.1;故选取序号4试验组合与序号5试验组合中各种因素水平的中间值为后续Box-Behnken试验设计的中间点,此时各因素添加量为麦芽浸粉3.75%、大豆蛋白胨1.2%、蛋白胨1.5%、磷酸氢二钾1.1%。
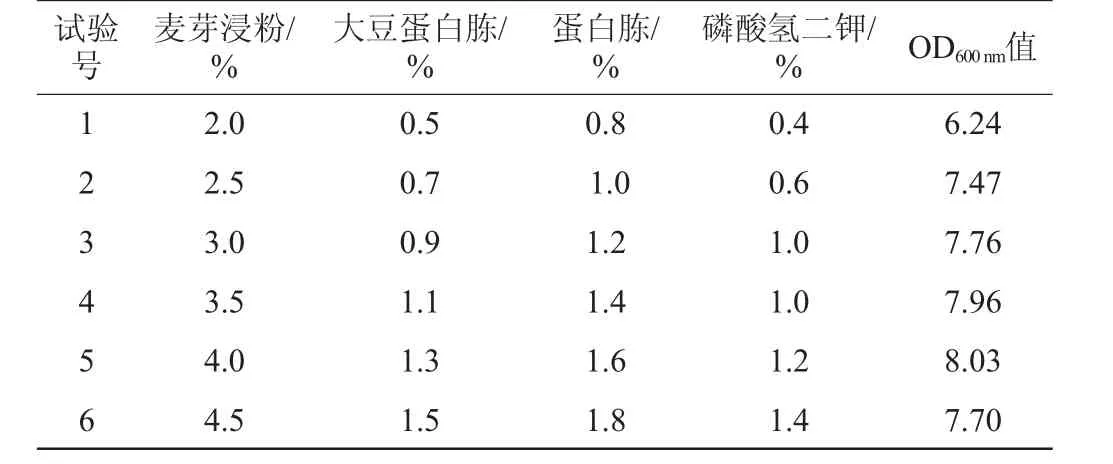
表6 最陡爬坡试验设计及结果Table 6 Design and results of the steepest ascent experiments
2.2.3 Box-Behnken试验设计结果及分析
响应面法可通过较少的试验,较短的周期在整个区域内给出因素与响应值之间的明确函数关系,且精度更高,同时能够研究几种因素间的交互作用。根据最陡爬坡试验筛选出的试验中心点,采用Box-Behnken试验设计,利用Design Expert 10.0.3软件试进行4因素3水平的响应面分析试验,试验设计及结果见表7。建立以OD600nm值(R)为目标函数的二次回归方程,并对所得到的回归方程进行方差分析与显著性检验,结果见表8。
生物量(R)与麦芽浸粉(A)、大豆蛋白胨(B)、蛋白胨(C)和磷酸氢二钾(D)之间的四元二次回归方程为:
R=8.0-0.18A+0.11B-0.062C+0.11D+0.30AB+0.023AC+0.06AD-0.09BC+0.077BD-7.500E-003CD-0.35A2-0.66B2-0.36C2-0.31D2
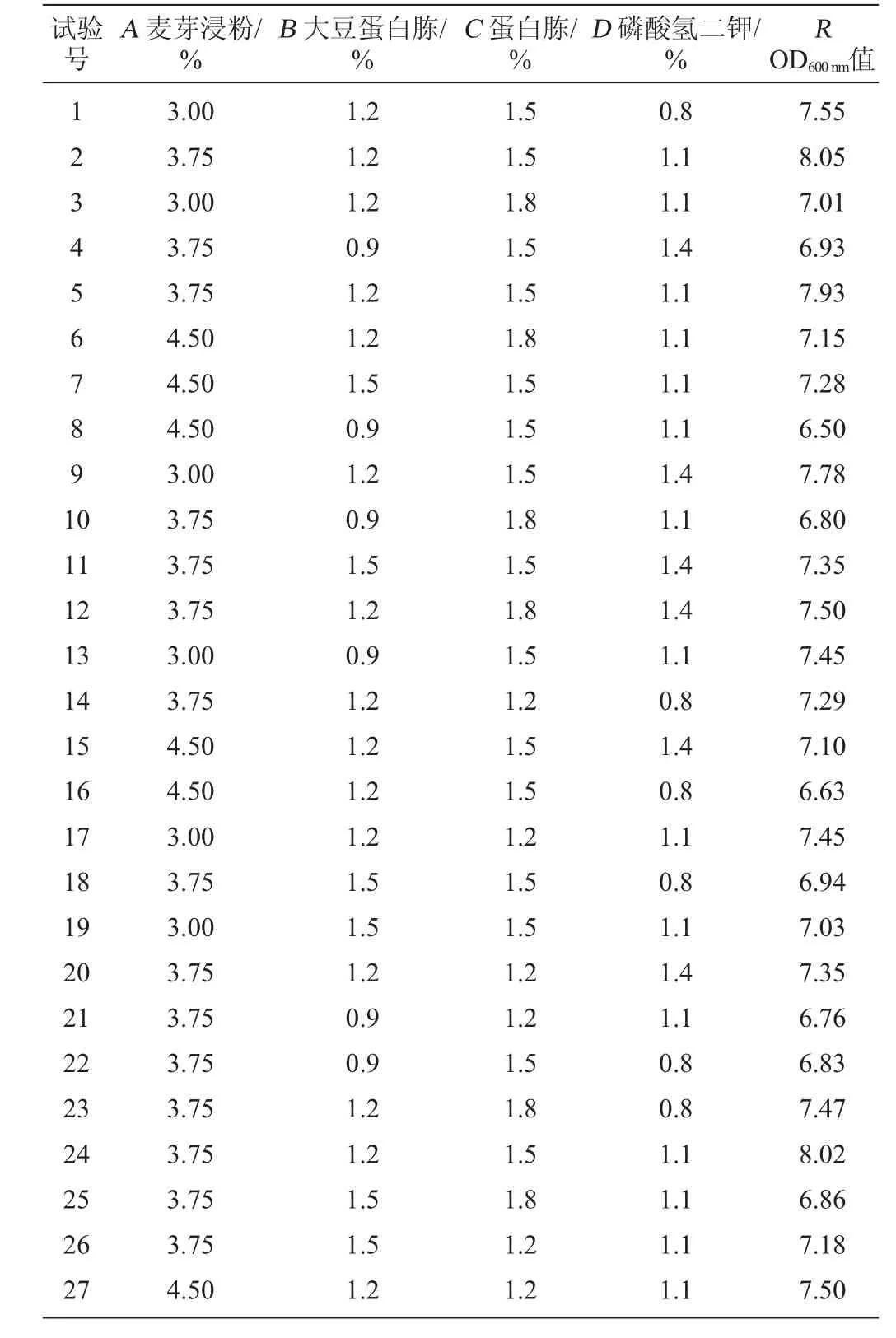
表7 Box-Behnken试验设计及结果Table 7 Design and results of Box-behnken experiments
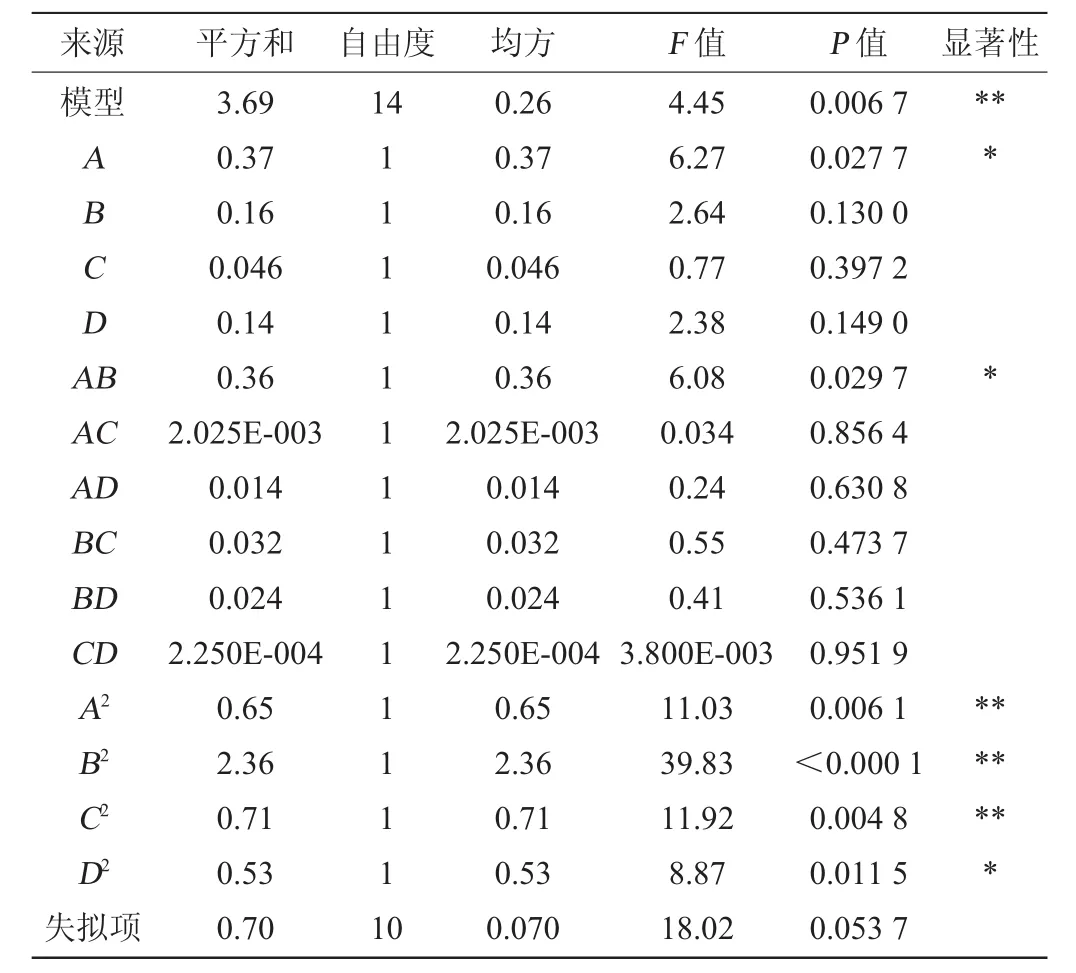
表8 回归模型方差分析Table 8 Variance analysis of regression model
由表8可知,该模型P值=0.006 7<0.01,达到极显著水平,且失拟项在置信区间95%水平上不显著(P=0.0537>0.05),说明模型拟合性较好,实验误差在可接受范围内,可以实际用于预测所选4个因素与菌体生长之间的情况。同时,一次项A,二次项D2及交互项AB影响显著(P<0.05),二次项A2、B2、C2影响极显著(P<0.01);说明麦芽浸粉含量对响应值(OD600nm值)有显著影响,麦芽浸粉与大豆蛋白胨含量对响应值(OD600nm值)有显著交互影响。麦芽浸粉、大豆蛋白胨、蛋白胨和磷酸氢二钾这4个因素中两两因素对响应值(OD600nm值)的交互作用,结果见图3。
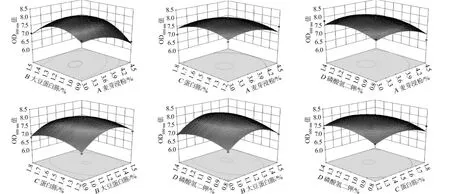
图3 酵母浸粉、大豆蛋白胨、蛋白胨及磷酸氢二钾含量交互作用对生物量影响的响应面和等高线Fig.3 Response surface plots and contour line of effects of interaction between yeast extract,soy peptone,peptone and K2HPO4 content on biomass
由图3可知,大豆蛋白胨与麦芽浸粉的交互效应影响显著。当大豆蛋白胨含量较低时,获得较高生物量(OD600nm值≈7.3)的麦芽浸粉含量大约在3.3%,当大豆蛋白胨含量为1.2%时,获得最高生物量(OD600nm值≈8.02)的麦芽浸粉含量大约在3.6%;这说明大豆蛋白胨与麦芽浸粉可能存在协同效应,在一定范围内,同时提高两者含量,可使菌株CICC 33077生物量增加。此外,图中等高线的形状可以反映出两因素之间交互作用的强弱,椭圆形表示交互作用强,对响应值影响显著,圆形则表示交互作用弱,对响应值影响不显著[22]。
根据上述分析及软件计算,预测培养基最佳组合为麦芽浸粉3.586%,大豆蛋白胨1.216%,蛋白胨1.470%,磷酸氢二钾1.148%,预测最高OD600nm值为(8.034±0.136)。为验证模型预测的可靠性,用预测得到的最优培养基条件下进行3次平行试验,得出OD600nm值的实际平均值为(8.096±0.112),与响应曲面拟合所得方程的预测值符合良好,说明该模型较为合理。
2.3 菌株CICC 33077生长pH及温度测定结果
菌株CICC33077生长pH值试验结果表明,初始pH值对扣囊复膜孢酵母(Saccharomycopsis fibuligera)CICC 33077生物量的影响很大,初始pH值在3.0~11.0时,菌株生长良好;pH 6.0时,该菌株菌体量达到最大值,pH值在1.0~2.0时,菌株CICC 33077生长趋于停滞。总体而言,该菌株pH适应范围广泛,能够应用于大曲发酵的酸性环境。
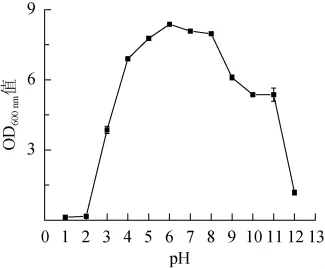
图4 扣囊复膜孢酵母CICC 33077生长pH值测定结果Fig.4 Determination results of growth pH of S.fibuligera CICC 33077
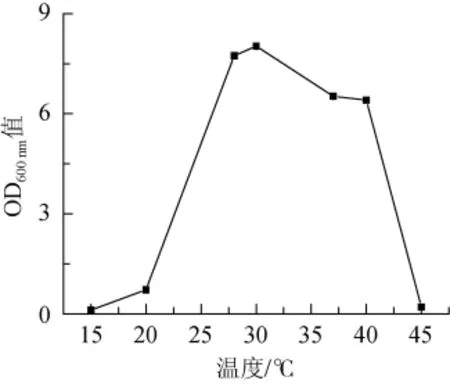
图5 扣囊复膜孢酵母CICC 33077生长温度值测定结果Fig.5 Determination results of growth temperature of S.fibuligera CICC 33077
菌株CICC 33077生长温度试验结果表明,扣囊复膜孢酵母(S.fibuligera)CICC 33077生长温度范围较广。该菌株在25~40℃条件下能保持良好生长;30℃为最适生长温度。20℃时,菌株生长缓慢;在低于15℃或高于45℃的条件下,该菌株停止生长。
3 结论
本研究采用多相分类鉴定技术对分离于扳倒井高温大曲中的产淀粉酶菌株CICC 33077分类学地位进行研究,鉴定结果表明,该菌株为扣囊复膜孢酵母(Saccharomycopsisfibuligera)。以生物量(OD600nm值)为响应值,利用PB设计、最陡爬坡试验及Box-Behnken设计对扣囊复膜孢酵母(S.fibuligera)CICC 33077培养基的营养物质进行了优化,最优培养基组分为麦芽浸粉3.586%,大豆蛋白胨1.216%,蛋白胨1.470%,磷酸氢二钾1.148%。对S.fibuligera CICC 33077生长温度与生长pH的研究表明,该菌株可在20~40℃,pH 3.0~pH 12.0条件下生长,最适生长温度为30℃,最适生长pH值为6.0。在此培养条件下利用优化培养基进行菌株的培养,生物量(OD600nm值)达到(8.136±0.102),比优化前提高了170%。
本研究通过对S.fibuligera CICC 33077的初步研究,确定了适合菌株生长的营养物质及培养条件,为下一步研究该菌株的生物学功能、固体产酶条件以及在扳倒井高温大曲生产中的实际应用奠定了基础。
参考文献:
[1]戚元民.对芝麻香型白酒的新认识[J].酿酒,2015,42(1):53-56.
[2]吕 磊.芝麻香型白酒关键微生物产香分析研究[D].齐鲁工业大学,2014.
[3]臧 威,谢广发,孙剑秋,等.绍兴黄酒酒药中酵母菌的物种资源[J].菌物学报,2015,34(6):1078-1084.
[4]ROSGAARD L,PEDERSEN S,MEYER A S.Comparison of different pretreatment strategies for enzymatic hydrolysis of wheat and barley straw[J].Appl Biochem Biotechnol,2007,143(3):284.
[5]车明秀,胡明燕,王 骏,等.芝麻香型白酒风味物质主体成分研究进展[J].酿酒科技,2016(11):97-99.
[6]高传强,阳 飞,张华山.芝麻香型白酒微生物菌群及风味物质研究进展[J].微生物学通报,2017,44(4):940-948.
[7]徐岩.科学传承、集成创新走中国白酒技术持续发展的道路——对芝麻香酒的看法和认识[J].酿酒科技,2013(4):17-20.
[8]童 彦,雒莎莎,应铁进.鱼蛋白水解液美拉德反应条件优化及反应前后氨基酸组成变化[J].中国食品学报,2011,11(8):101-106.
[8]毛 祥,黄 丹,沈才萍,等.酱香型大曲中产淀粉酶菌的分离鉴定及发酵特性研究[J].中国酿造,2015,34(12):24-27.
[9]权淑静,解复红,马 焕,等.一株产酸性α-淀粉酶菌株的筛选及酶学性质研究[J].中国酿造,2014,33(5):104-108.
[10]赵群丽,吴天祥,刘 昕.酱香大曲中一株酿酒细菌的筛选及酶活测定[J].酿酒科技,2015(11):41-44.
[11]王鑫昕,耿 霄,吴子龙,等.丛台酒大曲中高产淀粉酶细菌的分离和鉴定[J].酿酒科技,2017(1):30-32.
[12]赵敏洁,蔡海莺,李 杨,等.出芽短梗霉产脂肪酶培养基的响应面优化[J].中国食品学报,2017,17(7):77-85.
[14]BEGANOVICJ,KOSB,LEBOSPAVUNC A,et al.Traditionally produced sauerkraut as source of autochthonous functional starter cultures[J].Microbiol Res,2014,169(7-8):623-632.
[15]TAMURA K,DUDLEY J,NEIM,etal.MEGA4:molecular evolutionary geneticsanalysis(MEGA)softwareversion 4.0[J].Mol Biol Evol,2007,24(8):1596-1599.
[16]XIAO Z J,LIU PH,QIN JY,et al.Statistical optimization of medium components for enhanced acetoin production from molasses and soybean meal hydrolysate[J].Appl Microb Biotechnol,2007,74(1):61-68.
[17]王振河,武模戈,董自梅,等.不同碳氮源对平菇菌株新831菌丝生长的影响[J].湖北农业科学,2007,46(1):91-93.
[18]WETZEL R G,TUCHMAN N C.Effects of atmospheric CO2enrichment and sunlight on degradation of plant particulate and dissolved organic matter and microbial utilization[J].Archiv Fur Hydrobiologie,2005,162(3):287-308.
[19]POTEKHINA N V,SHASHKOV A S,STRESHINSKAYA G M,et al.Teichoic acidsof threetypestrainsof the Bacillussubtilis,group,Bacillus mojavensis,VKM B-2650,Bacillus amyloliquefaciens,subsp.amyloliquefaciens,VKM B-2582,and Bacillussonorensis,VKM B-2652[J].Microbiology,2013,82(5):571-578.
[20]田康明,尔 昊,路福平,等.磷酸盐精确控制策略提升大肠杆菌生长和产物合成效率[J].食品工业科技,2016,37(1):184-188.
[21]ROBERT H C.Fundamental concepts in the design of experiments[M].Holt:Rinehart and Winst,1982:35-42.
[22]曹楠楠,陈香荣,吴 艳.苦豆子多糖的超声波提取工艺优化及理化性质研究[J].现代食品科技,2014,31(2):209-215.
《中国酿造》杂志征稿启事
《中国酿造》创刊于1982年,是由中国商业联合会主管,中国调味品协会及北京食品科学研究院主办的综合性科技期刊。并历次被评为全国中文核心期刊、中国科技核心期刊、《中国知网》重点收录期刊、《万方数据库》全文收录期刊、《中文科技期刊数据库》来源期刊、中国学术期刊网络出版总库收录期刊、美国《乌利希期刊指南》(UPD)收录期刊、英国《食品科学文摘》(FSTA)收录期刊、英国《国际农业与生物科学研究中心》(CABI)收录期刊、美国《化学文摘》(CA)收录期刊、俄罗斯《文摘杂志》(AJ)收录期刊、中国科学评价研究中心(RCCSE)数据库收录期刊,也是学位与研究生教育的中文重要期刊。
本刊主要面向全国各大高等院校、科研院所、各级党政机关、相关企事业单位的广大专家学者、工程技术人员、本科生、硕士博士研究生、管理人员等。
《中国酿造》主要栏目有:研究报告、专论综述、创新与借鉴、经验交流、分析与检测、产品开发、酿造文化、海外文摘等。
欢迎踊跃投稿!
网站:www.chinabrewing.net.cn邮箱:zgnzzz@163.com电话:010-83152738/83152308
征稿范围:
(1)新工艺、新技术、新设备在酿造行业的应用;(2)调味品的研发创新与推广应用;(3)调味品产业生产管理及产品质量安全评价;(4)食品添加剂在酿造行业的应用;(5)现代高新检测技术在酿造行业的应用;(6)酿酒产品开发、生产管理及产品质量安全的控制;(7)发酵法制备酒精、氨基酸、高级醇及有机酸等工艺研究;(8)微生物发酵工艺及培养基发酵条件优化;(9)发酵工程菌种的筛育与人工诱变、杂交选育及基因工程改造研究;(10)生物质能源的开发利用及规模化制备;(11)传统发酵食品生产工艺改进、微生物菌种改良、发酵机理及规模化生产研究;(12)食品及发酵工业废水、废渣处理及综合利用;(13)益生菌及功能型发酵乳制品研究与开发;(14)行业实用技术、政策、法规、标准及行业动态和最新举措等。
注意事项:
(1)来稿要求论点明确、数据可靠、逻辑严密、文字精炼。在文稿首页用脚注说明论文属何项目、何基金(编号)资助,本刊将优先报道国家级、省部级及国际合作项目的科研成果;第一作者及通讯作者(一般为导师)简介(包括姓名、出生年月、性别、职称、学位、研究方向或目前主要从事的工作、邮箱、联系电话)。(2)稿件要求8000字以内,须有中图分类号,文献标志码,中英文标题、单位、作者,并有200~300字的中英文摘要和5~8个关键词,标题、摘要、表题、图题请用中英文对照。摘要内容应包括研究目的、方法、结果和结论;综述文章可写指示性摘要。(3)来稿内容涉及配方时,应写明配料的名称和配比,勿用代号;工艺过程要完整,不要省略;插图、表格需放在正文相应地方,不要集中;引用的图表要有出处,计量要用法定单位。(4)文稿参考文献一般研究论文约25篇参考文献,不可少于20篇,综述论文不少于35篇。研究性论文和综述性论文中近5年文献不少于参考文献总数的一半,外文文献不少于5篇,期格式请参照GB/T 7714—2015《信息与文献参考文献著录规则》。(5)来稿必须是最新的、作者自身创造性的科研成果,且是在中外文正式刊物上未发表的论文。本刊严禁一稿多投、重复内容多次投稿、不同文种重复投稿。(6)我刊以实现对所有来稿的文字复制比对工作,若文字复制比超过30%的稿件我刊不予采用。(7)稿件一经录用,即被认为同意收录于《中国学术期刊(光盘版)》、万方数据库等,同意入编数据库及上网发布,与此有关的作者著作权使用费与稿酬一次性给付。作者如有异议,请在投稿时声明。

