不同有机氮源对葡萄酒发酵的影响
谢诗怡,韩 月,张 烨,孙玉梅*
(大连工业大学 生物工程学院,辽宁 大连 116034)
随着葡萄酒消费量的增加,对葡萄酒品质的要求也越来越高。葡萄酒品质与酿酒葡萄原料和酿造工艺密切相关[1]。酵母可同化氮(yeast assimilablenitrogen,YAN)即能被酵母利用的氮源,主要是除脯氨酸外的α-氨基酸、小分子多肽和铵态氮这三类氮源[2]。葡萄原料的可同化氮含量直接影响酵母菌的生长和代谢,从而影响葡萄酒的发酵过程和最终产品质量。当酿酒葡萄中可同化氮含量过低时,会影响发酵速度并产生有刺激性的二氧化硫气体影响酒的品质[3]。为保证氮源不足的葡萄原料正常发酵,常添加无机氮源如磷酸氢二铵,或添加氨基酸。添加铵盐或单一氨基酸会导致酵母利用更多的糖合成氨基酸,使乙醇转化率下降,同时影响葡萄酒中有机酸生成[4]。使用混合氨基酸作为补加氮源能保证葡萄酒发酵的进程和品质[5]。酵母浸粉含有大量的氨基酸、肽、小分子蛋白、核苷酸、糖、维生素和风味化合物,常用作抗生素、氨基酸、有机酸、酶制剂等发酵生产的氮源[6],也有用作酸奶发酵氮源的探讨[7]。在葡萄酒氮源补充方面,目前主要选用无机氮源和氨基酸,对混合氨基酸作氮源的研究仅测定了糖、甘油、乙醇、乙酸等呈味物质,并未测定高级醇产量[8-10]。而且,尚无酵母浸粉的应用先例。为了探究酵母浸粉是否适合作为葡萄酒发酵的补加氮源,本研究分别以相同可同化氮含量的酵母浸粉和混合氨基酸作为模拟葡萄汁唯一氮源,进行葡萄酒发酵,从发酵过程中的二氧化碳生成量以及还原糖、可同化氮、甘油和挥发性化合物含量,对比两种氮源对葡萄酒发酵过程和葡萄酒品质的影响,以探究酵母浸粉作为葡萄酒发酵氮源不足时补加氮源的可能性。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
商业酵母ST:法国LAFFORT公司;717型阴离子交换树脂:天津市科密欧化学试剂有限公司。
1.1.2 化学试剂
葡萄糖、果糖:山东西王药业有限公司;酵母浸粉(生化试剂):北京奥博星生物试剂有限公司;各种氨基酸、乙醛:上海阿拉丁生化科技有限公司。乙醇:国药集团化学试剂有限公司;乙酸:天津市恒兴化学试剂有限公司;乙酸乙酯、正丙醇、异丁醇:天津市科密欧化学试剂有限公司;异戊醇:天津市光复科技发展有限公司。所有试剂均为分析纯。
1.2 仪器与设备
GC6850气相色谱仪:安捷伦科技有限公司;722S可见分光光度计:上海精密科学仪器有限公司;TELTA320 pH计:梅特勒-托利多仪器有限公司;CR21GⅢ离心机:日立工机株式会社。
1.3 方法
1.3.1 酵母驯化
为了适应葡萄酒发酵的高糖低温环境,需对活性干酵母进行逐级驯化,再将种子液接种到发酵液中。本实验涉及的活性干酵母驯化步骤如下:称取1 g活性干酵母加入10 mL无菌水中进行溶解,在38℃条件下恒温培养15 min,每5min轻微搅动一次。随后加入10mL稀释2倍的模拟葡萄汁,在25℃条件下恒温培养1 h,每30 min搅动一次。最后加入20 mL模拟葡萄汁,20℃条件下恒温培养2 h,每30 min搅动一次。得到酵母种子液。
1.3.2 模拟汁成分
葡萄糖180 g/L、果糖180 g/L、柠檬酸0.5 g/L、苹果酸5 g/L、酒石酸5 g/L、磷酸二氢钾5 g/L、无水硫酸镁0.5 g/L。
氮源:两组分别添加酵母浸粉和混合氨基酸作为唯一氮源,氮源添加量为180mg/L酵母可同化氮(YAN)。此含量为普通葡萄汁中平均有机氮源含量。即分别添加酵母浸粉3.9 g/L,混合氨基酸(180 mg/L)[11],组成详见表1。
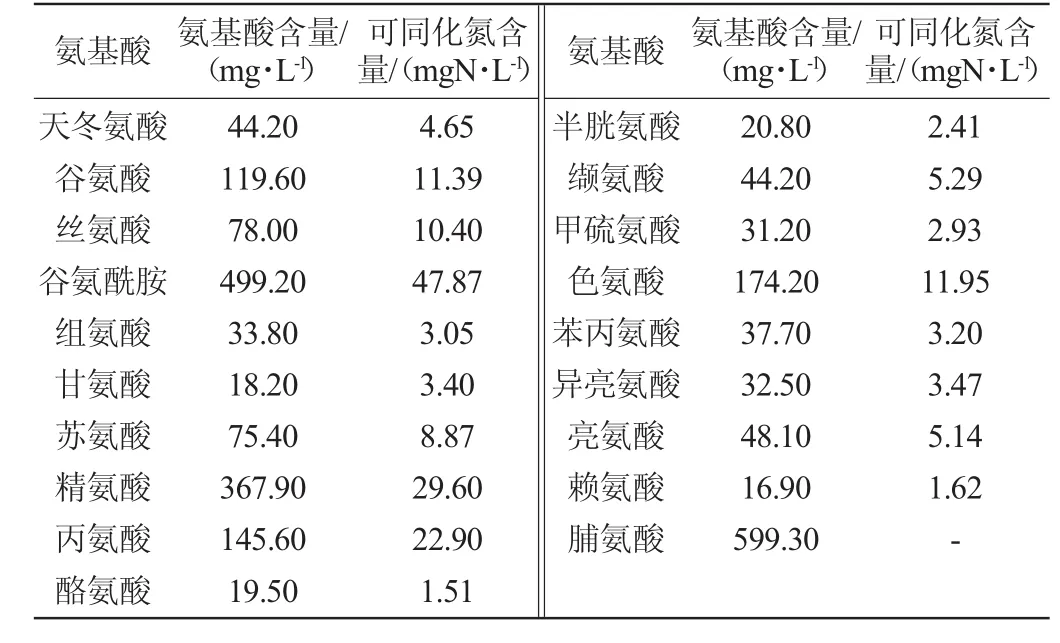
表1 混合氨基酸成分及可同化氮含量Table 1 Composition and assimilable nitrogen contents of mixed amino acids
1.3.3 葡萄酒发酵
每瓶接入驯化后的种子液12 mL,于18℃条件下控温发酵。发酵体系为1 L玻璃瓶:瓶高35 cm,直径7.6 cm,瓶口外径2.5 cm,瓶径长6 cm。
在1 L酒瓶中装500 mL模拟汁,每瓶接入驯化后的种子液12 mL,于18℃条件下控温发酵。发酵前2 d用棉塞封瓶口,当发酵液中有气体产生时,把棉塞换为发酵栓,进行厌氧发酵。
1.3.4 取样及样品预处理
发酵过程中前期(0~10 d)每3天取样一次,中期(10~20 d)和后期(20~30 d)每5 d取样一次,取样量为35 mL。发酵液于4℃,10 000 r/min离心10 min得发酵上清液,将其保存于-20℃冰箱中,待测定。测定各理化指标时,于4℃冰箱中解冻。
1.3.5 分析检测
二氧化碳生成量测定:采用发酵体系失重测量法。充分晃动装有发酵栓的玻璃瓶,使发酵液充分混匀且其中溶解的二氧化碳完全溢出,然后采用电子天平进行测量[12]。
还原糖含量测定:将发酵上清液用去离子水稀释至适当浓度,用3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法测定还原糖含量[13]。
甘油含量测定:采用高碘酸氧化法[14]。步骤:①处理树脂。用1 mol/L NaOH和HCl按照碱-酸-碱的顺序对201×7型强碱阴离子交换树脂进行洗脱。洗脱时用树脂体积的3~5倍的1 mol/L NaOH或HCl洗脱1 h,最后用去离子水洗至中性并用17g/L的AgNO3检测是否有氯离子存在,如有则继续用去离子水洗至无氯离子后备用。②装柱。取洗脱后的树脂,填装到长20 mL,内径1 cm的玻璃柱中,调整液面高于树脂表面0.5 cm左右。③上样。取2 mL发酵上清液加入到玻璃柱中。④收集洗脱液。上样后开始收集洗脱液,控制流速为2 mL/min左右。洗脱时,加入无二氧化碳去离子水保持液面距树脂表面0.5 cm左右,每管收集洗脱液2 mL。⑤洗脱液检测。每管洗脱液中取0.2 mL进行还原糖检测,直至洗脱液中出现还原糖为止。
可同化氮含量测定:采用甲醛值法[15]。量取50 mL甲醛溶液于100 mL烧杯中,置于磁力搅拌器上,将pH电极放到烧杯中合适的位置,边搅拌边用0.1 mol/L NaOH溶液调整甲醛溶液pH 8.5,备用。在5mL发酵上清液中加45mL去离子水和3滴30%过氧化氢。在磁力搅拌下,用0.1 mol/L NaOH溶液调整上述混合液的pH值为8.5。然后加入2 mL pH 8.5的甲醛溶液,反应3 min,用0.01 mol/L标准NaOH溶液滴定至pH 8.5。记录消耗0.01 mol/L标准NaOH溶液的体积。样品中可同化氮含量计算公式如下:
M=14×C×V×1 000/5
式中:M为样品中可同化氮含量,mg/L;C为标准NaOH溶液浓度,mol/L;V为0.01 mol/L标准NaOH溶液消耗体积,mL;14为氮的毫克当量;5为样品体积,mL;1 000为换算系数。
挥发性化合物的测定采用气相色谱法。样品前处理:准确移取7mL发酵上清液于顶空气相瓶中,加入1.4g NaCl固体和磁力搅拌转子,压盖器密封顶空瓶盖,放在磁力搅拌器(350 r/min、45 min)上使NaCl充分溶解,放置于进样槽。静态顶空气相色谱(headspacegaschromatography,HS-GC)条件:安捷伦7697A顶空进样器,Agilent DB-FFAP色谱柱(30 m×0.25 mm×0.25μm),检测器是氢火焰检测器(flame ionization detector,FID),空气流量300 mL/min,氢气流量30 mL/min,载气(氮气)流量10 mL/min。分流进样:分流比是10∶1;进样量2μL;样品平衡温度90℃;样品平衡时间30 min;进样口温度250℃,检测器温度250℃。升温程序:初始温度40℃,保持10 min,然后以5℃/min升至190℃,保持1 min,接着以20℃/min升至230℃,保持2 min。
定性定量方法:选择含量较高和影响较大的7种挥发性化合物(乙醇、乙酸、乙醛、乙酸乙酯、正丙醇、异丁醇、异戊醇)标准品,在上述色谱条件下进行分析,以各种挥发性化合物的色谱出峰时间作为样品组分的定性依据。将处理好的样品按上述色谱条件进行分析,以各挥发性化合物的色谱峰面积进行定量。
1.3.6 数据分析
本研究的不同氮源发酵均采取两组平行,所有理化指标均为3个平行测定,实验结果为平行实验的平均值。实验数据均用SPSS24进行显著性分析。
2 结果与分析
2.1 不同氮源的葡萄酒发酵二氧化碳生成量
在葡萄酒发酵过程中,伴随着二氧化碳的生成和排放,发酵体系的质量减少。因此,发酵系统减少的质量即二氧化碳生成量。通常用二氧化碳生成量衡量发酵状态。YAN为180 mg/L的不同氮源的葡萄酒发酵二氧化碳生成量结果见图1。
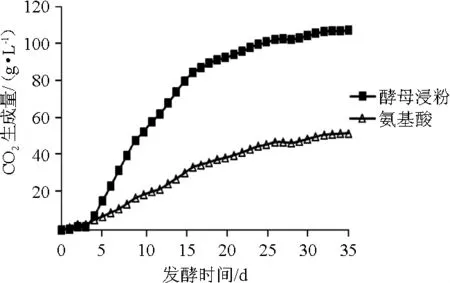
图1 葡萄酒发酵过程中二氧化碳生成量的变化Fig.1 Changes of carbon dioxide production during wine fermentation process
由图1可知,酵母浸粉组和混合氨基酸组均从第3天开始生成二氧化碳,发酵前20 d二氧化碳积累较快,累积生成量分别为92.4 g/L和38.6g/L,后15d的两组二氧化碳生成量变化较小,仅增加14.6 g/L和13.0 g/L,可能因为在此前还原糖被大量消耗并生成大量乙醇,抑制了酵母活性。在整个发酵过程中,酵母浸粉组的二氧化碳生成量一直大于混合氨基酸组(P<0.05),两组后15 d的二氧化碳生成量差值始终在53.8~55.4 g/L。在JOLLY N P等[15]的研究中,二氧化碳生成量的变化规律与本研究相似,其发酵状态转变时间为发酵第7天,这种差异可能是由于发酵初始糖浓度不同而造成的。
酵母浸粉不但富含各种氨基酸,还含有维生素及无机盐等微量物质[7],这些微量物质可能在一定程度上对酵母的生长代谢起到促进作用。上述结果表明,与混合氨基酸氮源相比,酵母浸粉氮源虽不能缩短启酵时间和发酵状态转变时间,但可以加快发酵速度。
2.2 不同氮源的葡萄酒发酵还原糖含量
还原糖作为葡萄酒发酵的能源和碳源,在发酵过程中逐渐被消耗,常用其含量变化衡量发酵进度。还原糖剩余量也影响最终葡萄酒的品质。YAN为180 mg/L的不同氮源的葡萄酒发酵过程中还原糖含量变化结果见图2。
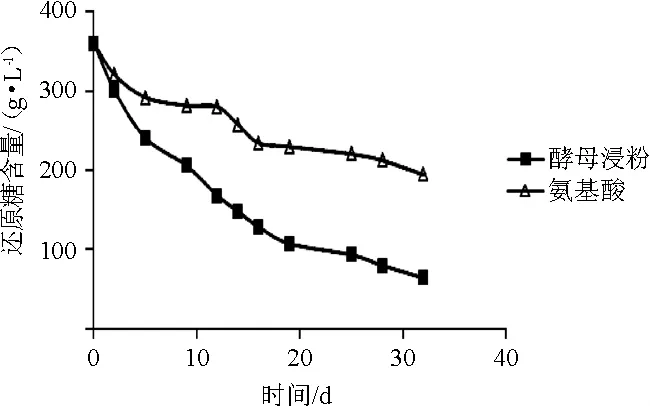
图2 葡萄酒发酵过程中还原糖含量的变化Fig.2 Changes of reducing sugar contents during wine fermentation process
由图2可知,酵母浸粉组降糖速度始终快于混合氨基酸组。酵母浸粉组在5~16 d时发酵迅速,而混合氨基酸组则为12~16 d。从整体上看,酵母浸粉组比混合氨基酸组发酵速度快,耗糖量大(P<0.05),两组最终还原糖消耗量分别为295.70 g/L和165.24 g/L。产生这种差异是因为酵母浸粉所含的维生素等物质对酵母生长代谢具有促进作用。这一结果与二氧化碳生成量变化规律相一致,与混合氨基酸相比,酵母浸粉具有加快发酵速度的特点。
2.3 不同氮源的葡萄酒发酵甘油含量
甘油无挥发性、无气味,不影响葡萄酒香气;具有甜味、黏性,有利于提高葡萄酒的质量。提高甘油含量会增加葡萄酒的甜味和黏度[16]。YAN为180 mg/L的不同氮源的葡萄酒发酵甘油含量变化结果见图3。
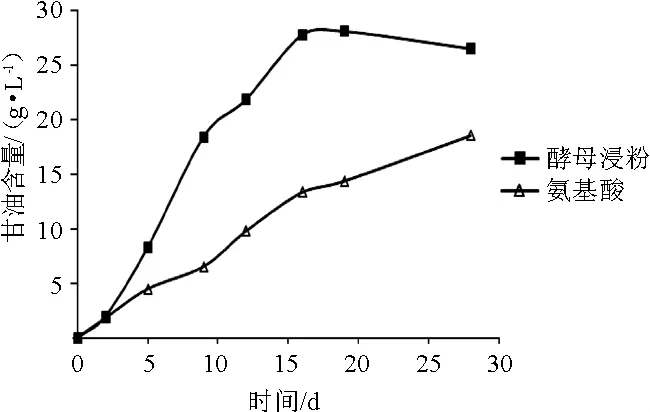
图3 葡萄酒发酵过程中甘油含量的变化Fig.3 Changes of glycerol contents during wine fermentation process
由图3可知,在发酵过程中,氨基酸组平稳持续积累甘油。酵母浸粉组在发酵前15 d甘油生成量较大,15~19 d趋于平稳,在发酵19 d达到最大值28.08 g/L,之后略降低至26.50 g/L。酵母菌在高浓度糖酒精发酵时产甘油以抵抗高糖带来的高渗透压以及在较高的乙醇浓度下保持酵母活性[17],生成的甘油可能用于合成其他物质而使后期甘油含量降低。氨基酸组的甘油生成量始终小于同期酵母浸粉组的甘油生成量,最终两组甘油含量分别为18.55 g/L和26.50g/L,差异显著(P<0.05)。本研究结果与PIGEAUGM等[18-19]的研究结果一致。
2.4 不同氮源的葡萄酒发酵可同化氮含量
可同化氮含量会影响发酵过程中酵母的生长和代谢,影响乙醇、甘油、酯类、乙酸、高级醇、乙醛和H2S等含量[4]。YAN为180 mg/L的不同氮源的葡萄酒发酵可同化氮含量变化结果见图4。
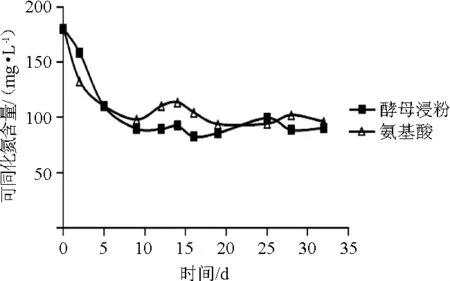
图4 葡萄酒发酵过程中可同化氮含量的变化Fig.4 Changes of assimilable nitrogen contents during wine fermentation process
由图4可知,酵母浸粉组和氨基酸组的可同化氮变化趋势大致相同,均在发酵9~14 d间有小幅度增加,涨幅分别为2.48 mg/L和15.85 mg/L,这一现象可能是发酵液中酵母自溶释放出内容物所致。过高的可同化氮含量可能促进腐败微生物生长,增加葡萄酒中氨基甲酸乙酯和生物胺含量,增加葡萄酒的毒性,影响葡萄酒的品质[4]。两种实验氮源的葡萄酒发酵可同化氮消耗分别为89.41mg/L和84.17mg/L,没有明显差异(P>0.05)。结果表明,酵母浸粉作为氮源并不影响酵母对发酵液中可同化氮的利用。
2.5 不同氮源的葡萄酒发酵风味物质含量
2.5.1 乙醇含量
YAN为180 mg/L的不同氮源的葡萄酒发酵乙醇含量变化结果见图5。
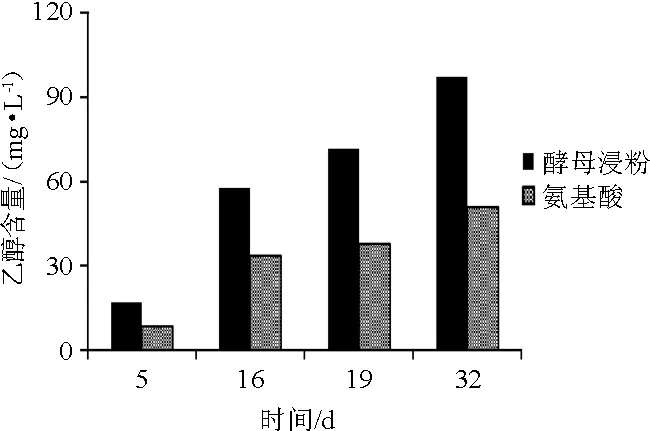
图5 葡萄酒发酵过程中乙醇含量的变化Fig.5 Changes of ethanol contents during wine fermentation process
由图5可知,两组乙醇生成速度均为先快后慢。乙醇积累量过大,抑制酵母活性,导致生成速度减慢。酵母浸粉组在整个发酵过程中乙醇生成速度一直高于混合氨基酸组,最终两组乙醇含量差异显著(P<0.05),分别为97.20 g/L和51.05 g/L。这种差异是由酵母浸粉对酵母生长代谢的促进作用导致的。乙醇是酵母无氧发酵的重要产物,其生成量随耗糖量增加而增加,这也与PIGEAU GM等[18-19]的研究结果一致。结果表明,与混合氨基酸相比,酵母浸粉做氮源可以更快更多的生成乙醇,减少发酵时间。
2.5.2 乙酸含量
乙酸是酒精发酵的副产物,由酵母的异常代谢生成。由于其具有特殊气味和口味,因此在葡萄酒中应控制乙酸含量,一般不宜超过1.2 g/L[20]。YAN为180 mg/L的不同氮源的葡萄酒发酵乙酸含量变化结果见图6。
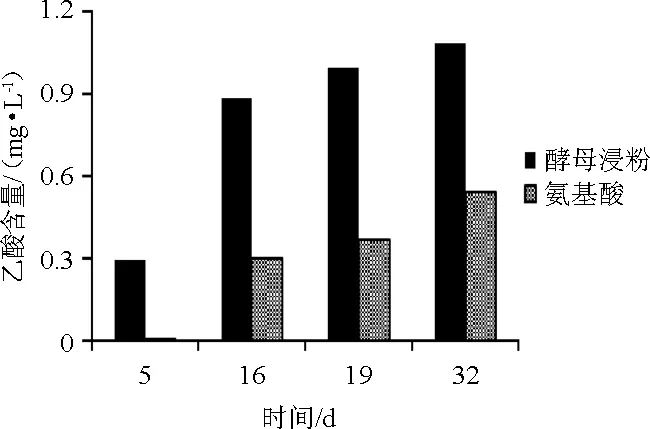
图6 葡萄酒发酵过程中乙酸含量的变化Fig.6 Changes of acetic acid contents during wine fermentation process
由图6可知,酵母浸粉组和氨基酸组乙酸含量均持续增加,16 d后乙酸生成速度减小。第5天时两组乙酸含量分别为0.29 g/L和0.11 g/L,差异显著(P<0.05),说明酵母浸粉组比混合氨基酸组更早的开始生成乙酸。在整个发酵过程中,酵母浸粉组乙酸含量一直高于混合氨基酸组,最终两组乙酸含量分别为1.08g/L和0.54g/L,差异显著(P<0.05)。两组乙酸含量随还原糖消耗量增而增加。研究表明,当初始还原糖含量为350~400 g/L时,乙酸含量与耗糖量正相关[19],这与本研究结果一致。结果表明,与混合氨基酸相比,酵母浸粉作为氮源生成乙酸用时更短且生成量更大。
2.5.3 乙醛含量
乙醛是酒精发酵过程中通过丙酮酸脱羧形成,随后被还原成乙醇。含量过高(≥80 mg/L)会影响葡萄酒的品质[12]。YAN为180 mg/L的不同氮源的葡萄酒发酵乙醛含量变化结果见图7。
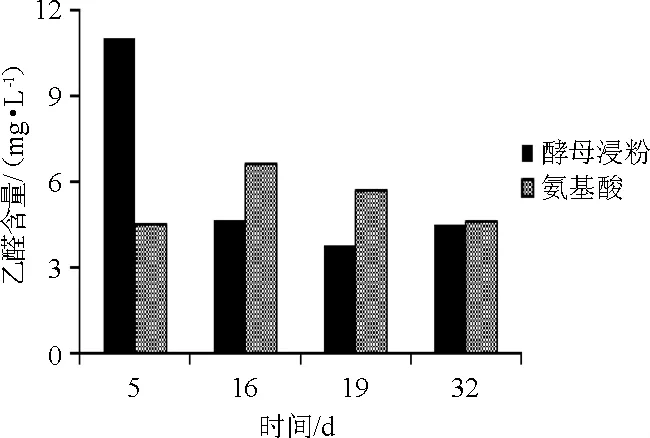
图7 葡萄酒发酵过程中乙醛含量的变化Fig.7 Changes of acetaldehyde contents during wine fermentation
由图7可知,酵母浸粉组在发酵第5天时乙醛含量达到最大值11.01 mg/L,之后乙醛含量开始下降,第19天时下降为3.78 mg/L,在发酵后期有小幅回升,增加至4.50 mg/L。混合氨基酸组则在第16天之间达到最大值6.65 mg/L,第16天后直至发酵结束持续下降至4.63 g/L。发酵结束时两组乙醛含量无显著差异(P>0.05)。上述结果表明,与混合氨基酸相比,酵母浸粉更早更快的生成和消耗乙醛,若缩短发酵时间,则酵母浸粉组会产生比混合氨基酸更少的乙醛。
2.5.4 乙酸乙酯含量
乙酸乙酯具有甜味和果香味,浓度过高时有刺激性气味,因此葡萄酒中乙酸乙酯含量不宜过高[16]。YAN为180 mg/L的不同氮源的葡萄酒发酵乙酸乙酯含量变化结果见图8。
由图8可知,酵母浸粉组和混合氨基酸组乙酸乙酯含量变化趋势基本相同。在发酵各个时期酵母浸粉组乙酸乙酯含量始终高于混合氨基酸组,最终两组乙酸乙酯含量分别为46.05 mg/L和32.35 mg/L,差异显著(P<0.05)。由于发酵过程中的乙酸乙酯是由乙酸和乙醇合成[21],因此乙酸乙酯含量与乙酸含量变化趋势相似。
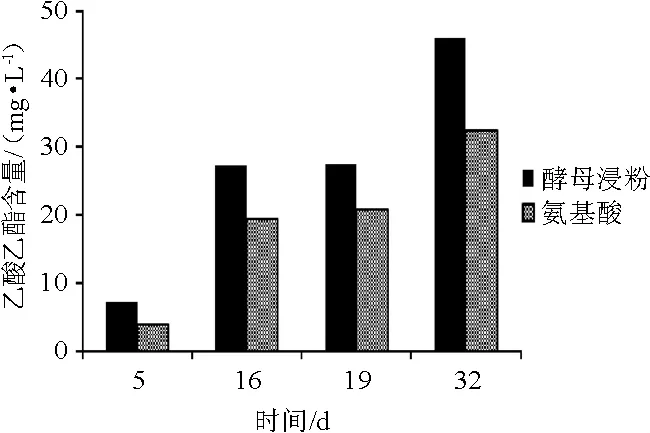
图8 葡萄酒发酵过程中乙酸乙酯含量的变化Fig.8 Changes of ethyl acetate contents during wine fermentation
2.5.5 高级醇含量
高级醇是酵母菌异常代谢的产物,普遍具有刺激性,含量在250~350 mg/L为宜,含量过高(≥550 mg/L)时易使饮用者有“上头”感[22]。YAN为180 mg/L的不同氮源的葡萄酒发酵高级醇含量变化结果见图9。
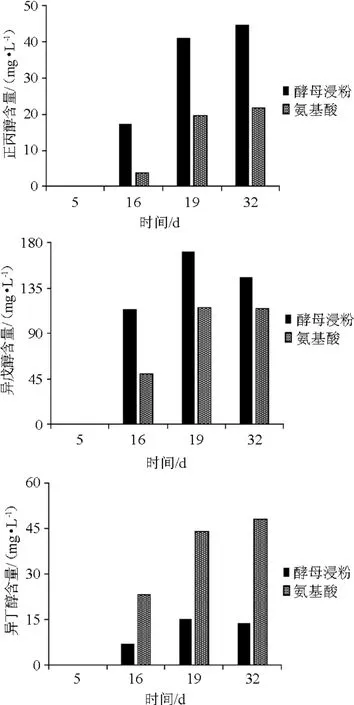
图9 葡萄酒发酵过程中高级醇含量的变化Fig.9 Changes of higher alcohol contents during wine fermentation process
由图9可知,发酵前5 d两组均没有高级醇生成。两组高级醇生成规律相似,酵母浸粉组生成更多正丙醇和异戊醇,混合氨基酸组生成更多异丁醇。这种差异可能是由于两种氮源氨基酸组成含量不同导致。由于正丙醇、异丁醇和异戊醇为葡萄酒发酵过程中生成量最大的3种高级醇[23],故葡萄酒发酵的高级醇生成总量可用这三种高级醇生成量的总和表示。最终酵母浸粉组高级醇总生成量(203.78 mg/L)略大于混合氨基酸组(184.32mg/L),无显著差异(P>0.05)。
3 结论
本研究分别采用酵母浸粉和混合氨基酸为模拟葡萄汁发酵的可同化氮源,在可同化氮供应量均为180mg/L的情况下,两组的可同化氮消耗量也基本相同,分别为89.41 mg/L和84.17mg/L。两组各生成物含量都在国标允许范围内[15,24],与混合氨基酸相比,使用酵母浸粉还原糖消耗量增加130.47 g/L,增加乙醇46.14 g/L、甘油7.95 g/L、乙酸0.54 g/L,增幅分别为78.95%、90.38%、42.84%和99.35%。两组乙酸乙酯和高级醇生成量无明显差异(P>0.05)。可见,酵母浸粉作氮源不同程度地促进了模拟葡萄汁发酵中还原糖的消耗和各种物质的生成。由此可以证明,酵母浸粉可以作为葡萄酒发酵的氮源补充,添加少量酵母浸粉有利于加快发酵速度,但若大量添加酵母浸粉可能会导致葡萄酒品质的降低。
参考文献:
[1]GOBBIM,COMITINIF,D‘IGNAZIG,et al.Effects of nutrient supplementation on fermentation kinetics,H2Sevolution,and aroma profile in Verdicchio DOCwineproduction[J].Eur Food Res Technol,2013,236(1):145-154.
[2]张 瑾.可同化氮素对酵母酒精发酵影响的研究[D].杨凌:西北农林科技大学,2009.
[3]UGLIANO M,FEDRIZZIB,SIEBERT T,et al.Effect of nitrogen supplementation and saccharomyces species on hydrogen sulfide and other volatilesulfur compoundsinshirazfermentationand wine[J].J Agr Food Chem,2009,57(11):4948-4955.
[4]郭在力,栾 静,孙玉梅.可同化氮对葡萄酒发酵影响的研究进展[J].中国酿造,2016,35(4):19-23.
[5]MARTÍNEZ-MORENOR,MORALESP,GONZALEZR,et al.Biomass production and alcoholic fermentation performance of Saccharomyces cerevisiae as a function of nitrogen source[J].FEMS Yeast Res,2012,12(4):477-485.
[6]余龙江.发酵工程原理与技术应用[M].北京:化学工程出版社,2006:67-80.
[7]孙长胜,伍业旭,李 啸.酵母浸粉在酸奶发酵中的应用研究[J].现代食品,2015(24):59-61.
[8]VILANOVA M,UGLIANO M,VARELA C,et al.Assimilable nitrogen utilisation and production of volatile and non-volatile compounds in chemically defined medium by Saccharomycescerevisiae wine yeasts[J].Appl Microbiol Biot,2007,77(1):145-157.
[9]STURGEON JQ,BOHLSCHEID JC,EDWARDSCG.Theeffect of nitrogen source on yeast metabolism and H2S formation[J].J Wine Res,2013,24(3):182-194.
[10]HERNANDEZ-ORTEP,BELY M,CACHOJ,et al.Impact of ammonium additions on volatile acidity,ethanol,and aromatic compound production by different Saccharomyces cerevisiae strains during fermentation in controlled synthetic media[J].Aust J Grape Wine Res,2006,12(2):150-160.
[11]BELTRAN G,NOVO M,ROZÈSN,et al.Nitrogen catabolite repression in Saccharomyces cerevisiae during wine fermentations[J].FEMS Yeast Res,2004,4(6):625-632.
[12]RODRÍGUEZ-PORRATA B,NOVOM,GUILLAMÓNJ,et al.Vitality enhancement of the rehydrated active dry wine yeast[J].Int J Food Microbiol,2008,126(1):116-122.
[13]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 12143—2008饮料通用分析方法[S].北京:中国标准出版社,2008.
[14]彭晋平,杨继红,彭新立,等.高碘酸氧化滴定碘法测定甘油含量的研究[J].精细石油化工,2001(4):67-68.
[15]JOLLY N P,AUGUSTYN O PR,PRETORIUSIS.The effect of non-Saccharomyces yeasts on fermentation and wine quality[J].South Afr J Enol Viticult,2017,24(2):55-62.
[16]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15037—2006葡萄酒[S].北京:中国标准出版社,2006.[17]李 华.葡萄酒工艺学[M].北京:科学出版社,2007:77-78.
[18]PIGEAU G M,BOZZA E,KAISER K,et al.Concentration effect of Rieslingicewinejuiceon yeast performanceand wineacidity[J].J Appl Microbiol,2007,103(5):1691-1698.
[19]裴广仁,李记明,于 英,等.冰葡萄酒中高含量挥发酸的影响因素分析[J].食品与发酵工业,2014,40(3):58-62.
[20]FROHMAN CA,DE ORDUÑA R M.Cellular viability and kinetics of osmotic stress associated metabolites of Saccharomyces cerevisiae during traditional batch and fed-batch alcoholic fermentations at constant sugar concentrations[J].Food Res Int,2013,53(1):551-555.
[21]GUITART A,ORTEPH,FERREIRA V,et al.Someobservationsabout the correlation between the amino acid content of musts and wines of the Chardonnay variety and their fermentation aromas[J].Am J Enol Viticult,1999,50(3):253-258.
[22]黄宏慧,周锡生,覃民扬,等.野生山葡萄酒杂醇油含量偏高的原因及对策[J].广西轻工业,2002(1):17-18.
[23]刘学强,钱 泓,周 正,等.低产高级醇葡萄酒酵母菌株的筛选[J].食品与发酵工业,2016,42(3):73-78.
[24]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 25504—2010冰葡萄酒[S].北京:中国标准出版社,2010.

