glmU基因单功能敲除对大肠杆菌生产氨基葡萄糖的影响
董瑞真,李丕武,石 凤,李 康,汪俊卿*
(齐鲁工业大学 生物工程学院 山东省微生物工程重点实验室,济南 250353)
氨基葡萄糖(glucosamine,GlcN)也称葡萄糖胺,是一种重要的功能性单糖,可作为食品配料使用,还是结缔组织和胃肠道结膜中糖蛋白的天然成分[1]。在呼吸系统的粘液分泌物中GlcN也发挥着作用[2]。MCALINDON TE等[3]认为GlcN能缓解关节炎疼痛。RICHY F等[4]认为GlcN可治疗膝骨关节炎。GlcN的生产方法主要有甲壳素水解法和酶生物转化法[5]以及微生物发酵法[6]。甲壳素水解法的原料贝壳类生产的GlcN易对人体产生过敏反应,该方法消耗大量的酸碱导致环境污染严重[7]。酶生物转化法所需的甲壳素酶的价格高增加了生产成本[8]。微生物发酵法利用微生物代谢合成GlcN,在基因水平上对菌种进行改造具有广阔的发展空间[5]。微生物发酵法具有原料来源易获得,发酵时间比较短,对环境污染小以及服用不会出现过敏反应等优点[9-13]。
已有利用Red同源重组技术敲除大肠杆菌(Escherichia coli)的甘露糖转运子编码基因(manX)和乙酰氨基葡萄糖转运子编码基因(nagE)以及葡萄糖磷酸转运系统编码基因(ptsG),减少了发酵液中氨基葡萄糖和乙酰氨基葡萄糖由胞外向胞内的转运,同时还分别敲除了糖酵解途经相关基因丙酮酸激酶编码基因pykA和pykF,氨基葡萄糖总产量有所提高[9]。但是在现有改造条件下,细胞中依然存在着氨基葡萄糖的消耗途径,本实验敲除glmU基因葡糖胺-1-磷酸乙酰转移酶结构域,减少氨基葡萄糖的消耗途径。
GlmU蛋白是由456个氨基酸组成的双官能团酶,有尿苷酰转移酶和乙酰转移酶两种活性[14]。大肠杆菌(E.coli)的glmU蛋白参与细胞壁肽聚糖和脂多糖的合成[15]。作为双功能酶的glmU在医学界被认为是细菌靶,因为glmU蛋白的抑制能导致细胞壁的分解使细胞死亡[16]。在原核生物中催化从葡萄糖胺-1-磷酸(glucosamine-1-phosphate,GlcN-1P),乙酰辅酶A(coenzymeA,CoA)和三磷酸尿苷(uridinetriphosphate,UTP)形成二磷酸尿苷(Uridinediphosphate,UDP)-乙酰氨基葡萄糖(UDP-GlcNAc)[17]。图1是E.coli BL21细胞内氨基葡萄糖的代谢途径,敲除葡糖胺-1-磷酸乙酰转移酶结构域来积累氨基葡萄糖和乙酰氨基葡萄糖。弱化glmU功能可以减弱氨基葡萄糖-6-磷酸(glucosamine-6-phosphate,GlcN-6P)向UDP-乙酰氨基葡萄糖(UDP-GlcNAc)方向的流失,积累了GlcN-6P。GlcN-6P向胞外转运时去磷酸化,产生GlcN。
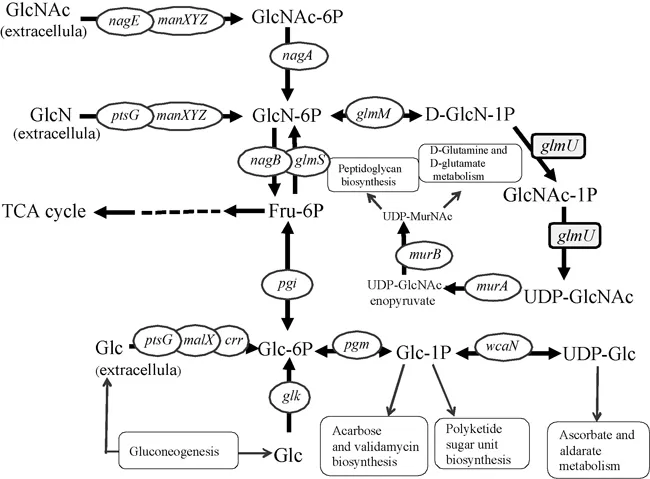
图1 E.coli BL21氨基葡萄糖代谢途径Fig.1 Metabolism pathway of E.coli BL21
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒与引物
大肠杆菌(E.coli)BL21:上海北诺生物科技有限公司;E.coli DH5α:实验室保藏菌株;提供抗性基因ampR的质粒pHT01:宝生物工程(大连)有限公司;所用引物见表1。
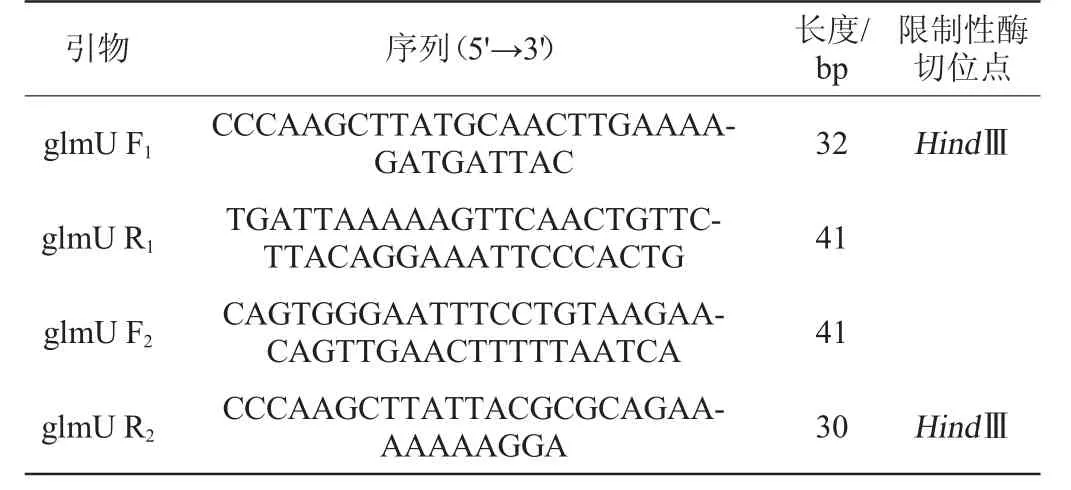
表1 实验所用引物Table 1 Primers used in the study
1.1.2 试剂
FastDigest HindⅢ:赛默飞世尔科技有限公司;基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、DNA胶回收试剂盒:上海生工生物工程有限公司;高纯度质粒小量快速提取试剂盒:北京艾德莱生物科技有限公司。
0.257 mol/L四硼酸钾试液、对二甲氨基苯甲醛试液、Ehrlich试剂、乙酰丙酮试剂:上海源叶生物科技有限公司。
1.1.3 培养基
LB液体培养基:酵母膏5g/L,蛋白胨10g/L,NaCl10g/L,pH 7.0。LB固体培养基:LB液体培养基中加入20 g/L琼脂。发酵培养基:葡萄糖40 g/L,蛋白胨10 g/L,酵母浸粉1 g/L,KH2PO417 mmol/L,K2HPO472 mmol/L,MgSO415 mmol/L,FeCl30.025 g/L,MnCl215 mg/L,(NH4)2SO43 g/L。
1.2 仪器与设备
OLABO-100C恒温振荡摇床:苏州威尔实验用品有限公司;ProFlex聚合酶链式反应(polymerasechain reaction,PCR)仪:赛默飞世尔科技有限公司;DYY-12型电泳仪:北京市六一仪器厂;MD2000H核酸超微量系列分光光度计:英国BioFuture公司;804R型离心机、4308型电转仪:德国Eppendorf公司。
1.3 方法
1.3.1 制备glmUⅠ-ampR重组同源性片段
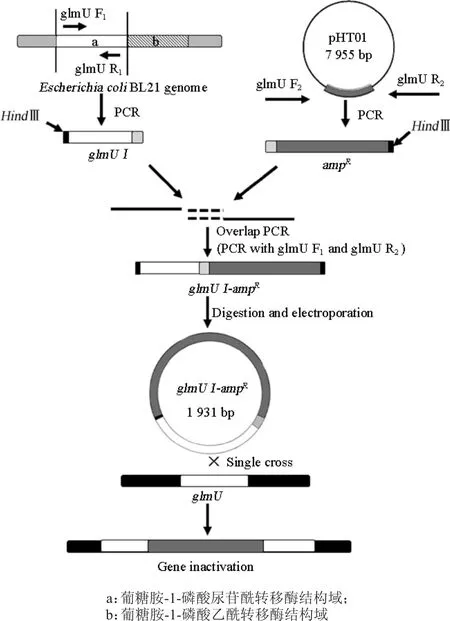
图2 E.coli BL21ΔglmU构建流程图Fig.2 Flowchart of E.coli BL21ΔglmU construction
用同源单交换的方法敲除glmU基因,提取E.coli BL21基因组,引物glmUF1和glmUR1进行PCR扩增,获得长度为603 bp的同源臂glmUⅠ;引物glmU F2和glmU R2扩增pHT01上的1 328 bp抗性基因片段ampR;glmUⅠ与ampR分别连接至CV08-pZERO-Blunt质粒上,转化至E.coli DH5α中,寄到测序公司测序,分别选取正确的基因序列,glmU F1和glmU R2为引物进行PCR扩增重叠延伸PCR,获得长度为1 931 bp的同源重组片段glmUⅠ-ampR(见图2)。
1.3.2 glmUⅠ-ampR片段的酶切、浓缩
用限制性内切酶HindⅢ酶切glmUⅠ-ampR基因片段后:加入酶切液1/10体积的3 mol/L醋酸钠和2.5倍体积的无水乙醇,放在-20℃冰箱中1 h,12 000 r/min离心3 min弃掉上清液,用体积分数70%的乙醇重悬清洗沉淀,离心除去乙醇,最后加入20μLddH2O重悬DNA[18]。用核酸超微量分光光度计测定glmUⅠ-ampR片段质量浓度在500 ng/μL左右。
1.3.3 制备电转感受态细胞及电转化
详细步骤参考朱森康等[19]制备感受态细胞的方法。
100μL感受态细胞与10μL glmUⅠ-ampR浓缩片段混合后再加入预冷的电转杯中冰浴10 min后立即电转化(2 500 V,25 mF,5 ms)。电击后立即加入1 mL LB培养基,复苏2 h左右,将细胞液涂布在含有抗生素ampR的LB培养基平板上培养。
1.3.4 筛选阳性重组菌株
从抗性平板上挑取单菌落接种到含ampR抗性的LB培养基中培养16 h后,提取基因组,用glmU F1和glmU R2做菌落PCR验证,选出阳性重组菌株。
1.3.5 发酵培养基优化
为了使重组菌发酵效果更显著,因此需要对培养基成分优化。分别对葡萄糖(20g/L、40g/L、50g/L、60 g/L),蛋白胨(5 g/L、10 g/L、15 g/L、20g/L),酵母浸粉(0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L),MnCl2(5 mg/L、10 mg/L、15 mg/L、20 mg/L、25 mg/L)添加量进行优化。
1.3.6 发酵培养与氨基葡萄糖的测定
将E.coli BL21和E.coli BL21ΔglmU分别接种于50 mL LB培养基中,待OD600nm≈4时,取种子液转接于含50 mL发酵培养基的500 mL摇瓶中。接种量为10%,37℃、200 r/min摇床培养,每隔2 h用10 mol/L KOH调节发酵液pH值为7.0,每种菌做3组平行。
按标准曲线计算氨基葡萄糖与N-乙酰氨基葡萄糖的浓度参考文献[20]。
2 结果与分析
2.1 基因敲除片段glmUⅠ-amp R的构建、电转化及筛选
PCR扩增结果都用1%琼脂糖凝胶电泳检测,结果见图3。由图3(a)可知,条带与理论长度603 bp相符,表明获得glmU基因同源臂glmUⅠ;由图3(b)可知,条带与理论长度1 328 bp相符,表明获得ampR片段;由图3(c)可知,条带与理论长度1 931 bp相符,表明获得glmUⅠ-ampR;由图3(d)可知,出现了glmUⅠ-ampR片段1 931 bp长度的条带,表明电转成功,获得E.coli BL21ΔglmU菌株。
2.2 发酵培养基优化结果
葡萄糖添加量优化结果见表2。由表2可知,葡萄糖添加量为40g/L时发酵结果最理想。如葡萄糖添加量过高,菌体就会产生大量乙酸和副产物,不仅抑制菌体生长而且干扰发酵产物的产生[21]。
蛋白胨添加量优化结果见表3。由表3可知,蛋白胨添加量为10 g/L时发酵结果最理想。初步推测继续增大蛋白胨添加量,发酵液黏度会增加,溶解氧含量减少,氨糖产量反而有所下降,培养基营养成分过高使菌体代谢废物增多[22]。
酵母粉添加量优化结果见表4。由表4可知,酵母粉添加量为1 g/L时发酵结果最理想。酵母粉添加量>1 g/L时,随酵母粉添加量增大,氨基葡萄糖产量下降。
氯化锰添加量优化结果见表5。由表5可知,氯化锰添加量最优为15 mg/L,再增大其添加量,氨基葡萄糖产量略微减小。
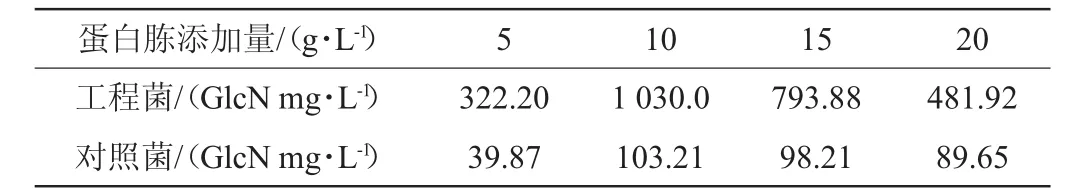
表3 蛋白胨添加量对发酵结果的影响Table 3 Effect of peptone addition on fermentation results
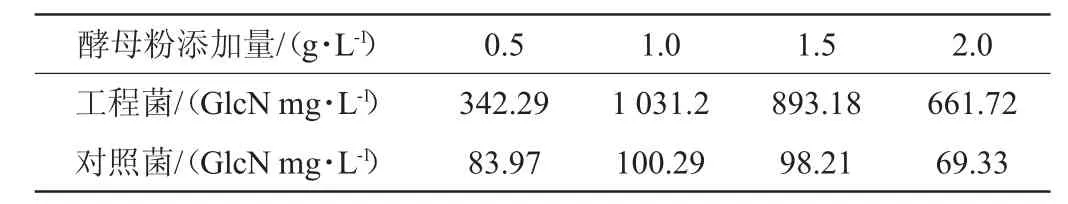
表4 酵母粉添加量对发酵结果的影响Table 4 Effect of yeast powder addition on fermentation results

表5 氯化锰添加量对发酵结果的影响Table 5 Effect of manganese chloride addition on fermentation results
2.3 工程菌发酵结果
用优化后的培养基发酵,将E.coli BL21ΔglmU和E.coli BL21的发酵结果对比分析,结果见图4。
由图4a可知,两种菌发酵2~10 h时,生长速度基本一,12 h后E.coli BL21ΔglmU生长进入稳定期,12~16 h E.coli BL21生长加快,16 h后进入稳定期,E.coli BL21ΔglmU的生长稳定期比E.coli BL21提前4 h。从总体趋势来看,相同培养条件下,E.coli BL21ΔglmU的OD600nm值明显低于E.coli BL21,表明glmU基因的敲除影响了菌体的生长。
由图4b可知,两种菌以4.0%葡萄糖为底物时,发酵液中的葡萄糖最后都未完全消耗完,E.coli BL21的葡萄糖消耗了85.25%,BL21ΔglmU消耗了77.75%,E.coli BL21的葡萄糖消耗略高于BL21ΔglmU。glmU的敲除对葡萄糖代谢影响不大。
由图4c可知,E.coli BL21发酵10 h时,发酵液中的乙酰氨基葡萄糖含量最高仅为7.2 mg/L,E.coli BL21ΔglmU发酵液中的乙酰氨基葡萄糖最高为发酵18 h时的36.76 mg/L,约为E.coli BL21的5.11倍。从发酵各时间点来看,E.coli BL21 ΔglmU的乙酰氨基葡萄糖产量始终高于E.coli BL21。
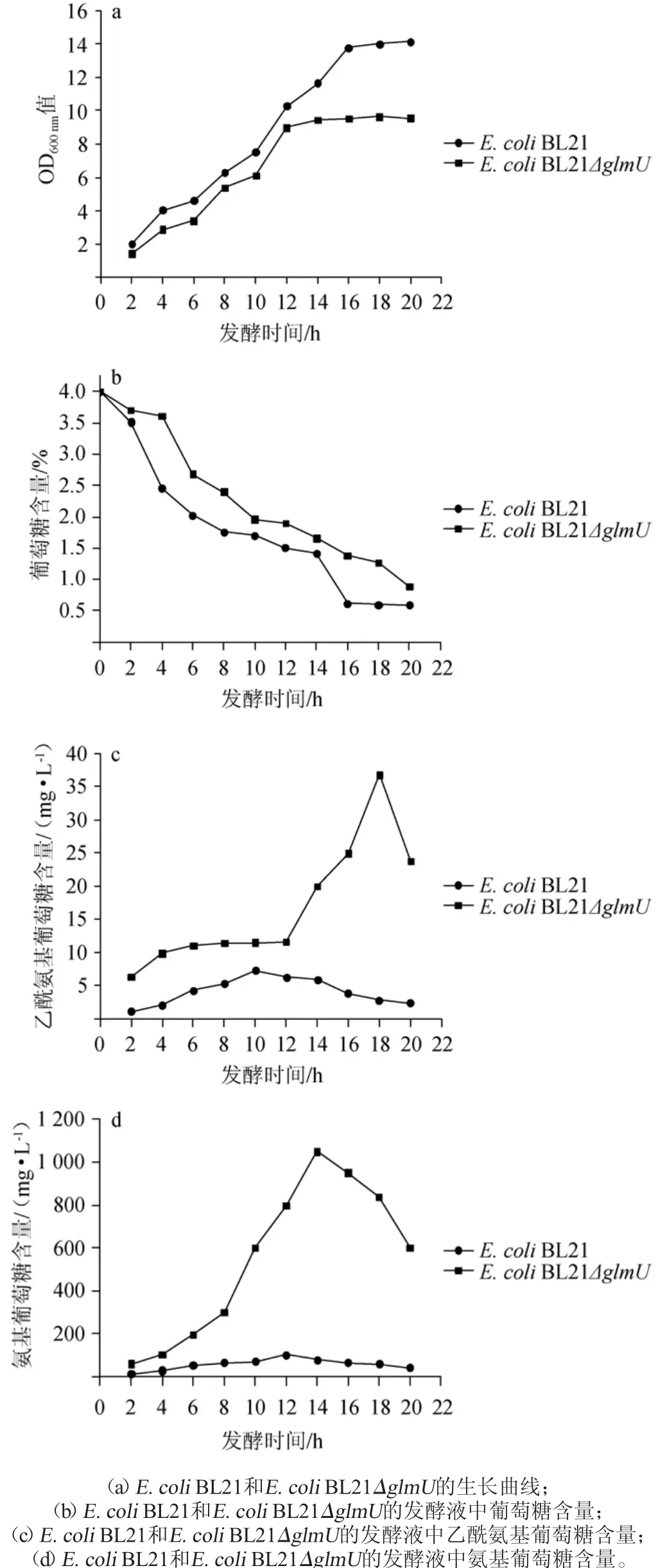
图4 E.coli BL21和E.coli BL21ΔglmU发酵结果对比Fig.4 Comparison of fermentation results of E.coli BL21 and E.coli BL21ΔglmU
由图4d可知,发酵至14 h时,E.coli BL21ΔglmU的发酵液中的氨基葡萄糖积累量达到最高值1049.6mg/L,发酵至12 h时,E.coli BL21的发酵液中的氨基葡萄糖积累量达到最高值103.34 mg/L。从发酵过程来看,E.coli BL21ΔglmU的氨基葡萄糖产量明显增多,是E.coli BL21的10.2倍,表明glmU是氨基葡萄糖代谢的关键基因。
3 结论
利用PCR扩增技术获取glmUⅠ同源臂和抗性基因ampR,利用重叠延伸PCR将两者连接组成glmUⅠ-ampR,将其整合到基因组上,完成葡糖胺-1-磷酸乙酰转移酶结构域部分的敲除。若glmU基因完全敲除则使细胞壁裂解,但敲除葡糖胺-1-磷酸乙酰转移酶结构域部分使双功能酶glmU功能缺失不会使细胞死亡。因此,在生长初期,重组菌的生长速度略慢于原始菌株,生长稳定期E.coli BL21ΔglmU的OD600nm值为E.coli BL21的67.6%。
本实验首次将双功能glmU的第二结构域敲除阻断了从GlcN-6P到UDP-GlcNAc的代谢途径,积累了GlcN-6P,更多的GlcN-6P向胞外转运并脱磷酸,因此发酵液中的氨基葡萄糖多于E.coli BL21。初步发酵研究以葡萄糖为底物发酵生产氨基葡萄糖时重组菌株E.coli BL21ΔglmU氨基葡萄糖产量为1 049.6 mg/L,是E.coli BL21的10.2倍。在此之前,已有许多有关氨基葡萄糖代谢控制的其他基因的研究,如葡萄糖胺-6-磷酸合成酶(glucosamine-6-phosphatesynthase,GlmS)是各种物种生物合成氨基葡萄糖的关键酶,其谷氨酰胺酶结构域催化谷氨酰胺向谷氨酸的转化并释放出氨[23],将E.coli的乙酰氨基葡萄糖磷酸转运子编码基因nagE和甘露糖磷酸转运子编码基因manX敲除,阻断胞外GlcN向胞内的转运[24]。一系列基因水平的改造[25]提高了氨基葡萄糖产量,本实验为生产氨基葡萄糖的碳代谢途径改造提供了新思路,对氨基葡萄糖代谢通路上的关键基因的研究做了实验补充。
参考文献:
[1]XING R,LIU S,GUO Z,et al.The antioxidant activity of glucosamine hydrochloride in vitro[J].Bioorg Med Chem,2006,14(6):1706-1709.
[2]SANTHOSH S,MATHEWPT.Preparation and propertiesof glucosamine and carboxymethylchitin from shrimp shell[J].J Appl Polym Sci,2008,107(1):280-285.
[3]MCALINDON T E,LA V M P,FELSON D T.Efficacy of glucosamine and chondroitin for treatment of osteoarthritis[J].Jama,2000,283(11):1469-1475.
[4]RICHY F,BRUYEREO,ETHGEN O,et al.Structural and symptomatic efficacy of glucosamineand chondroitin in knee osteoarthritis:acomprehensivemeta-analysis[J].Arch Int Med,2003,163(13):1514-1522.
[5]SASHIWA H,FUJISHIMA S,YAMANON,et al.Production of N-acetyl-D-glucosaminefromα-chitin by crudeenzymesfrom Aeromonashydrophila H-2330[J].Carbohyd Res,2002,337(8):761-763.
[6]DENGM D,WASSINK SL,GRUND A D.Engineering a new pathway for N-acetylglucosamine production:Coupling a catabolic enzyme,glucosamine-6-phosphatedeaminase,with abiosynthetic enzyme,glucosamine-6-phosphate N-acetyltransferase[J].Enzyme Microb Technol,2006,39(4):828-834.
[7]MOJARRAD J S,NEMATI M,VALIZADEH H,et al.Preparation of glucosaminefrom exoskeleton of shrimp and predicting production yield by response surface methodology[J].J Agr Food Chem,2007,55(6):2246-2250.
[8]KUK JH,JUNG W J,JO G H,et al.Production of N-acetyl-beta-D-glucosamine from chitin by Aeromonas sp.GJ-18 crude enzyme[J].Appl Microb Biot,2005,68(3):384-389.
[9]陈 欣.代谢工程改造大肠杆菌发酵生产氨基葡萄糖及过程优化与控制[D].无锡:江南大学,2012.
[10]CHEN X,LIU L,LI J,et al.Improved glucosamine and N-acetylglucosamine production by an engineered Escherichia coli via step-wise regulation of dissolved oxygen level[J].Bioresour Technol,2012,110:534-538.
[11]CHENX,LIU L,LIJ,et al.Optimization of glucosefeeding approaches for enhanced glucosamine and N-acetylglucosamine production by an engineered Escherichia coli[J].J Ind Microbiol Biotechnol,2012,39:359-365.
[12]ZHANG J,LIU L,LIJ,et al.Enhanced glucosamine production by Aspergillus sp.BCRC 31742 based on thetime-variant kineticsanalysisof dissolved oxygen level[J].Bioresource Technol,2012,111(5):507-511.
[13]SITANGGANG A B,WU H S,WANG SS,et al.Effect of pellet size and stimulating factor on theglucosamine production using Aspergillus sp.BCRC 31742[J].Bioresource Technol,2010,101(10):3595-3601.
[14]GEHRINGA M,LEESW J,MINDIOLA D J,et al.Acetyltransfer precedes uridylyltransfer in the formation of UDP-N-acetylglucosamine in separable active sites of the bifunctional GlmU protein of Escherichia coli[J].Biochemistry,1996,35:579-585.
[15]RASHMIS,CHITRA R,RUKMANKESH M,et al.Identification and characterization of novel small molecule inhibitors of the acetyltransferase activity of Escherichia coli N-acetylglucosamine-1-phosphateuridyltransferase/glucosamine-1-phosphate-acetyltransferase(GlmU)[J].Appl Microbiol Biot,2016,100(7):3071-3085.
[16]MEHRA R,SHARMA R.Identification and optimization of Escherichia coli GlmU inhibitors:an in silico approach with validation thereof[J].Eur J Med Chem,2015,92:78-90.
[17]WANG S S,FU X,LIU Y P,et al.Probing the roles of conserved residues in uridyltransferase domain of Escherichia coli K12 GlmU by site-directed mutagenesis[J].Carbohyd Res,2015,413:70-74.
[18]赵庆萱,石乐琴,王春晖.不同纯化方法处理DNA合成引物对PCR扩增效率的影响[J].生物学免疫学进展,1997,25(3):65-67.
[19]朱森康,黄 磊,李燕飞,等.制备高效大肠杆菌电转化感受态细胞和电转化条件的研究[J].生物技术通报,2011,37(10):206-209.
[20]张惟杰,李玲如.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999:18-20.
[21]刘兆巍,薛亚平,郑裕国.重组大肠杆菌发酵过程中乙酸的控制[J].发酵科技通讯,2014,43(2):21-26.
[22]李 民,陈常庆.重组大肠杆菌高密度发酵研究进展[J].中国生物工程杂志,2000,20(2):26-31.
[23]WEIWL,GERALD M,JAMESWG.Computational insightsinto substrate binding and catalytic mechanism of the glutaminase domain of glucosamine-6-phosphate synthase(GlmS)[J].RSC Adv,2017,7(47):29626-29638.
[24]陈 欣,刘 龙,李江华,等.Red同源重组敲除nagE和manX对大肠杆菌发酵生产氨基葡萄糖的影响[J].生物工程学报,2012,28(3):305-319.
[25]刘佃磊,李丕武,李瑞瑞,等.高产氨基葡萄糖基因工程菌的研究进展[J].生物技术通报,2014,40(3):36-41.

