血清CGB和GnRH1 mRNA表达与妊娠滋养细胞肿瘤血行转移的相关性研究
李莉,李涛
(西南医科大学附属医院 肿瘤科,四川 泸州 646000)
妊娠滋养细胞疾病(gestational trophoblastic disease,GTD)是一组来源于胚胎滋养细胞的疾病,根据组织学将其分为葡萄胎(hydatidiform mole,HM)、侵蚀性葡萄胎(invasive mole,IM)、妊娠性绒毛膜癌(gestational choriocarcinoma,GCC)及胎盘部位滋养细胞肿瘤[1]。而侵蚀性葡萄胎、妊娠性绒毛膜癌和胎盘部位滋养细胞肿瘤又统称为妊娠滋养细胞肿瘤(gestational trophoblastic neoplasia,GTN)。GTN可继发于葡萄胎、流产、异位妊娠及足月产等,其中约60%来源于葡萄胎[2]。一些肿瘤细胞拥有能力穿透血管壁,在血液中循环,达到身体的其他领域。这些循环肿瘤细胞(circulating tumor cell,CTC)是血行转移和肿瘤进展的重要原因之一[3]。因此检测患者外周血循环肿瘤细胞可能对评估GTN早期血行转移、检测治疗和预后起重要作用。
人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)是由α和β 2条多肽链通过非共价键结合,β亚基决定其免疫特性[4],人绒毛膜促性腺激素β亚基(human chorionic gonadotropin beta subunit,CGB)作为妊娠滋养细胞肿瘤标志物之一,长期被用于GTN的诊断、疗效评估和随访。人类促性腺激素释放激素(gonadotropin releasing hormone,GnRH)是由下丘脑分泌的十肽激素,在性成熟和生殖繁育能力方面起重要作用。人体中存在2种亚型GnRH1和GnRH2,在卵巢癌、子宫内膜癌、乳腺癌和前列腺癌中GnRH1表达水平升高[5],并且已证明GnRH1的受体激动剂可以抑制卵巢癌和子宫内膜癌的增殖,促进细胞凋亡[6]。有研究表明在子宫内膜癌和子宫内膜非典型增生时CGB的表达增加同时伴有GnRH1表达增加[7]。
本研究通过采用逆转录聚合酶链反应(transcription-polymerase chain reaction,RT-PCR)检测GTN患者血清CGB和GnRH1 mRNA表达情况,探讨其表达与肿瘤转移的相互关系,寻找诊断GTN患者早期血行转移的可能标志物。
1 资料与方法
1.1 研究对象
选取2014年1月-2015年6月西南医科大学附属医院、四川省遂宁市射洪县人民医院和四川省肿瘤医院3所医院肿瘤科门诊确诊的GTN患者52例(GTN组)和HM患者21例(HM组),同期体检正常妊娠妇女20例(正常妊娠组)和非妊娠妇女20例(非妊娠组)的基本临床资料及外周血5 ml。52例GTN患者,年龄16~42岁,平均(29.7±0.31)岁;末次妊娠为葡萄胎者41例(78.8%),流产9例(17.3%),异位妊娠1例(1.9%),足月产1例(1.9%)。
1.1.1 GTN组 纳入标准:①初诊的妊娠性绒毛膜癌、侵蚀性葡萄胎或中间型滋养细胞肿瘤患者;②经B超、影像学或病理学诊断确诊。排除标准:①已接受药物或手术治疗的GTN患者;②不能配合研究抽取外周血的患者;③非妊娠性绒毛膜癌患者;④其他肿瘤病史者。
1.1.2 HM组 纳入标准:初诊经B超、影像学或病理学确诊的葡萄胎患者。排除标准:已接受过药物或手术治疗;其他肿瘤病史者。
1.1.3 正常妊娠组 纳入标准:经血β-HCG和B超确诊的孕8~12周正常妊娠妇女。排除标准:既往有葡萄胎病史;既往有其他肿瘤病史。
1.2 GTN的诊断及FIGO分期
根据患者妊娠后(包括葡萄胎组织排空以后或流产、异位妊娠及足月产后)出现的相应症状和体征(如阴道流血,肺转移等),结合患者的血清HCG水平,GTN的诊断可以确定,影像学和组织学检测对诊断是非必须的。FIGO分期:所有患者依据国际妇产科协会(the International Federation of Gynecology and Obstetrics,FIGO)2002年颁布的新的标准进行分期及预后评分[8-9],0~6分为低危,≥7分为高危。
1.3 总RNA提取及RT-PCR
RNA提取试剂盒RNAfast 200购自上海飞捷生物科技有限公司,RT-PCR试剂盒[Prime Script™ RT reagent Kit(Perfect Real Time)]及 real-time PCR 试剂盒[SYBR®Premix Ex Taq™Ⅱ(Tli RNaseH Plus)]均购自宝生物工程(大连)有限公司。CGB引物(正向5'-AGCCAAAGACCGCTACG-3';反向5'-TG AGGGGACAAGCTACCG-3’),GnRH1引物(正向5'-GACCTGAAAGGACTCTGGA-3';反向 5'-CTTCTGGCC CAATGGATTTA-3')[10]均由上海吉玛生物科技有限公司合成。按RNAfast 200说明书分别提取血液中总RNA,经紫外分光光度计检测,OD260/OD280者为合格样品。取500 ng总RNA为模板,按RT-PCR试剂盒说明书配制逆转录反应体系,RNA水平使用2-∆∆Ct方法相对定量。
1.4 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料符合正态分布采用均数±标准差(±s)表示,采用Kruskal-WallisH检验,组间两两比较使用q检验,计数资料采用例表示,采用χ2检验或Fisher确切概率法,P<0.05为差异有统计学意义。
2 结果
2.1 GTN组、HM组、正常妊娠组及非妊娠组血清CGB和GnRH1 mRNA表达情况
各组CGB mRNA、GnRH1 mRNA RT-PCR典型条带图见图1、2。20例非妊娠组血清中CGB mRNA阴性,GnRH1 mRNA表达较少;20例正常妊娠组CGB mRNA和GAPDH mRNA 较少量表达;21例HM组和52例GTN组CGB mRNA和GAPDH mRNA表达均有所升高。4组患者血清CGB mRNA表达水平差异有统计学意义(H=9.748,P=0.005),说明4组血液中CGB mRNA表达水平不同,GTN组血清中CGB mRNA水平高于其余3组。4组血清GnRH1 mRNA表达水平差异有统计学意义(H=6.522,P=0.018),说明4组血液中GnRH1 mRNA表达水平不同,GTN组血清中GnRH1 mRNA水平升高,见表1。
2.2 GTN组血清CGB mRNA表达与临床指标的关系
根据临床指标中年龄、前次妊娠、最大肿瘤大小、远处转移、转移灶数目、临床分期、预后评分等因素分组。分别比较不同组中血清CGB mRNA表达情况。其中CGB mRNA表达与年龄、前次妊娠、最大肿瘤大小无关(P>0.05);与远处转移、转移灶数目、临床分期、FIGO预后相关(P<0.05)。见表2。
2.3 GTN组血清GnRH1 mRNA表达与临床指标的关系
根据临床指标中年龄、前次妊娠、最大肿瘤大小、远处转移、转移灶数目、临床分期、预后评分等因素分组。分别比较不同分组中血清GnRH1 mRNA表达情况。其中GnRH1 mRNA表达与年龄、前次妊娠、最大肿瘤大小、转移灶数目无关(P>0.05);与远处转移、临床分期、FIGO预后相关(P<0.05)。见表3。
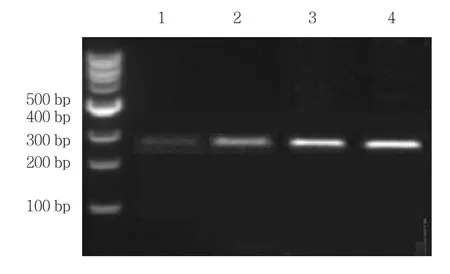
图1 GnRH1 mRNA RT-PCR条带图
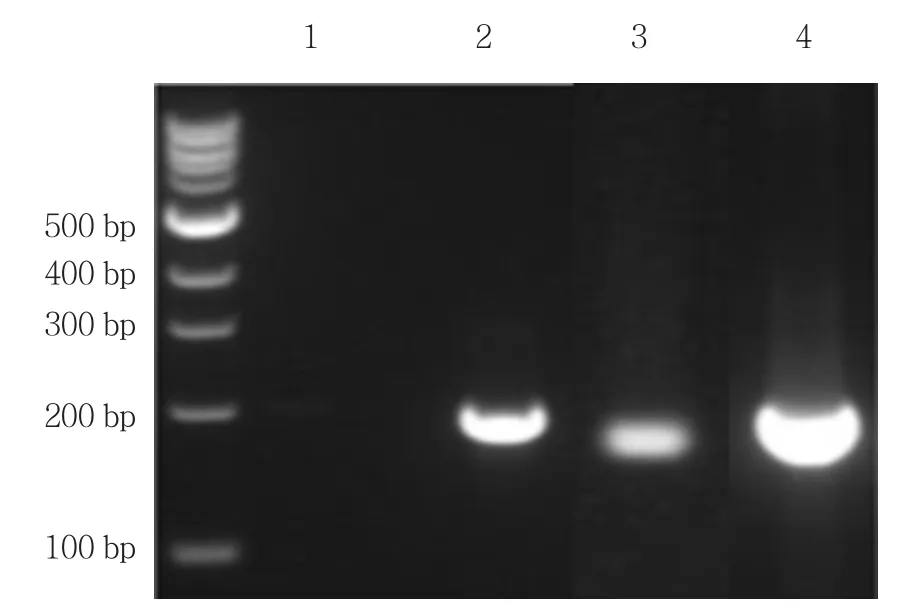
图2 CGB mRNA RT-PCR条带图

表1 各组血清CGB和GnRH1 mRNA表达情况
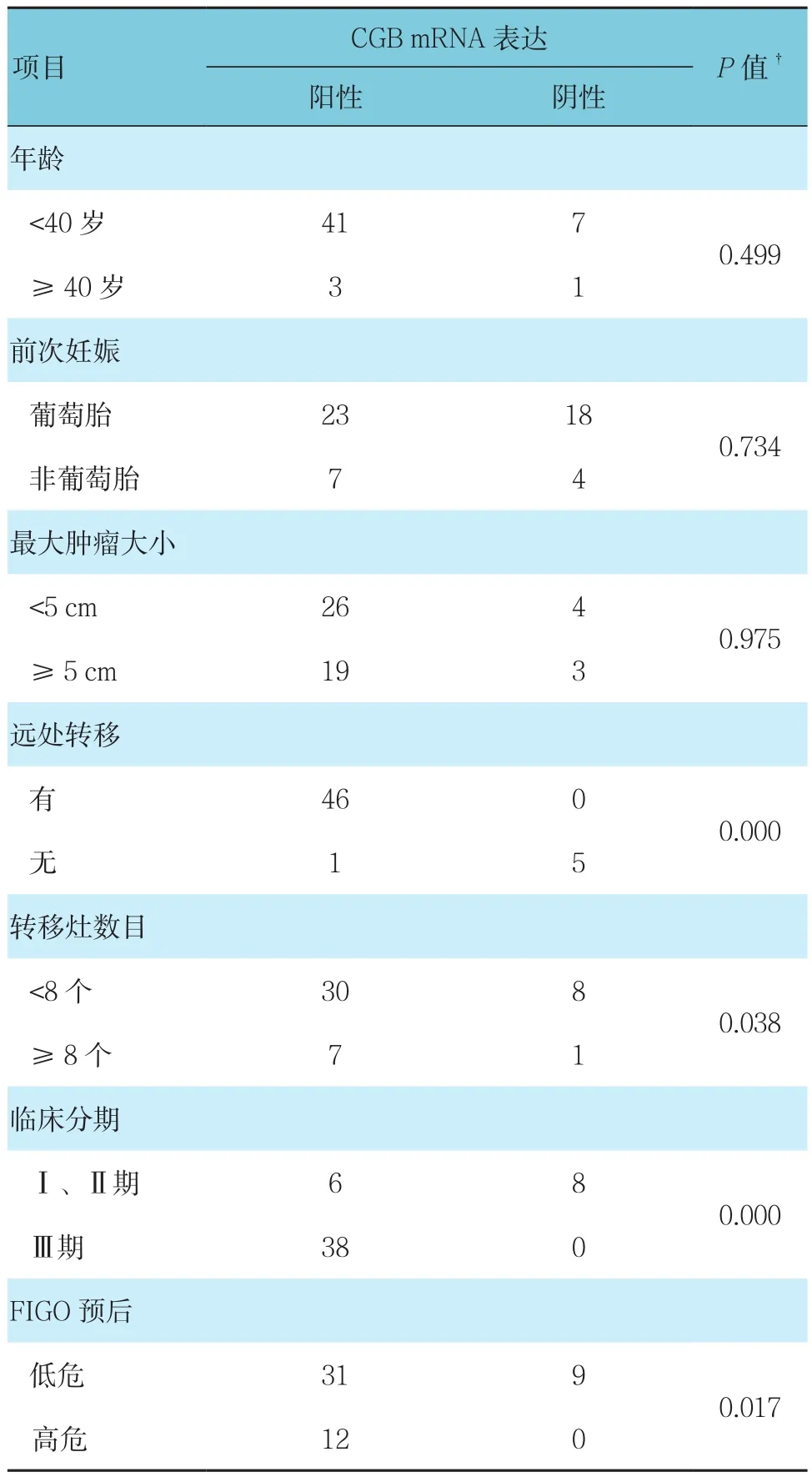
表2 GTN组血清CGB mRNA表达与临床指标的关系
3 讨论
GTN是胚胎的滋养细胞发生恶变而形成的肿瘤,包括中间型滋养细胞肿瘤、侵蚀性葡萄胎和妊娠性绒毛膜癌。妊娠滋养细胞肿瘤患者死亡的重要原因多数是发生远处转移,如肺转移、肝转移、脑转移等。一些肿瘤细胞拥有能力穿透血管壁,在血液中循环,到达身体的其他领域。CTC反映了肿瘤的侵犯,因此早期发现血液中的CTC,对于患者预后判断、疗效评价和个体化治疗都有着重要的指导作用。GTN是胚胎的滋养细胞发生恶变,因此外周血中检测恶变的细胞滋养细胞和合体滋养细胞,有助于早期发现肿瘤血行转移。目前,直接检测肿瘤细胞技术较为复杂,检测周期较长,临床推广困难,因此检测外周血中循环肿瘤细胞的重要任务是寻找其特异性标志物。国外对于检测妊娠滋养细胞肿瘤外周血循环肿瘤细胞的相关研究报道较多,而针对国人的报道则较少[11-12],本研究纳入4组不同人群,收集临床资料和外周血,使用RTPCR检测各组患者血清CGB和GnRH1 mRNA表达情况,分析其与妊娠滋养细胞肿瘤早期转移等临床参数的关系,探究其与妊娠滋养细胞肿瘤血行转移的相互关系。
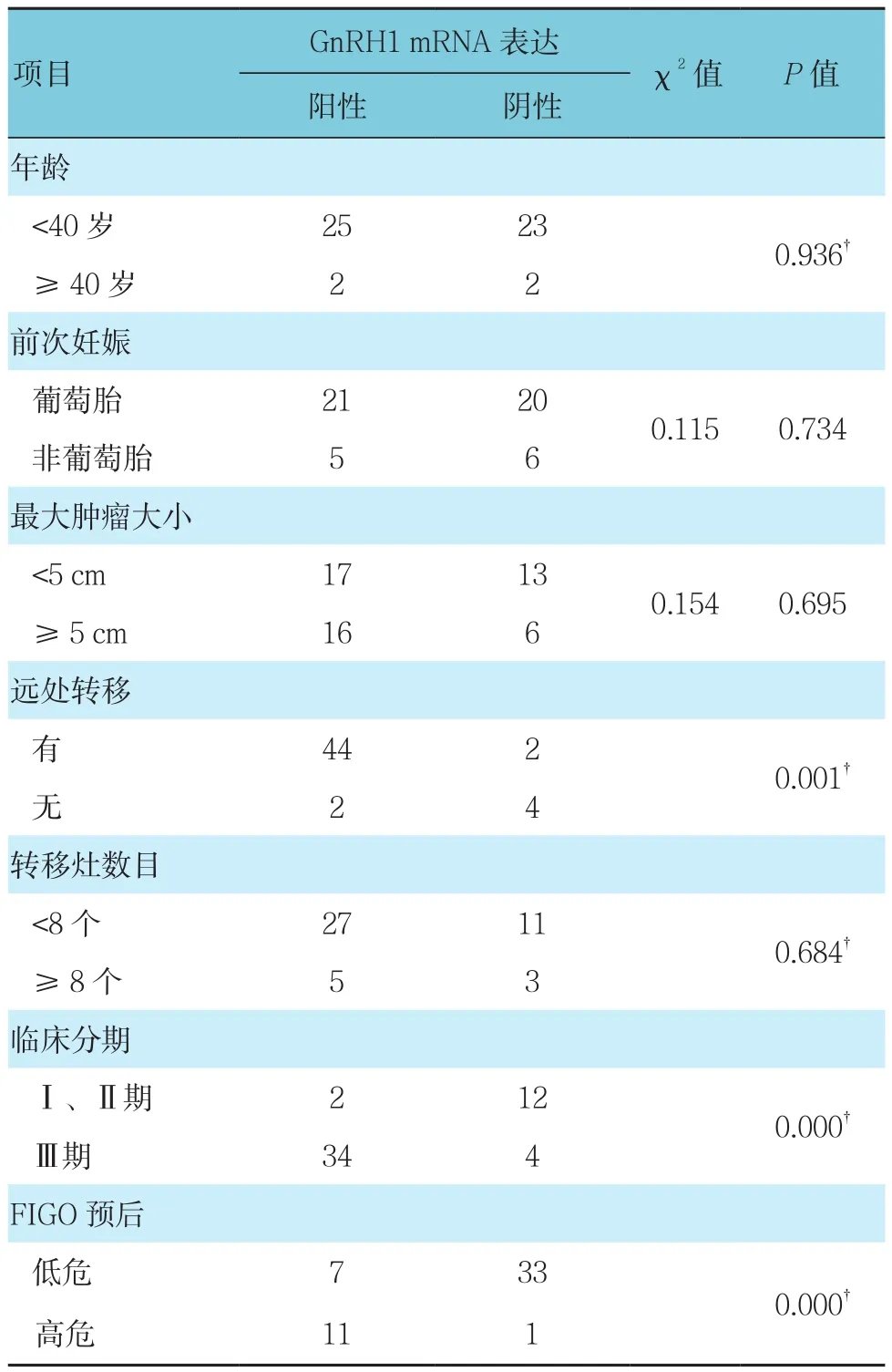
表3 GTN组血清GnRH1 mRNA表达与临床指标的关系
CGB是有胎盘合体滋养细胞分泌的一种糖蛋白。本研究显示非妊娠组外周血中无CGB mRNA表达,GTN组外周血中CGB mRNA表达水平高于HM组、正常妊娠组。GTN组外周血中GnRH1 mRNA表达水平高于HM组、正常妊娠组和非妊娠组。提示CGB和GnRH1表达可能作为妊娠滋养细胞肿瘤检测的标志物之一。
本研究显示,GTN组外周血CGB mRNA 表达阳性与年龄、前次妊娠、最大肿瘤大小无关;与远处转移、转移灶数目、临床分期、FIGO预后相关。GnRH1 mRNA表达阳性与年龄、前次妊娠、最大肿瘤大小、转移灶数目无关;与远处转移、临床分期和FIGO预后相关。CGB mRNA和GnRH1 mRNA表达阳性有远处转移组患者高于无远处转移组,临床分期Ⅲ组高于临床分期Ⅰ、Ⅱ组,FIGO高危组高于FIGO低危组,这些均提示外周血CGB mRNA和GnRH1 mRNA表达与转移相关临床指标相关,因此CGB和GnRH1可能成为评估妊娠滋养细胞肿瘤早期血行转移的有效评价指标。
参 考 文 献:
[1] SANTORO G, LAGANÀ A S, MICALI A, et al. Historical,morphological and clinical overview of placental site trophoblastic tumors: from bench to bedside[J]. Archives of Gynecology and Obstetrics, 2017, 295(1): 173.
[2] 朱晓旭, 钱建华, 掌佩文, 等. 不同HCG水平妊娠滋养细胞肿瘤的临床特征和治疗分析[J]. 浙江医学, 2016, 38(9): 611-613.
[3] GERGES N, RAK J, JABADO N. New technologies for the detection of circulating tumour cells[J]. British Medical Bulletin,2010, 94(1): 49-64.
[4] COHEN L, BOUSFIELD G R, BEN-MENAHEM D. The recombinant equine LHβ subunit combines divergent intracellular traits of human LHβ and CGβ subunits[J]. Theriogenology, 2015,83(9): 1469-1476.
[5] HUANG P P, BRUSMAN L E, IYER A K, et al. A novel gonadotropin-releasing Hormone 1 (Gnrh1) enhancer-derived noncoding RNA regulates Gnrh1 gene expression in GnRH neuronal cell models[J]. PLoS One, 2016, 11(7): eo158597.
[6] FAN L, SHIEKHATTAR R. Enhancer RNAs: the new molecules of transcription[J]. Current Opinion in Genetics & Development,2014, 25(4): 38-42.
[7] PNUELI L, RUDNIZKY S, YOSEFZON Y, et al. RNA transcribed from a distal enhancer is required for activating the chromatin at the promoter of the gonadotropin α-subunit gene[J]. Proceedings of the National Academy of Sciences, 2015, 112(14): 4369-4374.
[8] COMMITTEE F O. FIGO staging for gestational trophoblastic neoplasia 2000. FIGO Oncology Committee[J]. International Journal of Gynecology & Obstetrics, 2002, 77(3): 285-287.
[9] 雷呈志, 向阳, 万希润, 等. 足月产后绒毛膜癌患者的临床特征与预后分析[J]. 中华妇产科杂志, 2006, 41(11): 752-755.
[10] MIROSŁAW A. CGB and GNRH1 expression analysis as a method of tumor cells metastatic spread detection in patients with gynecological malignances[J]. Journal of Translational Medicine,2011, 9(1): 1-9.
[11] SUZUKA K, MATSUI H, IITSUKA Y, et al. Detection of betasubunit human chorionic gonadotropin mRNA in the peripheral blood of patients with nonmetastatic gestational trophoblastic disease[J]. Gynecologic Oncology, 2002, 86(1): 53-56.
[12] 朱建春. 妊娠滋养细胞肿瘤外周血肿瘤细胞检测方法的临床研究[J]. 医药论坛杂志, 2011, 13(21): 98-100.

