活血生肌汤联合外周血干细胞移植干预大鼠糖尿病足溃疡模型的研究*
何雄文,牛美兰
(1.河南省中医药研究院附属医院,河南 郑州 450004; 2.黄河科技学院,河南 郑州 450063)
糖尿病足溃疡是指未出现周围神经病变和周围血管病变的初期糖尿病患者足部感染如甲沟炎、脚气感染等所造成的足部感染、化脓、溃烂等。目前,干细胞移植治疗下肢缺血已得到认可。移植后的干细胞在体内分化为平滑肌细胞和血管内皮细胞,促进血管生成因子分泌。将干细胞移植到缺血下肢,其分化形成新生毛细血管,可增加下肢血流量,达到治疗下肢缺血的目的[1-2]。 活血生肌汤是针对糖尿病气阴两虚、瘀血阻络病证研制的复方制剂,具有活血通络、解痉止痛的功效。方剂中的红花、丹参、乳香、赤芍、川芎、党参、生黄芪等可活血祛瘀、调气止痛、消肿生肌,对糖尿病微血管病有治疗作用。本研究观察了活血生肌汤联合外周血干细胞移植对大鼠糖尿病足溃疡模型新生血管形成及创面愈合的影响。
1 材料与方法
1.1 动 物
取健康清洁级雄性SD大鼠80只,体质量110~140 g大鼠,购自山东省鲁抗医药集团有限公司,许可证编号(SCXK鲁2015004),存放在黄河科技学院动物房,光照12 h/d,温度20~23 ℃,相对湿度40%~60%。
1.2 药品、试剂与仪器
活血生肌汤处方组成:红花6 g,丹参 12 g,生黄芪 6 g,乳香 23 g,党参 14 g,川芎6 g,赤芍14 g,大黄7 g,黄柏2 g,生地黄7 g。药液由河南省中医药研究院附属医院中药制剂室提供,含生药量1.25 g/mL。羧甲基纤维素钠(CMC-Na),天津市永大化学试剂有限公司产品,批号20140110;链脲佐菌素(STZ),Amresco公司产品,批号1262C443; 兔抗大鼠CD34、CD44、CD38多克隆抗体,北京义翘神州科技有限公司产品,型号80262-R02H、53953-M08H、65003-T08H; DAPI 4’,6-联脒-2-苯基吲哚二盐酸盐,武汉博士德公司产品,批号40727ES10;Anti-CD34 /FITC荧光素标记,上海浩然生物技术有限公司产品,货号bsF-0646R;重组人粒细胞集落刺激因子(G-CSF),成都蓉生药业有限责任公司产品,批号S20013036;大鼠血管内皮细胞生长因子C(VEGF-C)ELISA检测试剂盒,上海酶联生物科技有限公司产品,货号ml002952;Trizol总 RNA提取试剂,上海翊圣生物科技有限公司产品,货号10606ES60;兔抗大鼠CD34-抗Abnova免疫组化试剂盒,北京中杉金桥生物技术有限公司产品,货号PAB 18289;DAB试剂盒,北京索莱宝科技有限公司产品,货号DA1010;高脂饲料、柠檬酸钠缓冲液、三羟甲基氨基甲烷缓冲液,由黄河科技学院实验中心供应;羟乙基淀粉550,上海易佰聚经贸有限公司产品,货号HES-TBD550。RPM1640 Medium ①Nissui日水培养基、德国Sigma 3K15高速(冷冻)离心机,购自北京五洲东方科技发展有限公司; EPICS XL II型流式细胞仪,美国Beckman Coulter公司产品。
1.3 模型的建立
将健康清洁级雄性SD大鼠80只以高脂饲料喂养4周,禁食12 h,按45 μg/g体质量腹腔注射STZ,3 d后测空腹血糖。空腹血糖≥17.9 mmol/L为糖尿病模型成功。第2天用液氮棉签冷冻大鼠右后肢距离髂棘外侧0.5 cm处约20 s,共冷冻3次。一次冷冻后待皮肤复温后再行下次冷冻。冷冻后第2天局部充血水肿范围扩大;第3天水肿范围局限化,皮肤颜色变暗红色,第5天形成溃疡。选取Wagner[3]分级3级的动物入实验组。
1.4 动物分组与给药
1.4.1 外周血干细胞的制备
40只实验大鼠,皮下注射G-CSF 500 ng/g,1次/d,连续5 d,给药期间皮下注射肝素抗凝4 100 u/kg,1次/d。以质量分数200 g/L的 乌拉坦0.3 μL/g体质量腹腔麻醉,腹主动脉采血,采用密度梯度法离心外周血单核细胞:将细胞悬液在300 g离心力下离心10 min,吸取上层单核细胞层,加入2倍缓冲液;200 g离心力下离心15 min,完全吸去上清;用80 μL的缓冲液/107个细胞重新悬浮细胞,加入CD38、CD34、CD44微珠每20 μL/7.8×107个细胞,混匀;在4~8 ℃孵育15 min;加入1~2 mL/107个细胞缓冲液洗涤细胞,在300 g离心力下离心10 min;完全弃掉上清,加入0.5 mL缓冲液悬浮细胞进入磁性筛选。分选细胞前用0.5 mL缓冲液冲洗柱子,将细胞悬液加到柱子中,用适量缓冲液3次冲洗柱子,每次都要抽空柱池,将分选柱与分选磁铁分离,放在收集管中;向柱子中加入0.5 mL缓冲液,分选柱塞快速推下,收集得到干细胞。加入无菌的DAPI溶液0.1 mL染色,避光,室温下静止15 min,加入2倍缓冲液,在200 g离心力下离心15 min ,丢弃上清部分。RPM1640培养基上稀释4 mL [干细胞浓度(0.5~2.0)×106/mL],在冰上保存并计数细胞数。在紫外波长下发蓝色荧光为标记细胞的细胞核,收集干细胞,以备移植。
1.4.2 分组与给药
将造模成功的60只大鼠随机分为模型对照组、外周血干细胞组、活血生肌汤+外周血干细胞组,每组20只。活血生肌汤+外周血干细胞组以活血生肌汤 0.8 g/kg灌胃,给药体积为10 μL/(g·d),2次/d。外周血干细胞组、活血生肌汤+外周血干细胞组在距离足溃疡1 mm边缘等距4个位点处,一次性皮下内膜层注射0.1 mL细胞悬液于小腿肌肉内,进针深度1 cm,两注射位点间距0.5 mm,每个位点注射0.1 mL细胞悬液。 模型对照组、外周血干细胞组灌服等体积的质量分数为5 g/L 的羧甲基纤维素钠(CMC-Na)溶液。各组连续灌胃30 d。
1.5 检测指标
1.5.1 VEGF水平
实验结束,禁食12 h后腹主动脉取血,4 ℃静置1 h, 3 000 r/min转速下离心20 min,取上清分别装于EP管,置于20 ℃冷冻保存。采用ELISA法检测血清VEGF水平,操作严格按照试剂盒说明书进行。设立标准品的检测浓度,以酶标仪自动拟合标准曲线,检测待测孔的OD值。
1.5.2 局部溃疡VEGF mRNA表达
采用实时荧光定量反转录PCR检测方法,操作严格按照说明书进行。
1.5.3 免疫组织化学检测CD34的表达
采用SP免疫组织化学染色方法 ,操作严格按照说明书进行。
1.5.4 溃疡局部组织CD34、CD44、CD38蛋白表达
采用免疫蛋白印记法检测方法,操作严格按照说明书进行。
1.5.5 溃疡面愈合
采用免疫组化检查溃疡面愈合情况
1.6 统计学方法
2 结 果
外周血干细胞组、活血生肌汤+外周血干细胞组大鼠因灌胃操作不当各死亡1只。
2.1 各组大鼠血清VEGF、溃疡局部组织中VEGF mRNA表达对比
与模型对照组对比,外周血干细胞组血清VEGF水平、溃疡局部组织中VEGF mRNA表达不明显(P>0.05);活血生肌汤+外周血干细胞组的血清VEGF水平、溃疡局部组织中VEGF mRNA表达均增加,差别有统计学意义(P<0.01)。与外周血干细胞组对比,活血生肌汤+外周血干细胞组血清VEGF水平增加(P<0.05)、溃疡局部组织VEGFmRNA表达显著增加(P<0.01)。见表1。
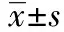

组别n血清VEGF溃疡局部组织中VEGFmRNA模型对照组2027.42±3.540.27±0.04外周血干细胞组1932.43±1.0∗0.38±0.09∗活血生肌汤+外周血干细胞组1954.06±7.61∗∗∗##0.68±0.12∗∗∗###
注:与模型对照组对比,*P>0.05,***P<0.01;与外周血干细胞组对比,##P<0.05,###P<0.01
2.2 各组大鼠溃疡局部组织CD34、CD44、CD38蛋白表达对比
与模型对照组对比,外周血干细胞组的CD44表达变化不明显,差别无统计学意义(P>0.05),CD34、CD38表达升高,差别有统计学意义(P<0.05);活血生肌汤+外周血干细胞组局部溃疡组织CD34、CD44、CD38表达升高(P<0.01)。与外周血干细胞组对比,活血生肌汤+外周血干细胞移植组CD34、CD44、CD38表达升高,差别有统计学意义(P<0.05)。见表2。
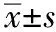

组别nCD34CD44CD38模型对照组200.38±0.200.24±0.020.31±0.01外周血干细胞组190.83±0.01∗∗0.29±0.01∗0.46±0.01∗∗活血生肌汤+外周血干细胞组191.00±0.08∗∗∗##0.66±0.04∗∗∗##0.79±0.08∗∗∗##
注:与模型对照组对比,*P>0.05,**P<0.05,***P<0.01;与外周血干细胞组对比, ##P<0.05
2.3 各组大鼠溃疡面愈合对比
各组溃疡面长径、短径均较治疗前缩小。与模型对照组对比,外周血干细胞组、活血生肌汤+外周血干细胞组溃疡面的长径、短径均缩小,差别有统计学意义(P<0.05或P<0.01)。与外周血干细胞组对比,活血生肌汤+外周血干细胞组溃疡面的长径、短径均缩小,差别有统计学意义(P<0.01)。见表3。


组别n治疗前长径短径治疗30d长径短径模型对照组203.72±0.712.63±0.711.14±0.410.82±0.41外周血干细胞组193.41±0.822.43±0.420.84±0.23∗∗∗0.61±0.16∗∗活血生肌汤+外周血干细胞组193.68±0.922.73±0.620.14±0.12∗∗∗###0.11±0.10∗∗∗###
注:治疗30 d后,与模型对照组对比,**P<0.05,***P<0.01;与外周血干细胞组对比, ###P<0.01
3 讨 论
目前认为糖尿病足发生的3个要素是血管闭塞性缺血、感染和神经病变[4]。本实验采用高脂饲料+低剂量 STZ复制糖尿病模型,然后采用液氮棉签冷冻法复制大鼠糖尿病足溃疡模型是基于:长期高脂可以诱发脂肪、糖代谢紊乱,形成动脉粥样硬化;低剂量STZ损伤胰岛B细胞,加速糖尿病形成;低温液氮棉签冷冻引起下肢局部血流减少,损伤局部组织,导致溃疡形成,诱发炎症反应,可在糖尿病的基础上形成均一的足溃疡[5-6]。干细胞移植治疗糖尿病足溃疡的基础理论是因干细胞具有分化能力,可分化成血管内皮祖细胞和成血管细胞,这些细胞可以促进新生毛细血管形成,从而改善血液供应。移植后的造血干细胞不仅是血液中各种血细胞的原祖细胞,也是血液循环过程中内皮细胞的来源。研究证明干细胞促进血管生成的机制包括:①分化成血管平滑肌细胞和血管内皮细胞;②直接形成新的血管;③通过旁分泌形成Ang-I、Ang-II、VEGF等多种血管生成因子,促进血管新生[7-9]。
本研究结果显示:治疗30 d后,活血生肌汤+外周血干细胞组大鼠血清VEGF和溃疡局部组织中VEGF mRNA表达较模型对照组增加(P<0.01)。与模型对照组比,干细胞组CD44蛋白表达不明显(P>0.05),而CD38、CD34蛋白表达增加(P<0.05);活血生肌汤+外周血干细胞组CD38、CD34、CD44蛋白量表达显著增加(P<0.01)。外周血干细胞组、活血生肌汤+外周血干细胞组大鼠溃疡面较模型对照组缩小(P<0.05或P<0.01)。活血生肌汤联合外周血干细胞移植可显著增加溃疡局部组织中VEGF mRNA表达,增加局部溃疡组织CD38、CD34、CD44蛋白表达,促进新生血管形成及溃疡创面的愈合。
中医学认为:由于瘀阻于四肢脉络,气血不能濡养肌肉筋骨而出现肢体麻疼或肢端坏疽。活血生肌汤是在中医药理论指导下、结合现代药理学研究筛选而成的治疗糖尿病足的中药方剂。方中丹参、红花、赤芍具有活血化瘀、止痛通络作用;乳香善于调气,能活血定痛,消肿生肌;川芎具有祛风、止痛活血行气的功效;生黄芪、党参、生地黄具有养血生津、活血行气止痛作用,其中党参益气养血生津,生黄芪益气固表、利水、排脓生肌、托疮,生地黄滋阴清热;黄柏清热解毒,泻火燥湿;大黄泻火解毒、活血祛瘀。全方共奏通络止痛、活血祛瘀、解毒生肌、益气生津之效。本研究通过灌胃大鼠、调节机体而发挥上述作用,证实了活血生肌汤对干细胞移植治疗糖尿病足具有增强疗效的作用,此与该方具有清热解毒、活血行气止痛通络、祛瘀生新的功效有关,其可促进干细胞移植后血管新生,促进侧支循环的建立,但其作用机制有待深入研究。
[1]高延明,张路.骨髓间充质干细胞移植治疗糖尿病足过程中血管内皮生长因子的表达[J].中国组织工程研究,2013,17(40):7169-7174.
[2]王瑛,但齐琴,王庆萍,等.人脐带间充质干细胞治疗大鼠糖尿病神经性足溃疡的疗效及VEGF表达变化[J].四川大学学报(医学版),2014,45(1):29-33.
[3]张莹,王伟灵,杨沁彤,等. 血清VCAM-1、FGF2等炎症因子与难愈性糖尿病足的相关性研究[J].检验医学,2014,29(5):472-476
[4]万妍,杨燕京,李玉桑,等.三黄生肤油对糖尿病大鼠末梢循环障碍和足溃疡的作用及其机制[J].中华烧伤杂志,2016,32(3):168-175.
[5]BOLTON LL. Quality Randomized Clinical Trials of Topical Diabetic Foot Ulcer Healing Agents[J]. Adv Wound Care (New Rochelle), 2016, 5(3):137-147
[6]SNYDER RJ ,SHIMOZAKI K,TALLIS A,et al. A Prospective, Randomized, Multicenter, Controlled Evaluation of the Use of Dehydrated Amniotic Membrane Allograft Compared to Standard of Care for the Closure of Chronic Diabetic Foot Ulcer[J]. Wounds A Compendium of Clinical Research & Practice, 2016,28(3):70-77
[7]顾萍,王坚. 糖尿病足溃疡内科治疗进展[J].中国全科医学,2009,12(11):1019-1021
[8]段旭东,张雅兰,赵辉,等.清利活血汤配合三黄生肌纱条对糖尿病溃疡大鼠肉芽组织中白介素1、内皮素1及碱性成纤维细胞生长因子含量的影响[J].中国老年学杂志,2013,33(4):839-841.
[9]李友山,杨博华,冀凌云,等.中药“蚓黄散”对大鼠糖尿病溃疡创面形态及促愈因子的影响[J].环球中医药,2016,9(1):10-14.

