人参多糖通过cAMP/PKA/CREB信号通路抗糖尿病肾病肾纤维化作用机制研究
黄 倩,张素萍,施子禄
(1.泉州医学高等专科学校基础医学部生理学教研室,福建 泉州 362100;2.浙江大学基础医学院生理系,浙江 杭州 310058;3.福建医科大学附属泉州第一医院肾内科,福建 泉州 362000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者最常见的微血管并发症之一,一旦出现肾纤维化,治疗相当棘手。DN的主要病理表现为肾小球系膜和肾小管间质出现渐进性的细胞外基质集聚,最终导致肾脏出现不可逆转的纤维化。其中,转化生长因子β(transforming growth factor-β,TGF-β)过度表达与肾纤维化密切相关。近年的研究从多角度、多层次证实了经典TGF-β/Smad信号通路参与肾纤维化的发生、发展[1-2]。然而,TGF-β也能激活丝裂原活化蛋白激酶[3]和蛋白激酶A(protein kinase A,PKA)等其他信号分子,而激活环磷酸腺苷(cyclic adenosine monophosphate,cAMP)/PKA信号通路,可明显诱导细胞中TGF-β1的表达[4]。PKA也称cAMP依赖的蛋白激酶,由2个调节亚基和2个催化亚基构成。cAMP与PKA调节亚基结合可促进催化亚基的活化,有活性的催化亚基直接转位入核,调节某些转录因子的活性,如环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)家族,PKA通过催化CREB磷酸化而启动下游基因的表达,最终调节细胞功能。研究显示[5],PKA信号通路与TGF-β诱导的肾小球硬化密切相关,抑制PKA/CREB信号通路能直接阻断TGF-β1诱导的肾小球硬化。因此,延缓或阻断肾脏细胞外基质过度纤维化是防治肾损害的关键所在,也是肾脏病治疗学的一个重要课题。本研究从阻断cAMP/PKA/CREB信号通路的角度出发,积极开发抑制肾纤维化的DN防治药物可能是一种新思路。
研究发现,中药多糖类化合物如地黄多糖、黄芪多糖对DN具有良好的保护作用,而其发挥药理作用的机制之一正是通过调节机体内多种关键蛋白和基因如TGF-β、PKA等来实现[6-7]。人参PanaxginsengC.A.Mey.作为最古老、最著名的珍贵药材之一,在我国已被广泛应用了数千年,其含有丰富的多糖、皂苷、多肽等化学成分。研究显示[8],人参多糖(ginseng polysaccharides,WGP)具有良好的抗肿瘤、抗氧化、降血糖、调节免疫等多种生物活性[8]。那么,同样含有多糖类成分的WGP是否对DN也具有同样的药理作用,目前国外内尚未见报道。因此,本研究通过构建DN小鼠模型,观察WGP对DN小鼠血糖、肾功能、肾脏病理变化的影响,并对与肾纤维化相关的cAMP/PKA/CREB信号通路中的关键蛋白进行测定,阐明WGP对肾纤维化的防治作用及可能机制,为进一步研发有效的DN防治药物提供可靠的实验依据。
1 材料与方法
1.1实验动物健康成年♂C57BL/6小鼠,8~12周龄,SPF级,体质量23~26 g,购自上海斯莱克实验动物有限公司,实验动物合格证号:SCXK沪2007-0005。标准条件饲养,自由获取食物和水,室温控制在22℃左右,相对湿度为30%~70%。
1.2药物取1 kg人参粉末,按一定比例(1 ∶20)加入双蒸水,充分混匀后,置于100℃恒温水浴箱中水浴2 h,过滤,重复上述步骤3次,得到滤液,并用微波真空干燥器浓缩,所得浓缩液中加入5倍量的无水乙醇,4℃冰箱过夜,用布式漏斗进行抽滤,醇沉3次,所得沉淀物即为人参粗多糖[9]。将多糖粗品配制成10 g·L-1的溶液,按3 ∶1比例加入Sevage试剂(氯仿 ∶正丁醇=4 ∶1),经多次萃取后除去蛋白质,用布氏漏斗抽滤得到多糖沉淀,真空干燥得到WGP,经红外光谱分析法鉴定多糖,紫外光谱测定样品中的WGP纯度达86.1%。
1.3试剂与仪器链脲佐菌素(streptozotocin,STZ,美国Sigma公司,批号 S0130);cAMP放射免疫分析药盒(上海中医药大学同位素室,批号 20070411);α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、层黏连蛋白(laminin,LN)、纤维连接蛋白(fibronectin,FN)、PKA、CREB、p-CREB蛋白抗体(Abcam公司,批号分别为 ab5694、ab11575、ab2413、ab65013、ab7540、ab32096);HRP标记的山羊抗兔IgG抗体(上海碧云天生物技术有限公司,批号 A0208)。UVmini-1240紫外可见分光光度计(日本岛津国际贸易上海有限公司);5810R高速冷冻式离心机(德国Eppendorf公司);XR210全自动生化分析仪(广东中山新锐医疗设备科技有限公司);MDF-U3386S -80 ℃超低温冰箱(日本三洋公司);垂直电泳仪(美国Bio-Rad公司);Tanon 3500全自动数码凝胶成像分析系统(上海天能科技有限公司)。
1.4方法
1.4.1糖尿病模型的建立及动物分组 动物实验在我校实验动物中心动物实验室进行,造模前12 h小鼠禁食不禁水,单次尾静脉注射STZ(120 mg·kg-1)构建糖尿病小鼠模型。72 h后禁食6 h,剪尾取血测空腹血糖(fasting blood-glucose,FBG),FBG≥16.7 mmol·L-1为糖尿病模型成功[10]。随机分为模型组、WGP(25、50、100 mg·kg-1)[11]组,每组10只,另设空白对照组小鼠10只,每天灌胃给药,连续12周。空白对照组和模型组给予等量等体积生理盐水。实验过程中,小鼠自由进食、饮水,不使用胰岛素,12周末无小鼠死亡。
1.4.2空腹血糖、24 h尿微量白蛋白、血清肌酐和尿素氮含量的测定 各组小鼠末次给药后,每只小鼠置于独立代谢笼中,禁食6 h后剪尾取血,采用血糖仪检测FBG;收集24 h尿液,采用全自动生化分析仪测定24 h尿微量白蛋白(microalbuminuria,mAlb)含量;麻醉小鼠,下腔静脉取血,分离血清,采用全自动生化分析仪检测血清肌酐(serum creatinine,Scr)和尿素氮(blood urea nitrogen,BUN)含量。
1.4.3肾脏Masson染色和免疫组织化学染色 取小鼠肾脏进行剥离,部分肾皮质固定,脱水,石蜡包埋,脱蜡,Masson染色进行病理学观察;按免疫组化试剂盒说明书进行肾皮质α-SMA(1 ∶200)染色,经抗原修复、封闭、抗体孵育、DAB显色,光镜下观察肾皮质中α-SMA的分布并进行量化。
1.4.4放射免疫法检测肾皮质cAMP的含量 另切取部分肾皮质,匀浆后,按cAMP放射免疫分析药盒说明书,检测肾皮质cAMP的含量。
1.4.5Western blot法检测肾皮质中LN、FN、PKA、CREB、p-CREB的蛋白表达 取各组小鼠部分肾皮质,按照相应的比例(20 mg组织 ∶200 μL裂解液)加入预冷的裂解液裂解肾皮质,充分裂解后,取上清,采用BCA法进行蛋白定量。十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,电转移至硝酸纤维膜,5%脱脂奶粉室温封闭1 h,洗涤后加入LN抗体(1 ∶1 000)、FN抗体(1 ∶2 000)、PKA抗体(1 ∶1 000)、CREB抗体(1 ∶1 000)、p-CREB抗体(1 ∶5 000),4℃摇床过夜,二抗为HRP标记的山羊抗兔抗体(1 ∶500),室温摇床孵育1 h,采用化学发光ECL显影,以目的蛋白与β-actin的比值作为其相对表达量。
2 结果
2.1WGP对DN小鼠生化指标的影响由Tab 1可知,模型组小鼠的FBG明显高于空白对照组(P<0.01),给予WGP低、中、高剂量12周后,与模型组相比,3个剂量WGP的FBG均明显降低(P<0.01);mAlb、Scr和BUN是反映肾功能的重要指标,与空白对照组相比,模型组小鼠在饲养12周后,mAlb、Scr和BUN含量均有所升高(P<0.05),与模型组相比,3个剂量WGP均可以降低DN小鼠mAlb、Scr和BUN含量(P<0.05),进而改善肾功能。
Tab 1 Effects of WGP on biochemical characteristics in DN
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group
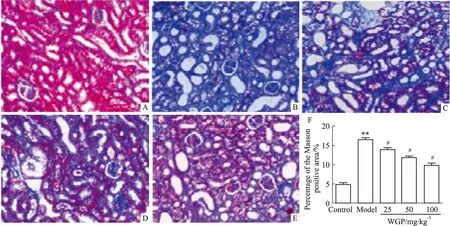
Fig 1 Masson staining and statistical analysis of kidney tissues in DN mice(×200)
A:Control group; B:Model group; C:25 mg·kg-1WGP group; D:50 mg·kg-1WGP group; E:100 mg·kg-1WGP group; F:Effect of WGP on renal fibrosis in mice with DN.**P<0.01vscontrol group;#P<0.05vsmodel group.
2.2小鼠肾脏组织的病理学变化为了观察WGP对DN小鼠肾纤维化的作用,对肾脏切片进行Masson染色,评估小鼠的肾纤维化程度。如Fig 1所示,与空白对照组相比,模型组小鼠肾小球肥大、硬化,肾小管上皮细胞萎缩,肾小球和肾小管间质蓝色区域面积明显增多(P<0.01),表明DN小鼠肾组织中胶原纤维沉积明显增多,给予WGP处理后可以减少肾组织中胶原纤维的沉积(P<0.05)。
2.3WGP对DN小鼠肾皮质α-SMA蛋白表达的影响肾小管上皮细胞表型转化为间质细胞在肾纤维化中起着重要作用,其中α-SMA是这种表型转化的标志蛋白。为了观察WGP对DN小鼠肾纤维化的作用,我们对肾脏切片进行α-SMA免疫组化染色,评估小鼠的肾纤维化程度。如Fig 2所示,与空白对照组比较,模型组小鼠肾皮质中α-SMA表达增多(P<0.01),WGP给药组小鼠肾皮质α-SMA表达逐渐减少(P<0.05或P<0.01)。
2.4WGP对DN小鼠肾皮质cAMP含量的影响cAMP信号通路与肾纤维化的发生、发展及肾小管上皮细胞增殖活化密切相关,为了进一步验证WGP对肾纤维化的作用,我们检测了肾皮质中cAMP含量。如Fig 3所示,与空白对照组比较,模型组小鼠肾皮质中cAMP含量升高(P<0.05),3个剂量WGP可有效逆转此变化(P<0.05)。以上结果表明,WGP可以改善DN状态下肾小管上皮细胞的增殖活化,从而延缓肾纤维化的进程。
2.5WGP对DN小鼠肾皮质LN和FN蛋白表达的影响LN和FN是细胞外基质的重要组成成分,我们采用Western blot法来评估DN小鼠肾皮质中细胞外基质的水平。与空白对照组比较,模型组小鼠肾皮质中LN和FN表达增多(P<0.05),给予WGP低、中、高剂量12周后,与模型组比较,3个剂量WGP的小鼠肾皮质LN表达减少(P<0.05),中、高剂量WGP可以降低DN小鼠肾皮质FN表达(P<0.05),见Fig 4。以上结果表明,WGP可以改善DN所致的小鼠肾纤维化。
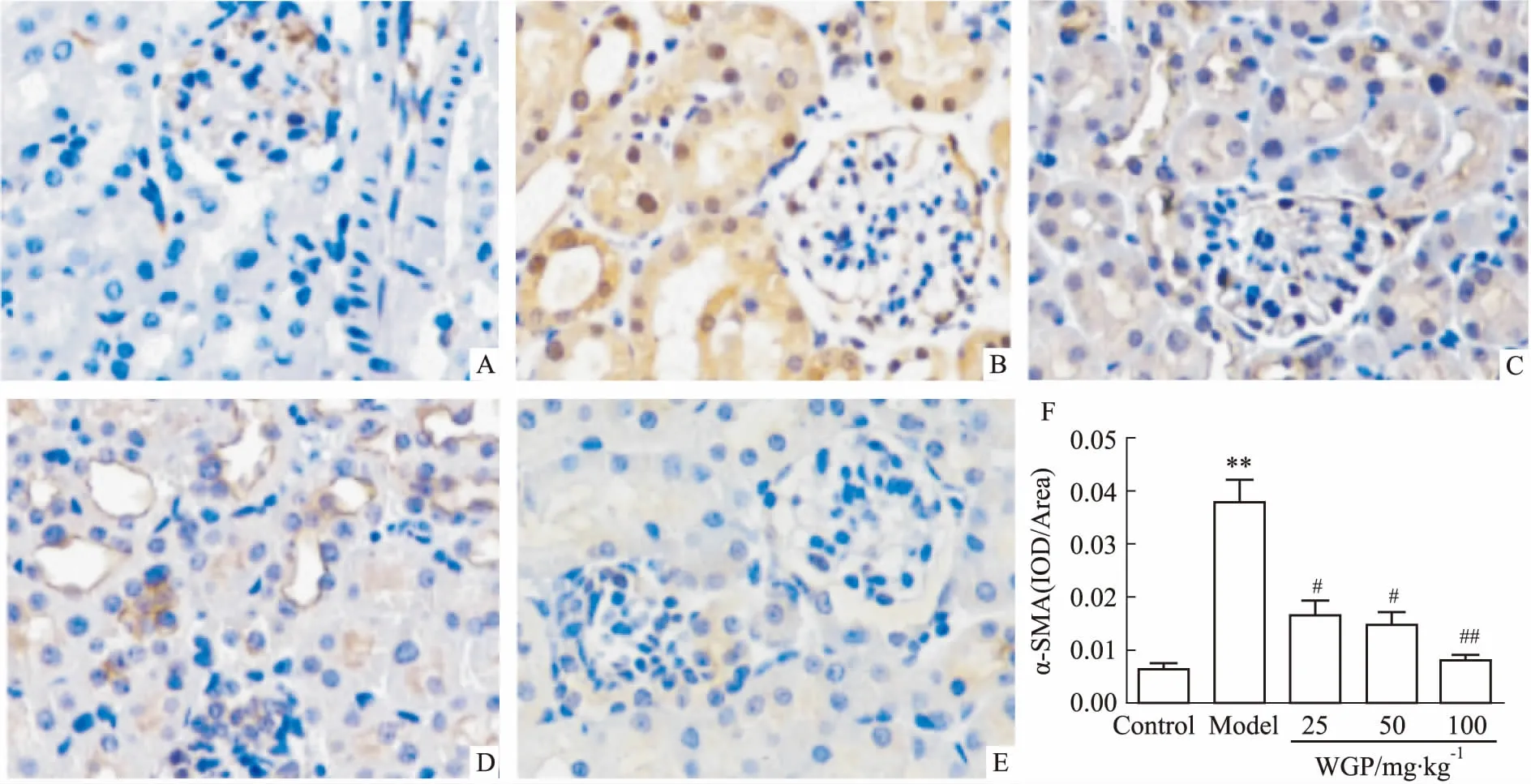
Fig 2 α-SMA protein distribution and statistical analysis of renal cortex in DN mice(×200)
A:Control group; B:Model group; C:25 mg·kg-1WGP group; D:50 mg·kg-1WGP group; E:100 mg·kg-1WGP group; F: Effect of WGP on α-SMA expression in renal cortex.**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
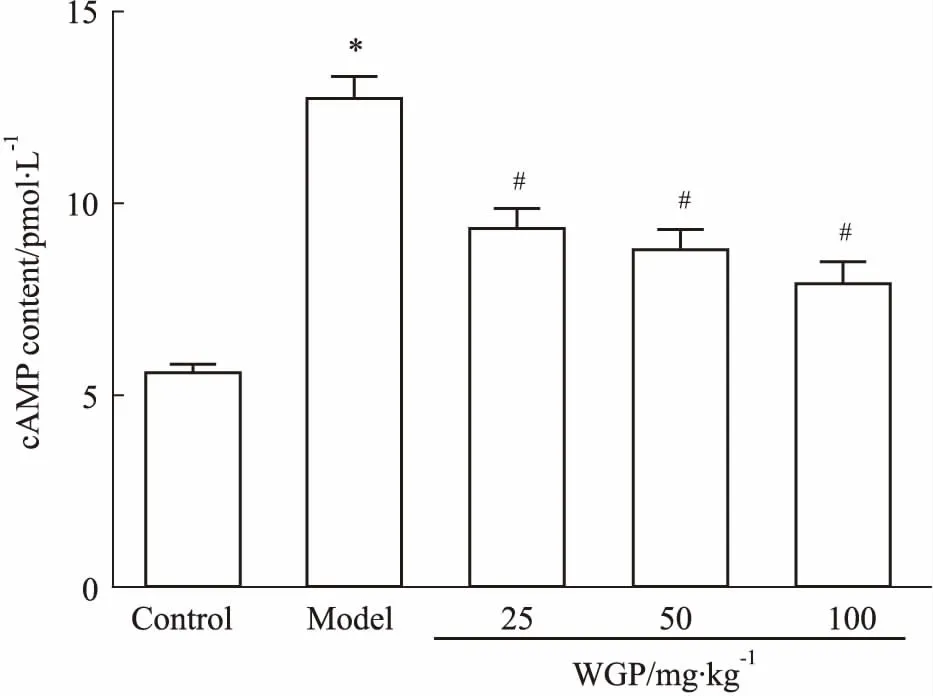
Fig 3 Effects of WGP on cAMP content in renal
*P<0.05vscontrol group;#P<0.05vsmodel group
2.6WGP对DN小鼠肾皮质PKA、CREB、p-CREB蛋白表达的影响为了探讨WGP改善肾纤维化的分子机制,我们观察了肾纤维化信号转导通路中的关键蛋白PKA、CREB和p-CREB的变化,以及WGP对PKA、CREB和p-CREB水平的影响。如Fig 5所示,与空白对照组比较,模型组小鼠肾皮质中PKA和p-CREB的蛋白表达增加(P<0.05),而对CREB无明显影响,表明DN状态下小鼠肾皮质中PKA/CREB信号通路被激活。给予WGP干预后,3个剂量均可以降低DN小鼠肾皮质中PKA和p-CREB蛋白的表达(P<0.05或P<0.01),而对CREB无明显影响。以上结果表明,WGP可以抑制DN状态下小鼠肾皮质中PKA/CREB的激活。
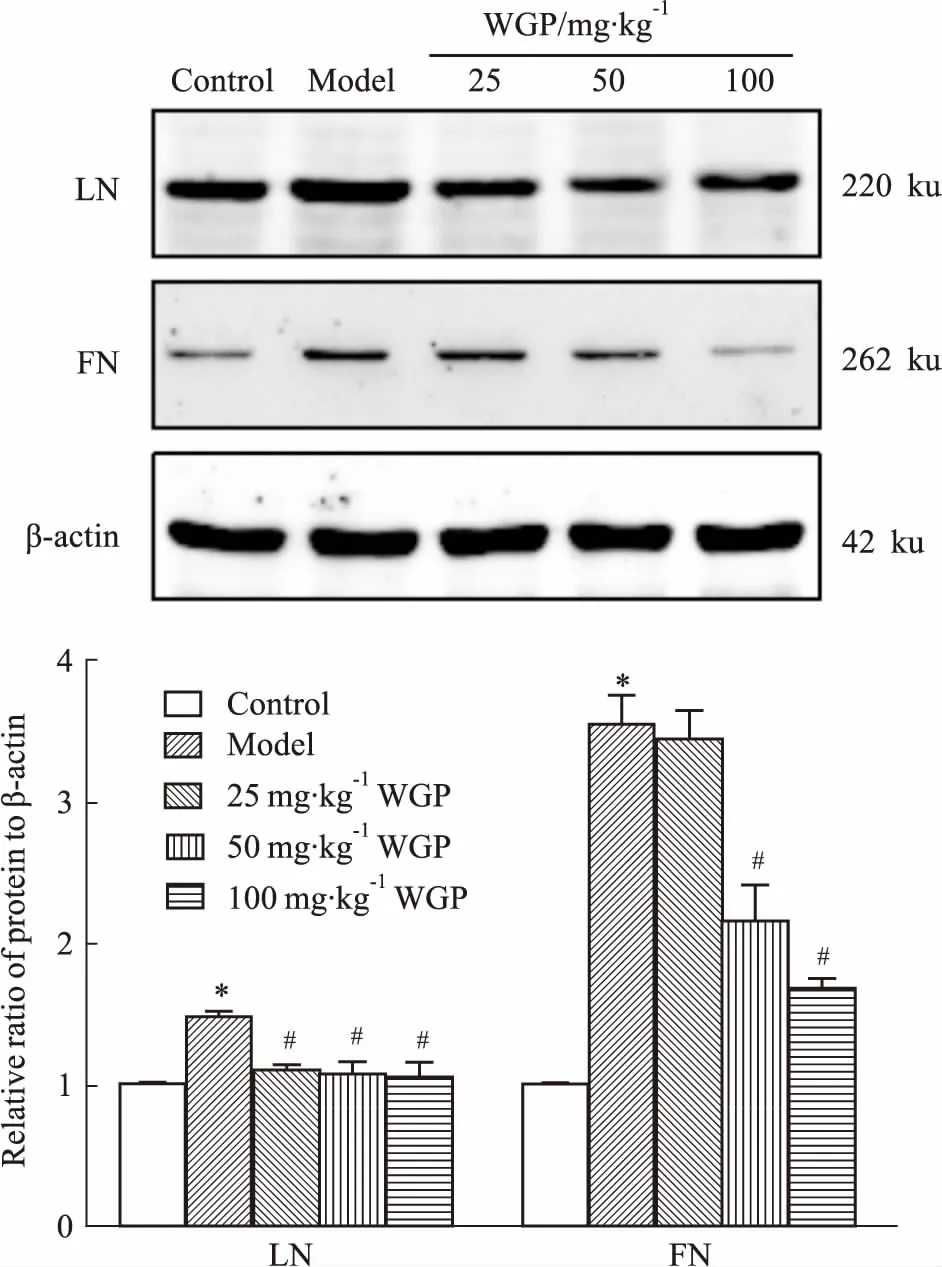
Fig 4 Effects of WGP on LN and FN expressions in renal cortex of DN
*P<0.05vscontrol group;#P<0.05vsmodel group
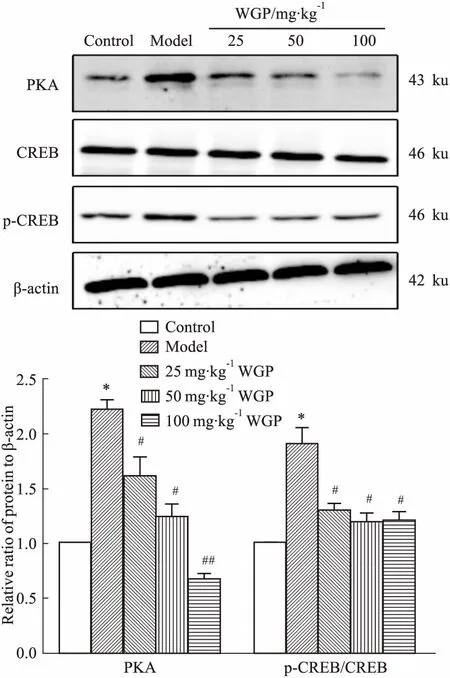
Fig 5 Effects of WGP on PKA,CREB and p-CREB expressions in renal cortex of DN
*P<0.05vscontrol group;#P<0.05,##P<0.01vsmodel group
3 讨论
人参属于五加科多年生草本植物,其有效成分包含多糖、皂苷及挥发性成分等,其中WGP为主要化学成分。我国学者已经从人参中分离出5种多糖成分,包括水溶性WGP、碱性WGP、人参淀粉、人参果胶及少量糖蛋白,具有抗肿瘤、抗氧化、降血糖、提高机体免疫系统功能等广泛的药理作用[8],由于其所具有的抗氧化、降血糖等药理作用与糖尿病发病进程相关,我们推测其与DN发病环节也可能存在一定的关系,因此,我们对其进行了初步的研究。在本实验中,DN模型小鼠经每天灌胃低、中、高剂量WGP连续12周后,3组均可有效降低DN小鼠FBG、mAlb、Scr及BUN水平,提示其对DN小鼠肾功能具有一定的保护作用。
胶原蛋白是细胞外基质的重要组成成分,胶原蛋白过度沉积在肾纤维化形成中起着非常重要的作用。为了观察DN小鼠肾纤维化的严重程度,我们采用Masson染色的方法检测了DN小鼠肾皮质中胶原的生成情况。DN小鼠饲养12周后,肾小球及肾小管间质区域蓝色胶原纤维的沉积增多。WGP的治疗不仅降低DN小鼠FBG、改善肾功能,而且还可以减少肾小球硬化、肾小球及肾小管间质胶原纤维的沉积,减缓肾纤维化的进程。
肾纤维化的发生机制非常复杂,研究证实肾小管上皮细胞表型发生转化在其中起着重要作用,其中α-SMA是这种表型转化的标志蛋白[12]。我们推测,在DN小鼠中,WGP可能通过抑制这种表型转化过程而改善肾功能,并最终延缓肾纤维化的发生与进展。因此,我们采用免疫组织化学方法对DN小鼠肾皮质中的α-SMA蛋白分布和表达进行了检测。结果显示,DN小鼠肾皮质中α-SMA蛋白表达增多,给予WGP治疗后,可以逐渐逆转DN小鼠肾皮质中α-SMA蛋白的表达。因此我们认为,3个剂量WGP均可以有效地保护或延缓DN状态下肾小管上皮细胞向间质细胞转化过程。
间质蛋白种类繁多,主要包括结构蛋白,如胶原和弹性蛋白,此外,还存在一些黏着蛋白如LN和FN,它们共同促使细胞同基质结合,参与DN肾纤维化的发生与发展[13]。为了观察DN小鼠肾纤维化的严重程度,我们采用Western blot方法检测了DN小鼠肾皮质中2种黏着蛋白的表达情况。结果显示,DN小鼠肾皮质中LN和FN表达增多,WGP治疗后可降低黏着蛋白的表达,减轻肾纤维化程度。
最近Deb等[14]研究证实,cAMP/PKA信号通路的激活是诱导肾小管上皮细胞向间质细胞转化的重要机制之一,进而促进肾纤维化的进展。国内学者翁琳等[15]研究同样发现,小鼠MDCK细胞孵育cAMP抑制剂Forskolin后可引起间质纤维化相关蛋白高表达,且该作用可被PKA抑制剂H89所抑制,说明在MDCK细胞中,cAMP-PKA信号通路可以直接促进间质纤维化进程,在常染色体显性遗传性多囊肾病理进程中发挥重要作用。CREB是PKA通路下游的含碱性亮氨酸拉链结构(bZIPs)的转录因子家族成员,可控制细胞增殖、参与细胞外基质重构,广泛参与DN发生、发展的不同环节。本实验中,DN小鼠肾皮质中cAMP含量升高,PKA和p-CREB的蛋白表达增加,表明cAMP/PKA/CREB信号通路参与了DN状态下肾纤维化的发生。给予WGP干预后,cAMP含量下降,PKA和p-CREB的蛋白表达均下降,表明WGP可能是通过抑制cAMP/PKA/CREB信号通路改善DN小鼠肾纤维化。
综上所述,WGP能够降低血糖,改善DN小鼠肾功能,减少肾组织中胶原蛋白和黏着蛋白过度沉积。WGP可能是通过抑制cAMP/PKA/CREB信号通路激活,进而阻断肾小管上皮细胞向间质细胞转化进程,最终减轻肾纤维化程度。如能充分应用WGP的药理作用,将为临床开发防治DN系列创新药物提供一定的实验依据和理论基础。
(致谢:本文所有实验均在泉州医学高等专科学校微血管生理调控实验中心完成,特别感谢对课题给予指导及帮助的老师。)
参考文献:
[1] Yao Z,Yang S,He W,et al.P311 promotes renal fibrosis via TGFβ1/Smad signaling [J].SciRep,2015,5:17032.
[2] Zhang X,Liang D,Lian X,et al.Effect of zinc deficiency on mouse renal interstitial fibrosis in diabetic nephropathy [J].MolMedRep,2016,14(6):5245-52.
[3] Hong F,Wu N,Ge Y,et al.Nanosized titanium dioxide resulted in the activation of TGF-β/Smads/p38MAPK pathway in renal inflammation and fibration of mice[J].JBiomedMaterResA,2016,104(6):1452-61.
[4] Weng L,Wang W,Su X,et al.The effect of cAMP-PKA activation on TGF-β1-induced profibrotic signaling[J].CellPhysiolBiochem,2015,36(5):1911-27.
[5] Zhang L,Duan C J,Binkley C,et al.A transforming growth factor beta-induced Smad3/Smad4 complex directly activates protein kinase A [J].MolCellBiol,2004,24(5):2169-80.
[6] 康 伟,王 肃.地黄多糖对糖尿病肾病大鼠模型的治疗作用及对PPAR-γ信号通路的影响[J].中国生化药物杂志,2015,35(9):30-3,37.
[6] Kang W,Wang S.Therapeutic effect of rehmannia polysaccharide on diabetic nephropathy rat model and its effects on PPARγ signal pathway[J].ChinJBiochemPharm,2015,35(9):30-3,37.
[7] 蒋 赛,彭晓珊,黄志华,等.黄芪多糖配伍三七总皂苷对糖尿病模型大鼠肾脏保护作用研究[J].浙江中西医结合杂志,2015,25(11):995-8.
[7] Jiang S,Peng X S,Huang Z H,et al.Effect of Astragalus polysaccharides combined with Panax Notoginseng saponins on kidney of rats with diabetic nephropathy[J].ZhejiangJIntegrTraditChinWestMed,2015,25(11):995-8.
[8] 宋 治,韩凤波,毕 博,等.红皮病对人参多糖含量的影响[J].人参研究,2015,(2):20-1.
[8] Song Z,Han F B,Bi B,et al.Rusty root of Ginseng effect on contents of polysaccharide[J].GinsengRes,2015,(2):20-1.
[9] Zhang X,Yu L,Bi H,et al.Total fractionation and characterization of the water-soluble polysaccharides isolated fromPanaxginsengC.A.Meyer[J].CarbohydrPolym,2009,77(3):544-52.
[10] 郭福团,许雄伟,潘建峰,等.桑枝多糖对糖尿病肾病小鼠肾皮质氧化应激作用的影响[J].中国药理学通报,2016,32(8):1148-52.
[10] Guo F T,Xu X W,Pan J F,et al.The anti-oxidative effect of Ramulus mori polysaccharides on diabetic nephropathy mice[J].ChinPharmacolBull,2016,32(8):1148-52.
[11] Sun C,Chen Y,Li X,et al.Anti-hyperglycemic and anti-oxidative activities of ginseng polysaccharides in STZ-induced diabetic mice[J].FoodFunct,2014,5(5):845-8.
[12] 麻志恒,钟利平,余柯娜,等.抗纤灵对5/6肾切除诱导的慢性肾纤维化小鼠模型不同时期ColⅠ、α-SMA、FN的影响[J].中成药,2017,39(1):181-4.
[12] Ma Z H,Zhong L P,Yu K N,et al.Effects of Kangxianlin on ColⅠ,α-SMA and FN during different periods in mice with chronic renal failure induced by 5/6 nephrectomized[J].ChinTraditPatMed,2017,39(1):181-4.
[13] 李凤婷,李 梦,岳顺卿,等.固本通络汤对糖尿病肾病模型大鼠FN、LN、C-Ⅳ表达的影响[J].山东中医药大学学报,2012,36(2):142-3.
[13] Li F T,Li M,Yue S Q,et al.Effects of Gubentongluo decoction on FN,LN and C-Ⅳ expression in diabetic nephropathy rats[J].JShandongUnivTraditChinMed,2012,36(2):142-3.
[14] Deb D K,Bao R,Li Y C.Critical role of the cAMP-PKA pathway in hyperglycemia-induced epigenetic activation of fibrogenic program in the kidney[J].FASEBJ,2017,31(5):2065-75.
[15] 翁 琳,周 虹,杨宝学.cAMP-PKA信号通路在多囊肾病间质病变中作用的研究[J].中国药理学通报,2015,31(Suppl):105-6.
[15] Weng L,Zhou H,Yang B X.Role of the cAMP-PKA signaling pathway in interstitial lesions of polycystic kidney disease[J].ChinPharmacolBull,2015,31(Suppl):105-6.