叶下珠抗补体活性研究
朱芳娟,侯灵莉,孙黔云,杨庆雄
(1.贵州师范大学化学与材料科学学院,贵州 贵阳 550001;2.贵州医科大学省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550014;3.贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550014;4.贵州师范大学喀斯特研究院/国家喀斯特石漠化防治工程技术研究中心,贵州 贵阳 550001)
叶下珠(Phyllanthusurinaria)又名阴阳草、油甘草、珍珠草等,为大戟科(Euphorbiaceae)叶下珠属一年生草本植物,广泛分布于全世界热带及亚热带地区如泰国、菲律宾、非洲等地,在我国主要分布于长江以南地区[1]。叶下珠属植物的化学成分复杂,含有木脂素、多酚等多种类型的化合物。叶下珠及同属的多种植物,作为传统中药以干燥全草入药,具有平肝清热、利水解毒的功效,具有抗炎、抗病毒、抗氧化、抗癌、抗骨质疏松、抗菌、抗血栓等作用[2-3]。我们前期筛选发现叶下珠粗提物具有抗补体活性,鉴于补体与诸多疾病有密切关系,本文以活性为向导开展了叶下珠抗补体活性的研究。
1 材料
1.1药物与试剂叶下珠全草采集于广西东部地区,由贵州师范大学喀斯特研究院杨庆雄教授鉴定为大戟科叶下珠属叶下珠(Phyllanthusurinaria)。样品标本保存于贵州师范大学喀斯特研究院。绵羊红细胞、兔红细胞、大鼠血清(贵州省实验动物中心);标准人血浆(德国Siemens);色谱乙腈(德国 Merck);石油醚、乙酸乙酯、氯仿均为分析纯;提取用甲醇为工业级;葡聚糖凝胶Sepharmadex LH-20(安玛西亚技术有限公司)。
1.2仪器Revco超低温冰箱(美国 Thermo);5810R冷冻离心机(德国 Eppendorf);Molecular Devices Spectra MAX-190连续波长酶标仪(美国MD); N-1000旋转蒸发仪(上海埃朗);T-214 电子天平(北京赛多斯仪器系统有限公司);Elix 纯水系统和 Milli-Q超纯水系统(美国Millipore);Shimadazu LC-15C高效液相色谱仪(日本岛津)。
2 方法
2.1叶下珠抗补体活性成分的分离鉴定叶下珠原料9.0 kg,粉碎后,甲醇冷浸提取3次,每次浸泡 24 h,合并 3 次提取液,旋转蒸馏除去溶剂,得到甲醇浸膏。甲醇浸膏先后使用石油醚、氯仿、乙酸乙酯萃取分段,每种溶剂均萃取3次。分别合并萃取液,旋转蒸发仪下减压蒸馏浓缩,除去溶剂,分别得到石油醚部分95.0 g、氯仿部位38.5 g、乙酸乙酯部分79.6 g、水部分125.5 g。
叶下珠各个分段提取物进行抗补体溶血活性测定,选择抗补体活性效果明显的部分进一步分离纯化。叶下珠乙酸乙酯部位,经MCI柱分离得4部分(Fr.1~4)。经活性测定后,Fr.3为活性部位,对这个部位进行进一步的分离。Fr.3(1.6 g)上葡聚糖凝胶柱Sephadex LH20,甲醇 ∶水(20%、40%、60%、80%、100%)梯度洗脱,从60%部位中分离得化合物1(292.4 mg),80%部位上制备HPLC,30%乙腈水溶液洗脱,得到化合物2(5.4 mg)。
2.2抗补体经典途径的测定致敏绵羊红细胞悬液的制备方法[4]:将保存在阿氏液中的绵羊红细胞(sheep red blood cell,SRBC)用GGVB++缓冲溶液洗涤,2 500 r·min-1离心10 min,重复洗涤3次,再用GGVB++缓冲溶液配成浓度为1.0×1012·L-1的SRBC悬液,取等体积效价为1 ∶1 500的溶血素加入SRBC悬液中,混匀后,置于37℃水浴孵育30 min,存放于4℃冰箱备用。
人血浆稀释度的确定参照文献[4]的方法。不同稀释度的人血浆(用GGVB++缓冲溶液稀释)、致敏绵羊红细胞各100 μL加入试管中,37℃水浴孵育,每隔5 min轻摇1次,30 min后加入1 mL冷生理盐水终止反应,2 500 r·min-1离心10 min,取200 μL上清液,采用酶标仪测定412 nm吸光值,选取溶血率在70%~80%之间的稀释度进行实验。
抗补体溶血活性测定参照文献[4]的方法。样品用二甲基亚砜溶液配制成浓度为10 g·L-1的储备液,使用前用PBS稀释。将不同浓度的样品、稀释人血浆(用GGVB++按1 ∶20稀释)、致敏绵羊红细胞 (5.0×1011·L-1) 各100 μL加入试管中,轻轻混匀,37℃水浴孵育 30 min,每5 min轻摇1次,孵育结束后,立即加入 1 mL冷生理盐水终止反应,于2 000 r·min-1离心 10 min,取上清液在波长 412 nm 处测定吸光度值。根据下列公式计算各组的溶血率和抑制率。
溶血率=[(A正常管/样品管-A血清管-A血球管)/
(A全溶管-A血球管)]×100%
抑制率=[1-样品组溶血率/正常组溶血率 ]×100%
2.3抗补体旁路途径的测定取保存在阿氏液中的兔红细胞,用GVB-Mg-EGTA缓冲溶液洗涤, 2 000 r·min-1离心10 min,反复3次,再用GVB-Mg-EGTA缓冲溶液配成浓度为1.5×1011·L-1的悬液备用。
参照文献方法[5],用 PBS稀释样品,取5 μL加至95 μL GVB-Mg-EGTA缓冲溶液(含2 mmol·L-1MgCl2、8 mmol·L-1EGTA)中,加入100 μL大鼠血清(含4 mmol·L-1MgCl2、16 mmol·L-1EGTA缓冲溶液1 ∶5稀释),再加入100 μL兔红细胞悬液,充分均匀后,于37 ℃水浴30 min,每隔5 min轻摇1次。之后加入0.5 mL冷生理盐水终止反应,2 000 r·min-1离心,取200 μL上清液于412 nm测吸光度。
2.4样品对经典途径C3转化酶形成的影响不同浓度的样品液、人血浆(用GGVB++按1 ∶20稀释)各100 μL加入试管中,37℃恒温水浴孵育10 min,再加入致敏绵羊红细胞100 μL,37℃恒温水浴孵育5 min,然后加入生理盐水1 mL,2 000 r·min-1离心10 min,重复洗红细胞2次,弃上清,加入100 μL稀释血浆(用含40 mmol·L-1EDTA的GVB缓冲溶液稀释),37℃恒温水浴孵育30 min,加入0.9 mL冷生理盐水终止反应。2 000 r·min-1离心10 min,取上清液,在波长412 nm处测吸光度。
3 结果
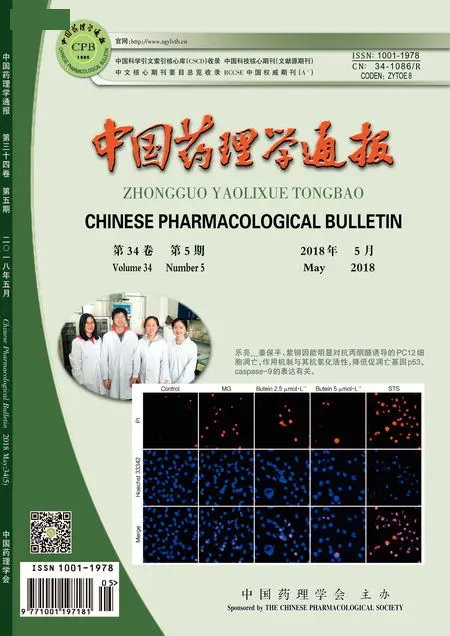
3.1叶下珠的活性成分的分离鉴定叶下珠甲醇提取物以及各极性部分抗补体活性筛选结果显示,叶下珠总提取物和乙酸乙酯萃取部位抗补体效果好(Fig 1)。根据结果,对乙酸乙酯部位进行分离,获得两个有活性的化合物1和2。
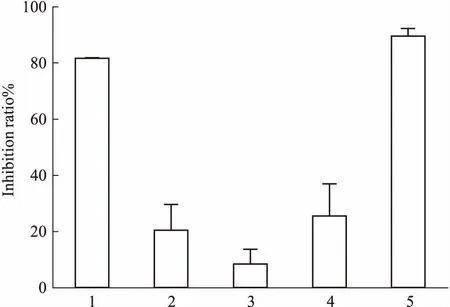
Fig 1 The anticomplementary activity of various extracts
1:Methanol extract;2:Water extract;3:Petroleum ether extract;4:Chloroform extract;5:Ethyl acetate extract.
化合物1: 灰白色粉末。13C-NMR (400 MHz,CD3OD) ∶δ ∶61.4 (C-6),63.5 (C-4),68.1 (C-2),69.8 (C-3),74.7 (C-5),93.3 (C-1),107.2(C-2‴),109.0 (C-2‴),109.9 (C-2′,6′),114.9 (C-6‴),115.6 (C-6″),119.9 (C-1′),124.6 (C-1‴),124.8 (C-1″),135.8 (C-4‴),136.3 (C-4″),138.4 (C-4′),143.9 (C-3″),144.0 (C-5‴),144.5(C-5″),145.0 (C-3′,5′),145.3 (C-3‴),164.3 (C-7′),166.3 (C-7″),167.7 (C-7″)。与文献[6]报道的柯里拉京结构数据基本一致,所以推定化合物1为柯里拉京(corilagin)。
化合物2:浅黄色粉末。13C-NMR(400 MHz,CD3OD) ∶δ ∶107.8 (C-1,1′),140.6 (C2-2′),135.9 (C-3,3′),147.9 (C-4,4′),110.8 (C-5,5′),111.9(C-6,6′),158.6(C-7,7′),与文献[7]中对比基本一致,由此鉴定化合物2为鞣花酸(ellagic acid)。
3.2抗补体经典途径活性抗补体经典途径溶血实验表明,乙酸乙酯萃取部位、化合物1和2均能够抑制补体活性,其IC50分别为53.77、176.54、102.23 mg·L-1(Fig 2、3)。
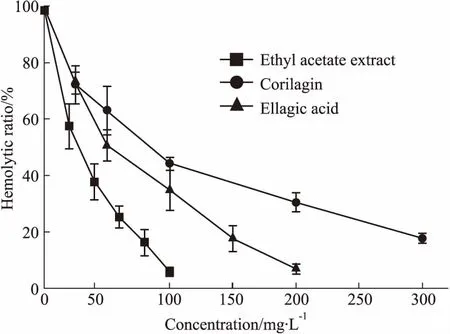
Fig 2 Effect of samples on hemolytic activity of complement classical pathway
Fig 3 The inhibitory effect of samples on hemolytic activity of complement classical pathway
3.3抗补体旁路途径活性对补体旁路途径测定表明,叶下珠提取物对其抑制效果不明显(Fig 4、5)。
3.4样品对经典途径C3转化酶形成的影响对补体经典途径C3转化酶的抑制实验中,乙酸乙酯萃取物、柯里拉京、鞣花酸均表现出抑制作用,其中乙酸乙酯萃取部位的抑制作用最好(Fig 6)。
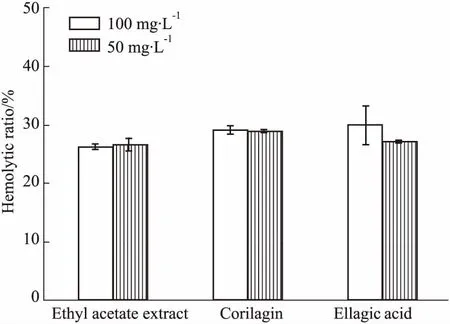
Fig 4 Effect of samples on hemolytic activity of complement alternative pathway
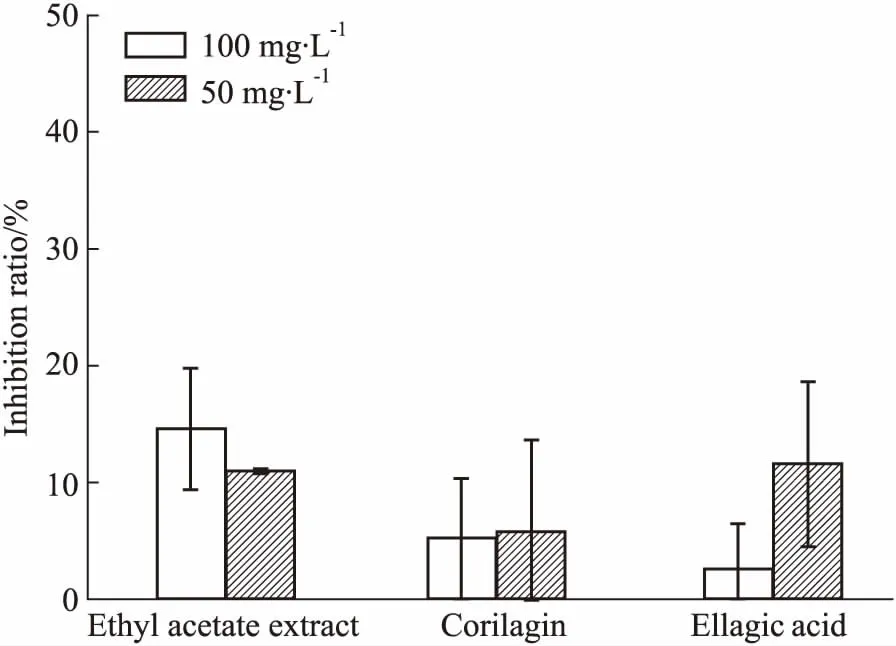
Fig 5 The inhibitory effect of samples on hemolytic activity of complement alternative pathway
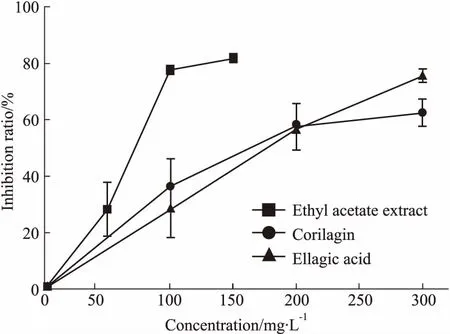
Fig 6 Effect of samples on formation of C3 convertase of complement classical pathway
4 讨论
补体在天然免疫系统中具有重要的作用,其激活有经典、旁路和凝集素3条途径。补体过度激活会导致人体自身正常组织的炎症和损伤[8],在诸多病症的发病机制中扮演了重要角色,如急性肺损伤、类风湿性关节炎、系统性红斑狼疮、缺血/再灌损伤等。抑制补体已成为防治补体相关疾病和损伤的重要策略之一[9]。目前,从天然产物中已分离出多种类型的抗补体活性成分,包括多糖、黄酮、甾体、皂苷、生物碱等[10]。天然产物将会是抗补体新药的重要来源。
叶下珠提取物已报道的活性有抗氧化、抗辐射、抗肿瘤和抗病毒等[11],目前尚未见叶下珠抗补体活性的研究报道。我们前期筛选发现叶下珠提取物具有抗补体活性。本研究显示,叶下珠的乙酸乙酯萃取物具有明显的抗补体活性,再对其进行提取分离,得到两个活性化合物柯里拉京和鞣花酸。实验结果显示,乙酸乙酯萃取物、鞣花酸、柯里拉京的抗补体经典途径溶血活性的IC50分别为53.77、102.23、176.54 mg·L-1,但对旁路途径无明显作用,表明叶下珠成分主要影响经典途径。在病理生理条件下,补体激活的经典途径开始于C1q与抗原-抗体复合物结合后,依次活化C1r、C1s、C4、C2,形成经典途径C3转化酶(C4b2b),启动补体活化的级联反应。而补体旁路途径则是由微生物或其他病原激活,在旁路途径成分B因子、D因子等参与下,形成C3转化酶[12],从而引发级联反应。基于叶下珠样品对经典途径溶血活性的影响,我们进一步研究了样品对经典途径C3转化酶形成的影响。结果表明,叶下珠抗补体活性成分影响了经典途径C3转化酶的形成。通过对乙酸乙酯萃取部位、化合物1和2的抗补体活性的比较,提示了叶下珠中可能还存在活性更高的化合物。本工作有助于加深对叶下珠药用功效及物质基础的认识,也为进一步研究叶下珠活性成分提供了实验依据。
(致谢:本研究化学部分是在贵州师范大学杨庆雄教授课题组完成,抗补体活性部分在贵州省中国科学院天然产物化学重点实验室孙黔云研究员课题组完成,特此表示感谢。)
参考文献:
[1] 郑秀青.叶下珠化学成分分离和药理作用的研究 [D].福州:福建农林大学,2008.
[1] Zheng X Q.Study on chemical composition separation and pharmacological action ofPhyallanthusurinariaL[D].Fuzhou:Fujian Agriculture and Forestry University,2008.
[2] Tong F,Zhang J,Liu L, et al.Corilagin attenuates radiation-induced brain injury in mice[J].MolNeurobiol,2016,53(10):6982-96.
[3] Patel J R,Tripathi P,Sharma V,et al.Phyllanthus amarus:ethnomedicinal uses,phytochemistry and pharmacology:a review[J].JEthnopharmacol,2011,138(2):286-313.
[4] 沈良贤.脂多糖激活补体对内皮细胞的作用及抑制补体对脂多糖致急性肺损伤的影响 [D].遵义:遵义医学院, 2011.
[4] Shen L X.Effect of lipopolysaccharide-activated complement on endothelial cell and the effect of complement inhibition on lipopolysaccharide-induced acute lung injury[D].Zunyi:Zunyi Medical College,2011.
[5] 孙黔云,叶巧玲,闫银萍.小鼠血清补体替代途径溶血活性测定的新方法[J].中国药理学通报,2011,27(11):1619-22.
[5] Sun Q Y,Ye Q L,Yan Y P.A new method for measurement of the alternative pathway activity of mouse serum complement[J].ChinPharmacolBull,2011,27(11):1619-22.
[6] 沙东旭,刘英华,王龙顺,徐绥绪.叶下珠化学成分的研究[J].沈阳药科大学学报,2000,17(3):176-8.
[6] Sha D X,Liu Y H,Wang L S, Xu S X.Studies on the chemical constituents of common Leafflower (Phyllanthusurinaria)[J].JShenyangPharmUniv,2000,17(3):176-8.
[7] 黄永林,李典鹏,杨子明.红背山麻杆叶的化学成分研究(Ⅳ)——多酚类化合物[J].广西植物, 2015,35(4):564-8.
[7] Huang Y L, Li D P, Yang Z M.Chemical constituents from the leaves ofAlchorneatrewioides(4).Polyphenols[J].Guihaia, 2015,35(4):564-8.
[8] 周 英,李 敏,孙黔云.绿原酸、咖啡酸和阿魏酸对补体旁路激活致内皮细胞炎症相关分子表达的干预[J].中国药理学通报,2016,32(12):1723-8.
[8] Zhou Y,Li M,Sun Q Y.Effect of chlorogenic acid,caffeic acid,and ferulic acid on inhibition of inflammatory response of HMECs induced by activated complement alternative pathway[J].ChinPharmacolBull,2016,32(12):1723-8.
[9] 郭 静,李 敏,杨付梅,孙黔云.补体旁路激活致小鼠急性肺损伤的炎症病理机制研究[J].中国药理学通报,2016,32(11):1521-6.
[9] Guo J,Li M,Yang F M,Sun Q Y.Inflammatory mechanism of acute lung injury in mice induced by activation of complement alternative pathway[J].ChinPharmacolBull,2016,32(11):1521-6.
[10] Arumugam T V,Woodruf T M,Lathia J D,et a1.Neuroprotection in stroke by complement inhibition and immunoglobulin therapy[J].Neuroscience,2009,158(3):1074-89.
[11] Tong G D,Zhang X,Zhou D Q,et al.Efficacy of early treatment on 52 patients with preneoplastic hepatitis B virus-associated hepatocellular carcinoma by compoundPhyllanthusUrinariaL[J].ChinJIntegrMed,2014,20(4):263-71.
[12] 孙黔云.眼镜蛇毒因子在生命科学中的应用[J].生命科学,2016,28(1):22-6.
[12] Sun Q Y.Application of cobra venom factor in life sciences[J].ChinBullLifeSci,2016,28(1):22-6.