钾通道阻滞剂四乙基铵敏感性钾电流在肺高压大鼠肺动脉平滑肌细胞中的变化
张双双,穆云萍,贺志成,颜晓晓,林默君
(福建医科大学基础医学院生理学与病理生理学系,心血管病离子通道信号调控福建省高校重点实验室,福建 福州 350108)
肺高压(pulmonary hypertension,PH)是由许多因素引发的以肺血管重塑、肺血管收缩升高、原位血栓的形成为典型病理改变的一类临床病理生理综合征。肺血管阻力、肺血管压力持续性升高,肺血流受限,最终会导致右心衰竭,甚至死亡[1]。肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)的收缩和增殖参与了PH发展过程中持续的肺血管收缩和血管重塑[2],而胞质内游离Ca2+浓度([Ca2+]i)的增加是PASMCs收缩和增殖的主要诱因和重要刺激[3]。钾通道是细胞内钾离子(K+)转移至细胞外的主要途径,在调节膜电位、[Ca2+]i、血管平滑肌收缩等方面都发挥着重要作用[4]。电压依赖性钾通道(voltage-depending potassium channel,KV)作为最常见的钾通道家族,广泛表达于PASMCs细胞膜。研究发现,KV故障与PH的产生和发展有很大关联,抑制KV会引起细胞内K+积聚,导致细胞膜发生去极化,进而激活L型电压门控Ca2+通道,胞外Ca2+进入细胞内,增加[Ca2+]i,使得肺血管持续性收缩,而持续的血管收缩最终会影响PASMCs的增殖和凋亡,引起肺血管重构[5]。我们的前期研究表明,PH大鼠模型PASMCs中[Ca2+]i明显提高,各类Ca2+通道功能明显增强[6],但是PASMCs中KV的功能还有待进一步的研究。因此,本文使用慢性低氧(chronic hypoxia,CH)、野百合碱(monocrotaline,MCT)诱导的两种PH大鼠模型,探讨钾通道阻滞剂四乙基铵(tetraethylammonium,TEA)敏感性KV电流的电生理特性及其在PH中的变化。
1 材料与方法
1.1试剂氯化钾(KCl)、氯化镁(MgCl2)、氯化钙(CaCl2)、HEPES、EGTA、二甲基亚砜(DMSO),均购自Sigma公司。野百合碱(MCT,Sigma)配制方法:首先采用HCl(1 mol·L-1)溶解,其次用NaOH(1 mol·L-1),使得溶液pH为7.0,最后用双蒸水定容成2%溶液,现配现用。TEA(Sigma)用双蒸水配成2.5 mmol·L-1的贮存液备用。其他试剂均为国产分析纯。
1.1.1钾通道电流电极内液的配制 电极内液(mmol·L-1):KCl 35、Mg-ATP 5、葡萄糖酸钾 90、NaCl 10、GTP 0.5、HEPES 10,用5 mol·L-1KOH调节pH至7.2。高浓度ATP用于阻断ATP敏感性钾通道(ATP-sensitive K+channels,KATP)电流,电极内液无Ca2+,最大限度阻断钙离子激活性钾通道(Ca2+-activated K+channels,KCa)电流,以保证记录到的钾电流基本为KV电流。
1.1.2通道灌流液的配制 通道灌流液(mmol·L-1):葡萄糖 5.2、NaCl 136、HEPES 10、KCl 5.4、CaCl21.8、MgCl21.2,用3 mol·L-1NaOH调节pH至7.4。
1.2肺高压模型的建立
1.2.1CH肺高压模型的建立 清洁级♂ SD大鼠(体质量200~220 g),购自福建医科大学实验动物中心[SCXK(闽)2012-0001],随机分为正常对照组、CH组。将两组动物同时放于密封的有机玻璃饲养箱内,CH组饲养箱内氧分压调至9.5%~10.5%,对照组箱内维持正常氧分压,常规饲养3周,正常饮食饮水,饲养箱每天定时清理。
1.2.2MCT肺高压模型的建立 清洁级♂ SD大鼠(体质量150~160 g),随机分为对照组和MCT组。MCT 组采用50 mg·kg-1的剂量一次性腹腔注射MCT(2%),对照组则采用相同的方法给予等体积生理盐水,常规饲养3周,正常饮食饮水。
1.3右心室内压测定各组大鼠饲养3周后,用20%乌拉坦(0.5 g·kg-1)腹腔注射麻醉,并行腹腔肝素化(500 IU·kg-1)处理,迅速分离右颈外静脉,经静脉行右心室(right ventricle, RV)插管术,PE50管(0.6mm ID×0.9mm OD)成功进入RV后,对各组的右心室收缩压(right ventricular systolic pressure, RVSP)进行记录。
1.4右心室重量指数计算右心室内压测定结束后,对动物实施安乐死,随后快速剖开胸腔,并取出心、肺组织,置于滤纸上,沿心脏房室交界剪去左右心房和周围大血管组织,完整保留左右心室,随后沿室间隔分离RV,反复用滤纸吸干其上的血液和水分,最后用分析天平称重。将左心室与室间隔(left ventricular wall plus septum, LV+S)剖开,同样用滤纸吸干其上的血液和水分,然后采用分析天平进行称重,最后计算右心室质量指数(right ventricular mass index, RVMI):RVMI= RV/(LV+S)。
1.5PASMCs培养及鉴定各组大鼠血流动力学测定结束后,开胸取出心肺,在HEPES缓冲盐溶液(HBSS)中分离肺叶内动脉,用棉签去血管内皮,然后将动脉放置于4℃的HBSS中,恢复20 min。将血管组织置于37℃含胶原蛋白酶I、木瓜蛋白酶、牛血清蛋白的酶溶液中消化20 min,取出,并用无Ca2+的HBSS终止消化。将细胞混悬液置于35 mm培养皿,并用含1% FBS、100 kU·L-1链霉素和0.1 g·L-1青霉素的F-12培养基培养12~24 h。
对培养12~24 h的PASMCs进行免疫组织化学鉴定。首先将细胞滴在培养皿中的玻璃片中央进行培养,后用PBS清洗细胞3次,4%多聚甲醛室温固定30 min;再用PBS冲洗5 min×3次,用蒸馏水冲洗,0.3% H2O2室温孵育10 min,蒸馏水冲洗,PBS冲洗5 min×3次;滴加封闭血清,室温孵育40 min,倾去多余液体;滴加鼠抗actin单克隆抗体(1 ∶400),阴性对照采用PBS,4℃湿盒孵育过夜,然后在37℃复温45 min,PBS冲洗5 min×3次;滴加生物素标记羊抗鼠IgG工作液,37℃孵育30 min,PBS冲洗5 min×3次;滴加辣根酶标记链霉素卵白素工作液,37℃孵育30 min,PBS冲洗5 min×3次;DAB显色剂显色,然后在显微镜下观察,掌握显色程度,蒸馏水充分冲洗终止染色;苏木精复染2 min;乙醇脱水,二甲苯透明,中性树胶封片。阳性结果判断:胞质内呈棕褐色丝状条纹沉淀。
1.6全细胞膜片钳技术测定钾电流取培养12~24 h的PASMCs于细胞记录槽内,用细胞外液灌流;玻璃微电极(电阻3~5 MΩ)内充灌正常或含2.5 mmol·L-1TEA的电极内液。选择贴壁良好、形态规则、细胞膜光滑完整且折光性好的大鼠PASMCs,记录细胞膜的KV电流。钳制电位为-80 mV,阶跃电压10 mV,给予从-80 mV至+60 mV的去极化脉冲刺激,并用pClamp软件分析。
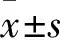
2 结果
2.1PH模型的鉴定如Fig 1所示,与对照组相比,CH组、MCT组的RVSP和RVMI均明显升高(P<0.01),其中CH和MCT模型构建成功率高达80%,表明CH和MCT均能够引起大鼠肺动脉压力的明显升高,导致右心室肥厚,PH模型构建成功。
2.2PASMCs的免疫化学鉴定取原代培养的大鼠PASMCs进行免疫组织化学染色(Fig 2),Fig 2A为阴性对照,Fig 2B为阳性对照。在高倍镜下可见细胞核呈淡蓝色,卵圆形居中,阳性对照胞质内呈棕褐色丝状条纹沉淀,即可判断为PASMCs。
2.3TEA对对照组KV电流的影响-80 mV钳制电压下,给予去极化脉冲刺激从-80 mV到+60 mV,阶跃电压10 mV,记录KV特异性阻滞剂TEA(2.5 mmol·L-1)对PASMCs KV电流的影响。Fig 3结果显示,PASMCs在阶跃电压刺激下,随刺激电压强度的增加,KV电流也随之变大,并且形成I-V曲线[pA/pF:(40.06±3.08),Fig 3A]。TEA干预后,PASMCs的I-V曲线明显减小[pA/pF:(17.68±2.01),P<0.01,Fig 3B]。表明TEA能够明显抑制PASMCs KV电流的I-V曲线,但是对KV电流的形态无明显影响。
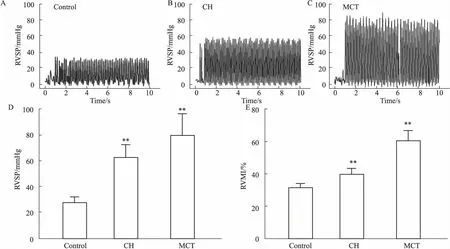
Fig 1 CH and MCT up-regulated RVSP and RVMI
Typical traces showing RVSP in control (A), CH (B) and MCT (C).Average values of RVSP (D) in control (n=26), CH-induced rats (n=27) and MCT-treated rats (n=22) and average values of RVMI (E) of control (n=21), CH-induced rats (n=20) and MCT-treated rats (n=25).**P<0.01vscontrol.
Fig 2 Immunohistochemical staining identified PASMCs (×400)
Immunocytochemical staining by α-actin (smooth muscle specific) antibody in PASMCs.A: negative; B: positive.
2.4KV电流在对照组中的变化及TEA的干预作用为进一步观察KV电流在CH致PH大鼠PASMCs中的变化,在相同钳制电压和阶跃电压下,去极化脉冲刺激后记录KV电流。结果显示,与正常组相比,CH组PASMCs KV电流I-V曲线明显减小[pA/pF:(36.19 ± 3.18),P<0.05,Fig 4A],表明CH处理能够降低大鼠PASMCs KV电流。随后,观察KV抑制剂TEA对CH大鼠PASMCs钾电流的干预作用,结果显示,与加药前相比,TEA明显抑制CH组KV的I-V曲线[pA/pF:(15.50±3.64),P<0.01,Fig 4B]。表明TEA同样能够明显抑制CH大鼠PASMCs中KV电流的I-V曲线,而KV电流I-V曲线的形态在加药前后无明显变化。
2.5KV电流在MCT大鼠中的变化及TEA的干预作用我们继续观察了MCT预处理对PASMCs中KV电流的影响,相同钳制电压和阶跃电压下,给予相同的去极化脉冲刺激,记录MCT致PH大鼠KV电流。结果显示,与正常组相比,MCT组KV电流I-V曲线明显降低[pA/pF:(26.26 ± 4.14),P<0.01,Fig 5A],且比CH组降低的更明显,表明MCT预处理能够明显降低大鼠PASMCs KV电流。继续观察TEA对MCT组KV电流的干预作用,结果显示,TEA作用后,MCT大鼠KV的I-V曲线明显降低[pA/pF:(18.76±4.47),P<0.01,Fig 5B]。表明KV抑制剂TEA明显抑制MCT大鼠PASMCs中KV电流的I-V曲线,而对I-V曲线的形态无明显影响。
2.6TEA的抑制作用在PH大鼠中的变化最后,观察CH和MCT诱导的PH大鼠中TEA对KV电流抑制作用的变化。利用pClamp分析软件将加TEA之前的KV电流曲线减去同一细胞加药后的电流曲线,即为TEA敏感性钾电流曲线,也代表了TEA对细胞KV电流的抑制作用。因此,我们通过分析不同组别PASMCs中TEA敏感性钾电流的大小,反映TEA对KV电流抑制作用的强弱。结果显示,与正常组(30.09 ± 2.81)比较,CH组PASMCs的TEA敏感性钾电流减小至(4.57 ± 0.54)(P<0.01),MCT组的TEA敏感性钾电流减小至(2.36 ± 0.76)(P<0.01),差异具有统计学意义(Fig 6)。以上结果表明,TEA敏感性钾电流在CH和MCT诱导的PH大鼠明显减小,即TEA对PASMCs中KV电流的抑制作用明显降低。
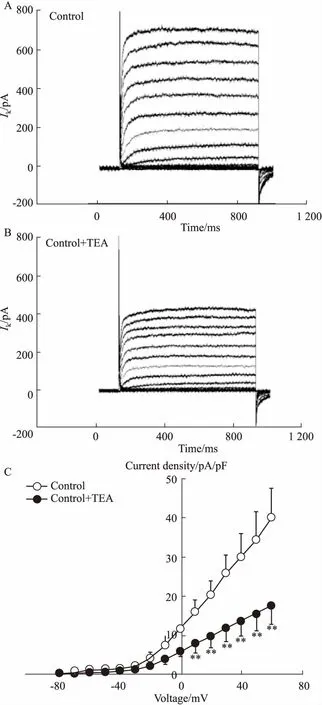
Fig 3 TEA decreased whole-cell KV currents in PASMCs of control rats
A: Original IKVtrace in PASMCs of rats in control group; B: Original IKVtrace in PASMCs of control rats in the presence of TEA; C: Curve graphs of the relationship between current density and voltage in normal group (n=10).**P<0.01vscontrol group.
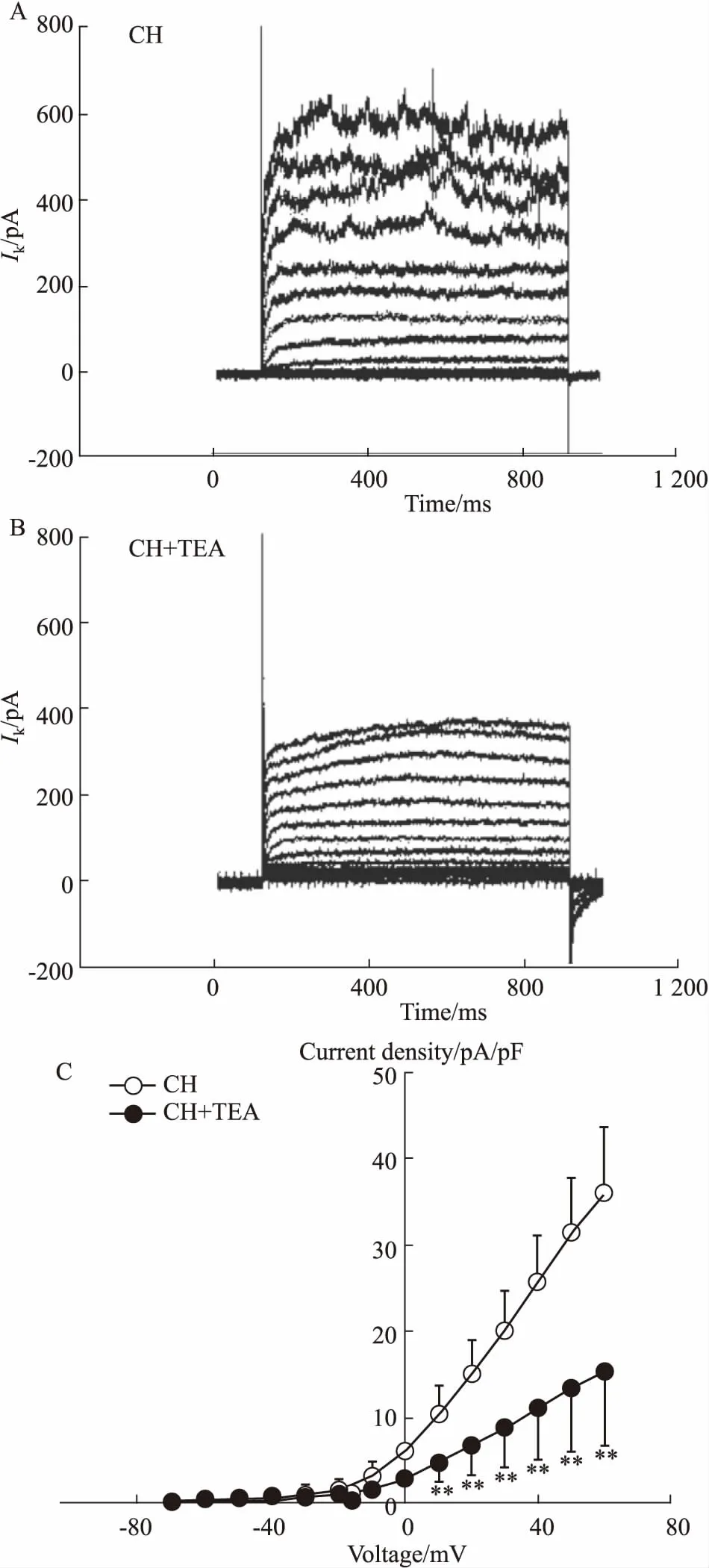
Fig4TEAdecreasedKVcurrentsinPASMCsofCH-treatedrats
A: Original IKVtrace in PASMCs of CH-treated rats; B: Original IKVtrace in PASMCs of CH rats in the presence of TEA; C: Curve graphs of the relationship between current density and voltage in CH-treated rats (n=6).**P<0.01vsCH group.
3 讨论
研究表明,CH刺激可以使肺动脉收缩,血管张力升高,PASMCs多种Ca2+通道蛋白表达和功能增强[7-10],引起胞内Ca2+稳态失衡,同时CH能够抑制PASMCs凋亡,促进细胞增殖[11],引起PH。MCT可直接损伤肺血管内皮,使内皮胶原纤维裸露,导致肺血管血栓,并引发PASMCs增生等多种病理改变,引起肺血管壁重塑,最终形成PH[12]。研究表明,KV参与调节PASMCs的静息膜电位,决定肺血管张力[10]。抑制钾通道,使细胞膜发生去极化,引起KV开放,最终使得[Ca2+]i提升,血管收缩性加强[11]。因此,钾通道一直是治疗PH的重要靶点。
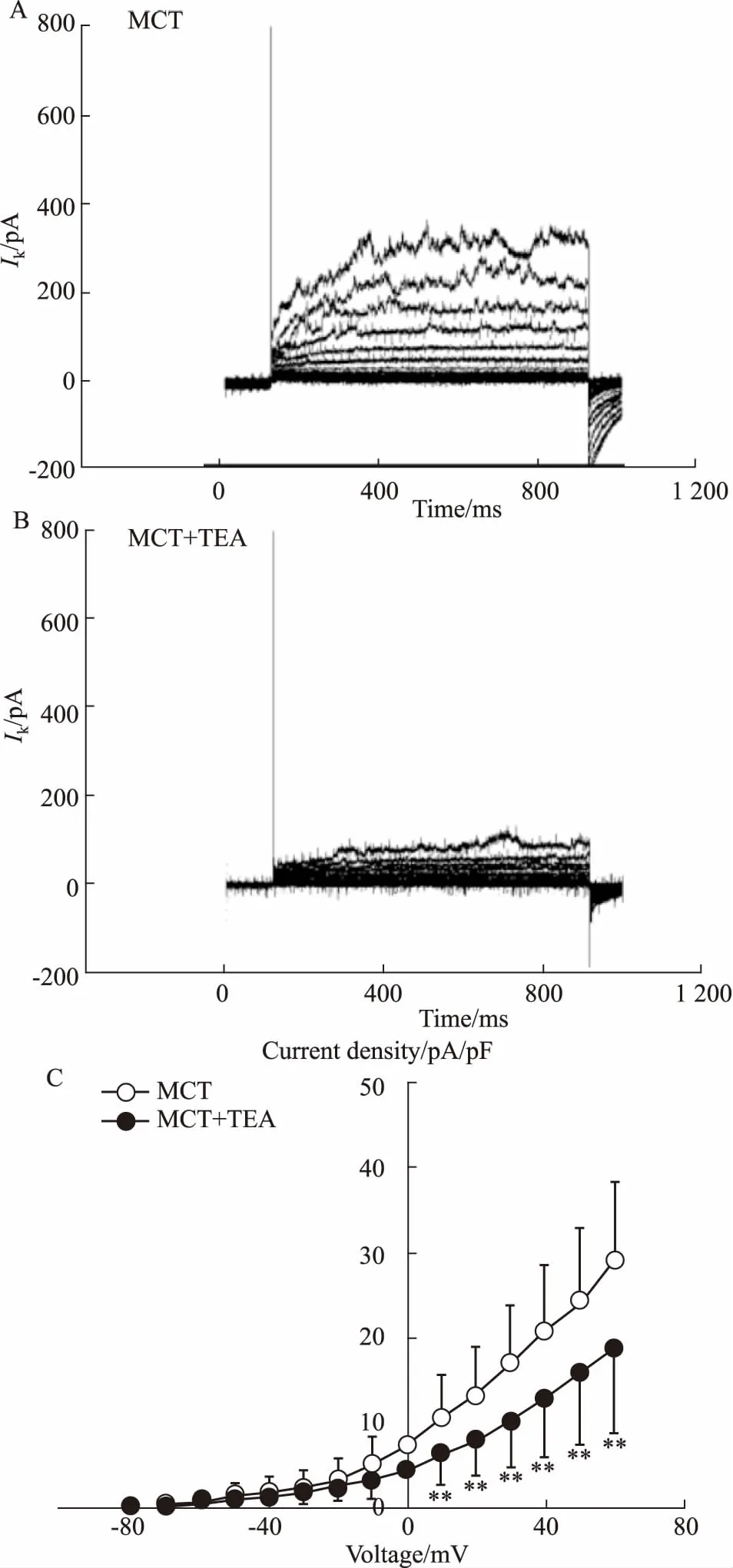
Fig 5 TEA decreased KV currents in PASMCs of MCT-induced rats
A: Original IKVtrace in PASMCs of MCT-induced rats; B: Original IKVtrace in PASMCs of MCT rats in the presence of TEA; C: Curve graphs of the relationship between current density and voltage in MCT-induced rats (n=5).**P<0.01vsMCT group.
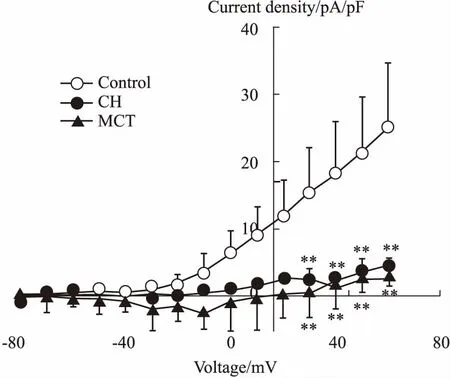
Fig 6 Alteration of TEA-sensitive KV currents in PASMCs of PH rats
Average whole cell current-voltage (I-V) plots of outward TEA-sensitive KVcurrents recorded in PASMCs of control (n=10), CH (n=6) and MCT (n=5)-induced rats with whole cell patch-clamp techniques.Currents have been corrected for cell capacitance and plotted as current density.All currents were evoked at a holding potential of -80mV.**P<0.01vscontrol group.
本研究使用全细胞膜片钳技术,首先在正常大鼠PASMCs上观察了KV特异性阻滞剂TEA对KV电流的影响。结果显示TEA干预后,PASMCs上记录到的KV电流明显减小,表明TEA特异性阻断了PASMCs细胞膜上的KV,使自由通过通道的K+明显减少,导致形成的钾电流减小,该研究结果与文献报道基本一致。有研究表明,CH刺激下PASMCs细胞膜上的KV通道的活性与PH的发生、发展及肺血管的重塑密切相关[10],CH处理可明显抑制PASMCs的KV通道活性,从而使Ca2+通道开放,最终导致PH的形成。本研究的结果与此基本一致,CH组的KV电流明显减小,且TEA干预后同样明显抑制CH大鼠中记录到的KV电流。
MCT作为一种较为成功的PH模型,它的代谢产物野百合吡啶能破坏肺动脉内皮细胞,促进PASMCs增殖,而PASMCs增殖过度又会引发肺血管重塑。本研究中,从电流密度-电压关系曲线图中,我们观察到MCT诱导的PH大鼠PASMCs的KV电流明显减小,且与CH组相比,MCT诱导的PH大鼠KV电流被抑制的更明显。同样,TEA干预后,明显抑制MCT大鼠PASMCs上记录到的KV电流。CH和MCT诱导PH大鼠中KV电流密度明显减小,同时,TEA敏感性钾电流也明显减小,TEA对PASMCs中KV电流的抑制作用明显降低。提示PH大鼠模型PASMCs上的KV通道的数量或者活性减小,同时具体是哪种类型的KV作用减小还有待进一步研究。
综上所述,CH和MCT诱导的PH能够明显抑制大鼠PASMCs上KV的开放,使得通过的KV电流明显减小;KV特异性抑制剂TEA可以阻断正常大鼠和PH大鼠PASMCs上的KV,明显降低钾电流。因此,明确PH大鼠PASMCs钾电流的变化有助于揭示PH的发病机制,对于针对PH的新药研究具有非常重要的意义。
(致谢:非常感谢美国Johns Hopkins大学医学院肺及重症医学系James S.K.Sham教授在实验设计和膜片钳技术操作中给予的无私帮助。)
参考文献:
[1] Hoeper M M, Bogaard H J, Condliffe R, et al.Definitions and diagnosis of pulmonary hypertension [J].JAmCollCardiol, 2013,62: D42-50.
[2] Kuhr F K, Smith K A, Song M Y, et al.New mechanisms of pulmonary arterial hypertension: role of Ca2+signaling [J].AmJPhysiolHeartCircPhysiol, 2012,302: H1546-62.
[3] Tuna, B G, Bakker, E N, VanBavel, E.Smooth muscle biomechanics and plasticity: relevance for vascular calibre and remodelling [J].BasicClinPharmacolToxicol, 2012,110(1):35-41.
[4] Hu H L, Zhang Z X, Chen C S, et al.Effects of mitochondrial potassium channel and membrane potential on hypoxic human pulmonary artery smooth muscle cells [J].AmJRespirCellMolBiol, 2010,42(6):661-6.
[5] Park W S, Firth A L, Han J, Ko E A.Patho-, physiological roles of voltage-dependent K+channels in pulmonary arterial smooth muscle cells [J].JSmoothMuscleRes, 2010,46(2):89-105.
[6] Chen W S, Li X Q, Cao W, et al.Vardenafil ameliorates calcium mobilization in pulmonary artery smooth muscle cells from hypoxic pulmonary hypertensive mice [J].ArchMedRes, 2012,43(4):265-73.
[7] 承 伟,李 智.肺动脉高压模型大鼠肺动脉平滑肌细胞内钙的改变[J].中国药理学通报,2010,26(5):593 - 6.
[7] Cheng W, Li Z.Alteration of [Ca2+]iin pulmonary artery smooth muscle of pulmonary artery hypertension rats [J].ChinPharmacolBull, 2010,26(5):593-6.
[8] 穆云萍,焦海霞,朱壮丽,戴 耄.慢性低氧大鼠TRPC1表达与肺动脉收缩变化时间曲线关系[J].中国药理学通报,2014,30(12):1667-71.
[8] Mu Y P, Jiao H X, Zhu Z L, Dai M.Relationship of time-course curve between the expression of TRPC1 and vascular tone of pulmonary arteries in chronic hypoxia pulmonary hypertension rats [J].ChinPharmacolBull, 2014,30(12):1667-71.
[9] Cahill E, Rowan S, Sands M, et al.The pathophysiological basis of chronic hypoxic pulmonary hypertension in the mouse: vasoconstrictor and structural mechanisms contribute equally [J].ExpPhysiol, 2012,97(6): 796-806.
[10] Zhang W H, Zhang Y J, Liu C P, et al.Simvastatin protects against the development of monocrotaline-induced pulmonary hypertension in rats via a heme oxygenase-1-dependent pathway [J].ExpLungRes, 2011,37:492-9.
[11] Firth A L, Remillard C V, Platoshyn O, et al.Functional ion channels in human pulmonary artery smooth muscle cells: voltage-dependent cation channels [J].PulmCirc, 2011,1(1):48-71.
[12] Yuan J X, Aldinger A M, Juhaszova M, et al.Dysfunctional voltage-gated K+channels in pulmonary artery smooth muscle cells of patients with primary pulmonary hypertension [J].Circulation, 1998,98:1400-6.