二甲双胍对2型糖尿病模型大鼠肾功能及肾组织SIRT1表达的影响
余 丹,叶山东,李业琼,胡 闻
(安徽医科大学附属省立医院1.内分泌科、2.病理科,安徽 合肥 230001)
糖尿病肾脏疾病(diabetic kidney disease,DKD)是一种常见的糖尿病慢性微血管并发症,表现为进行性白蛋白尿,随后肾小球滤过率(glomerular filtration rate, GFR)逐渐下降,导致肾衰竭伴有足细胞损失、进行性肾小球硬化和肾小管间质性纤维化[1]。其发病与慢性高血糖、炎症、氧化应激、肾小球血流动力异常等有关[2]。二甲双胍(metformin, MET)是广泛使用的一线抗糖尿病药物,近来研究显示,其可减少DKD患者的尿蛋白排泄,对糖尿病肾脏病变有一定的保护作用,但机制尚不十分明确[3]。沉默信息调节因子1(silent information regulator 1,SIRT1)涉及多种疾病的发病机制,包括肾脏疾病[4]。研究显示,营养感受途径的改变,如雷帕霉素靶蛋白敏感型复合体1(mammalian target of rapamycin complex 1,mTORC1)、腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase, AMPK)、SIRT1与糖尿病肾损伤的发病机制有关[5]。在营养过剩的条件下,mTORC1、AMPK活化和SIRT1的活化减少,可能抑制自噬,而自适应自噬可以对抗糖尿病状态下的细胞应激,保护肾实质细胞[6]。本研究观察二甲双胍对2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠肾组织SIRT1表达的影响,初步探讨二甲双胍对T2DM大鼠肾脏组织的保护作用及其机制。
1 材料与方法
1.1材料
1.1.1实验动物 清洁级8 周龄♂ SD 大鼠,体质量180~220 g,购自安徽医科大学动物中心。所有动物自由饮食和饮水,适应性喂养1 周后开始实验。实验期间湿度48%,室温控制为(19±1)℃,照明、黑暗12 h交替。
1.1.2药物与试剂 二甲双胍购自上海施贵宝公司;链脲佐菌素(streptozocin, STZ)购自Sigma公司;白蛋白放射免疫试剂盒购自天津市协和公司;肌酐、尿素氮试剂盒购自南京建成科技公司;TRIzol、引物和PCR试剂盒购自大连TaKaRa公司;格列本脲(glibenclamide, GLY)购自天津太平洋公司;SIRT1免疫组化试剂盒购于武汉博士德生物工程有限公司;尿SIRT1 ELISA试剂盒购自上海艾来萨生物科技公司。
1.1.3仪器 DG-3022A型酶联免疫检测仪(江苏南京国营华东电子管厂);DFM-96型10管放射免疫计数仪(安徽合肥众成机电公司);DS-5型糖化血红蛋白检测仪(英国DREW公司);NDl000紫外/分光光度仪(美国Nano-Drop公司);ABI7500型扩增仪(美国Bio-Rad公司)。
1.2方法
1.2.1T2DM大鼠模型的建立、分组及给药 44只SD大鼠,随机分为正常组10只和模型组34只。正常组大鼠给予普通饲料饲养,模型组大鼠给予高脂饲料(含88%常规饲料、10%猪油、2%胆固醇) 。饲养4周后,禁食不禁水12 h,然后腹腔注射STZ(30 mg·kg-1)建立T2DM大鼠模型。造模72 h后,大鼠禁食不禁水8 h,尾静脉采血测定血糖≥16.7 mmol·L-1为造模成功。共30只造模成功,随机分为糖尿病组、二甲双胍(300 mg·kg-1·d-1) 治疗组和格列本脲组(5 mg·kg-1·d-1),每组均为10 只,灌胃给药,每天1次,连续8 周,T2DM大鼠继续高糖高脂饲料喂养。
1.2.2标本的采集 干预治疗8周后,用代谢笼收集12 h尿液,混匀后留取尿液5 mL,置于-40℃冰箱中,待测尿肌酐、尿SIRT1和尿白蛋白。收集尿标本后,各组大鼠在10%的水合氯醛腹腔注射麻醉下,行腹主动脉插管采集血标本,待测血糖(blood glucose,BG)、血尿素氮(blood urea nitrogen,BUN)、糖化血红蛋白(hemoglobin A1c,HbA1c)。取出大鼠的双肾组织,用生理盐水反复灌洗,去除包膜,右肾部分组织放置于液氮中保存,留做real-time PCR,其余肾脏组织用来观察肾脏的病理变化。
1.3检测指标及方法
1.3.1生化指标的检测 尿肌酐检测使用苦味酸比色法,尿SIRT1检测采用ELISA法,血尿素氮检测使用尿酶法,尿白蛋白检测使用放射免疫分析法。尿SIRT1及尿白蛋白排泄取其与尿肌酐的比值来表示,以排除尿液稀释的影响,表示为尿SIRT1 肌酐比(urinary SIRT1/urine creatinine,USIR)和尿白蛋白肌酐比(urinary albumin/urine creatinine, UACR)。
1.3.2免疫组化检测肾组织SIRT1蛋白表达 石蜡切片脱蜡水化;滴加3% H2O2,在室温下孵育15 min,以阻断内源性过氧化物酶;用PBS冲洗5 min×3 次;滴加10%的正常山羊血清封闭液,置于室温下20 min;滴加一抗(SIRT1稀释浓度为1 ∶200),4℃冰箱过夜;次日用PBS洗3 min×3次;滴加二抗,放置于37℃温箱内孵育30 min,用PBS清洗3 min×3次;用DAB显色;自来水冲洗,复染后脱水至透明,封片。每张切片选取3个视野拍照,采用全自动图像分析系统(Image Pro Plus 6.0)测定图像阳性反应部分的面积及相应的累积光密度(integral optical density , IOD),选取各切片阳性物质的相对含量,用SIRT1IOD表示。
1.3.3Real-time PCR法检测肾组织SIRT1 mRNA表达 用TRIzol法提取肾组织RNA,提取2 μg总RNA逆转录为cDNA,产物分别进行SIRT1及β-actin的扩增。SIRT1引物序列为上游:5′-TGTTTCCTGTGGGATACCTGA-3′,下游:5′-TGAAGAATGGTCTTGGGTCTTT-3′;β-actin引物序列为上游:5′-GCCTTAGCCTGGACCCATAG-3′,下游:5′-GACCACCAATCCACACAGA-3′。使用ABI7500型扩增仪,在20 μL反应体系下运用荧光染料法,95℃预变性30 s;95℃变性5 s,60℃退火34 s,72℃延伸1 min的热循环40次;95℃15 s、60℃ 1 min及95℃ 15 s循环1次。内参和目的片段分别同批扩增,每组同时设置3个复孔,采用ΔΔCt法分析Ct值, 2-ΔΔCt表示目的基因mRNA表达的拷贝数与β-actin拷贝数之比。
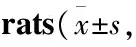
Tab 1 Biochemical indicators after 8 weeks of intervention in n=10)
*P<0.05vsNC group;#P<0.05vsT2DM group;△P<0.05vsMET group
1.3.4电镜观察 取部分肾皮质在2.5%戊二醛室温下固定30 min,制作成超薄切片,在10 000倍下采取10个视野,并随机选取8处,测量肾小球基底膜厚度(glomerular basement membrane thickness, GBMT),求其平均值。电子显微镜下观察肾小球足细胞形态。
2 结果
2.1各组大鼠一般生化指标的比较8周末,与正常组比较,各组T2DM大鼠的血HbA1c、BG、BUN、USIR、UACR水平明显增高,差异有统计学意义(P<0.05);与T2DM组比较,MET组和GLY组上述指标明显降低(P<0.05),但高于NC组(P<0.05)。MET组与GLY组之间BG和HbA1c值差异无统计学意义(P>0.05),BUN、USIR和UACR差异有统计学意义(P<0.05)。见Tab 1。
2.2各组大鼠肾组织SIRT1蛋白表达的变化Fig 1、Tab 2免疫组化结果显示,NC组肾组织SIRT1表达最多,其余各组SIRT1IOD水平均减少,差异有统计学意义(P<0.05)。与T2DM组比较,MET组及GLY组SIRT1蛋白表达水平增加(P<0.05),MET组SIRT1蛋白表达高于GLY组,差异有统计学意义(P<0.05)。
2.3各组大鼠肾组织SIRT1mRNA表达的变化Real-time PCR结果显示,NC组肾组织SIRT1 mRNA表达最多,其余各组SIRT1 mRNA水平均减少,且差异存在统计学意义(P<0.05);MET组和GLY组肾组织SIRT1 mRNA表达明显高于T2DM组(P<0.05),且MET组SIRT1 mRNA表达高于GLY组,差异有统计学意义(P<0.05),见Tab 2。
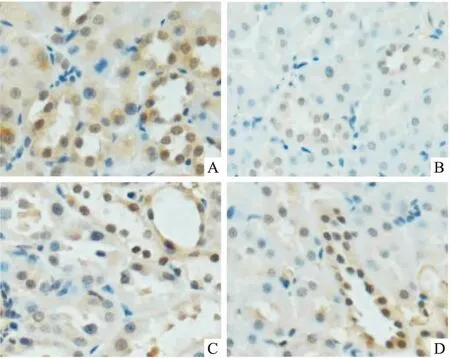
Fig1ExpressionofSIRT1inrenaltissuesofeachgroup(×400)
A: NC group; B: T2DM group; C: MET group; D: GLY group
2.4各组大鼠肾组织病理学变化Fig 2电镜下可见,NC组肾脏结构清晰,足突无融合,GBM厚薄均匀;T2DM组GBMT明显增厚,与NC组比较,差异有统计学意义(P<0.05),且足突融合,结构模糊不清;MET组和GLY组GBMT较T2DM组明显减低(P<0.05),足突融合明显改善;GLY组与MET组GBMT差异无统计学意义(P>0.05)。见Tab 2。
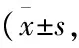
Tab 2 Comparison of GBMT and expression of mRNA and protein of SIRT1 after 8 weeks of intervention in rats n=10)
*P<0.05vsNC group;#P<0.05vsT2DM group;△P<0.05vsMET group
3 讨论
SIRT1是长寿蛋白(Surtuin)家族的一员[7],是一种烟酰胺腺嘌呤二核苷酸(nicotinamide adeninedinucleotide, NAD+)依赖性脱乙酰酶,在调节胰岛素信号和代谢率、控制胰岛素敏感性、脂肪储存代谢及葡萄糖利用等方面都起着高度保守的作用[8]。SIRT1参与许多细胞的代谢,并涉及人类疾病(如肥胖、T2DM、癌症、神经变性疾病)的发生发展[9]。Kume等[5]证实,在糖尿病状态下,代谢障碍可通过激活mTORC1的靶标以及减少AMPK和SIRT1活性而损害自噬作用。下调肾脏中SIRT1的表达可抑制自噬,导致线粒体活性氧(reactive oxygen species,ROS)的积聚,参与糖尿病肾病的发生[7]。文献报道,SIRT1可能通过调节转录因子如p53的活性,保护肾小球足细胞[10]。Bao等[3]证实,激活线粒体AMPK-SIRT1-过氧化物酶体增殖物激活受体γ共激活因子α(peroxisome proliferators activated receptor gamma co-activator 1α, PGC-1α)信号通路,可缓解高脂饮食所致的糖尿病模型大鼠体内氧化应激和线粒体破坏,并增加肾脏肾病蛋白和足细胞标志蛋白的表达,SIRT1激活可阻止肾细胞凋亡,抑制炎症和纤维化[7]。
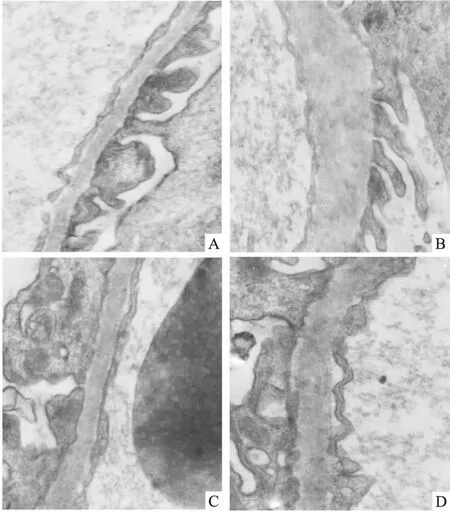
Fig 2 The pathological changes in kidneys of rats after 8 weeks of intervention observed under electron microscope (×10 000)
A: NC group; B: T2DM group; C: MET group; D: GLY group
二甲双胍是一线抗糖尿病药物,Caton等[11]研究发现,二甲双胍可增加肝组织SIRT1蛋白表达和活性,抑制TORC2介导的糖异生。本动物实验结果显示,经二甲双胍及格列本脲干预8周后,MET组和GLY组BUN、UACR和GBMT均低于T2DM组,足细胞病理改变减轻,且MET组低于GLY组,但两组血糖和HbA1c无明显的差异,提示二甲双胍在降血糖作用相似的情况下,其肾脏保护作用较格列本脲更具优势,部分独立于血糖的降低。进一步观察显示,糖尿病模型组大鼠肾组织SIRT1蛋白和mRNA表达明显降低,MET和GLY干预治疗后,可明显增加肾组织SIRT1表达,且二甲双胍优于格列本脲。提示二甲双胍可上调T2DM大鼠肾组织SIRT1蛋白和mRNA的表达,进而对肾脏提供一定的保护作用。MET增加肾组织SIRT1表达的机制尚不十分明确,可能与其抑制炎症反应、减轻氧化应激和诱导自噬有关。Tsuruoka等[12]发现,高血糖状态下足细胞SIRT1和PGC-1α的表达减少,导致线粒体损伤。二甲双胍激活AMPK/SIRT1旁路,减轻氧化应激,降低NAD+/NADH比值,从而增加SIRT1活性[11,13]。此外,二甲双胍也可直接刺激SIRT1的表达和增加其活性,并通过调节SIRT1下游靶标叉头转录因子(Forkhead box O1,FoxO1)和p53/p21,保护内皮细胞[14],激活SIRT1/ FoxO1通路,致线粒体氧化应激降低[15]。Zheng等[16]报道了视网膜内皮细胞在高血糖条件下,二甲双胍直接或部分通过肝激酶B1(liver kinase B1,LKB-1)/AMPK通路,增加SIRT1水平/活性,从而抑制ROS产生、NF-κB的激活以及Bax诱导的细胞凋亡。并且,二甲双胍治疗恢复SIRT1表达,可通过蛋白激酶A(protein kinase A, PKA)独立的途径诱导自噬[17]。本研究结果显示,二甲双胍干预组尿SIRT1蛋白排泄明显降低,有待进一步观察。
综上所述,本实验初步结果显示二甲双胍可降低糖尿病大鼠肾组织SIRT1蛋白和mRNA的表达,该结果可能与其肾脏保护作用有关。
(致谢: 本研究在安徽医科大学附属省立医院糖尿病研究室和病理科完成,在此致以由衷的感谢! )
参考文献:
[1] Lieberthal W, Levine J S.The role of the mammalian target of rapamycin (mTOR) in renal disease[J].JAmSocNephrol, 2009,20(20):2493-502.
[2] Skupien J, Warram J H,Niewczas M A,et al.Synergism between circulating tumor necrosis factor receptor 2 and HbA1c in determining renal decline during 5-18 years of follow-up in patients with type 1 diabetes and proteinuria[J].DiabetesCare, 2014,37(9):2601-8.
[3] Bao L,Cai X,Dai X, et al.Grape seed proanthocyanidin extracts ameliorate podocyte injury by activating peroxisome proliferator-activated receptor-γ coactivator 1α in low-dose streptozotocin-and high-carbohydrate/high-fat diet-induced diabetic rats[J].FoodFunct, 2014,5(8):1872-80.
[4] Roth M, Chen W Y.Sorting out functions of sirtuins in cancer[J].Oncogene, 2014,33(13):1609-20.
[5] Kume S, Koya D, Uzu T, et al.Role of nutrient-sensing signals in the pathogenesis of diabetic nephropathy[J].BiomedResInt, 2014,2014(8):3154-94.
[6] Kitada M, Ogura Y, Monno I, et al.Regulating autophagy as a therapeutic target for diabetic nephropathy[J].CurrDiabRep, 2017,17(7):53.
[7] Kitada M, Kume S, Takeda-Watanabe A, et al.Sirtuins and renal diseases: relationship with aging and diabetic nephropathy[J].ClinSci(Lond), 2013,124(3):153-64.
[8] Yang T, Fu M, Pestell R, Sauve A A.SIRT1 and endocrine signaling[J].TrendsEndocrinolMetab, 2006,17(5):186-91.
[9] Moynihan K A, Grimm A A, Plueger M M, et al.Increased dosage of mammalian Sir2 in pancreatic beta cells enhances glucose-stimulated insulin secretion in mice[J].CellMetab, 2005,2(2):105-17.
[10] Liu R, Zhong Y, Li X, et al.Role of transcription factor acetylation in diabetic kidney disease [J].Diabetes, 2014,63(7):2440-53.
[11] Caton P W, Nayuni N K, Kieswich J, et al.Metformin suppresses hepatic gluconeogenesis through induction of SIRT1 and GCN5[J].JEndocrinol, 2010,205(1):97-106.
[12] Tsuruoka S, Hiwatashi A, Usui J, et al.The mitochondrial SIRT1-PGC-1α axis in podocyte injury[J].KidneyInt, 2012,82:735-6.
[13] 王光宇, 毕亚光, 刘向东,等.二甲双胍对高糖培养H9c2细胞Connexin43表达的影响[J].中国药理学通报, 2016,32(7):920-4.
[13] Wang G Y, Bi Y G, Liu X D, et al.Effects of metformin on the expression of Connexin43 in H9c2 cells cultured with high glucose [J].ChinPharmacolBull, 2016,32(7):920-4.
[14] Arunachalam G, Samuel S M, Marei I, et al.Metformin modulates hyperglycaemia-induced endothelial senescence and apoptosis through SIRT1[J].BrJPharmacol, 2014,171:523-35.
[15] Tikoo K, Lodea S, Karpe P A, et al.Calorie restriction mimicking effects of roflumilast prevents diabetic nephropathy [J].BiochemBiophysResCommun, 2014,450(4):1581-6.
[16] Zheng Z, Chen H, Li J, et al.Sirtuin 1-mediated cellular metabolic memory of high glucose via the LKB1/AMPK/ROS pathway and therapeutic effects of metformin[J].Diabetes, 2012,61(1):217-28.
[17] Song Y M, Lee Y H, Kim J W, et al.Metformin alleviates hepatosteatosis by restoring SIRT1-mediated autophagy induction via an AMP-activated protein kinase-independent pathway[J].Autophagy, 2015,11(1):46-59.