加速溶剂萃取-QuEChERS法测定高活性干酵母粉中12种有机持久污染物残留
李 芳, 粟有志, 李艳美, 雷红琴, 孟 茹, 储晓刚
(1.伊犁出入境检验检疫局综合技术服务中心,伊犁 伊宁 835000;2.中国检验检疫科学研究院,北京 100025)
有机持久污染物 (POPs)主要包括滴滴涕(DDT)、艾氏剂等有机氯农药,很多持久性有机污染物具有致癌、致畸、致突变性,对人类生存繁衍和可持续发展构成重大威胁,对人类的影响会持续几代。POPs残效期长、降解缓慢,因此这些残留在环境中可能造成对新种植物或新储存食品等的再次污染[1-2]。酵母粉是以甜菜糖蜜原料,以化学物质为氮、磷、钾等营养源,经发酵罐有氧逐级扩大培养的产物[3]。有机持久污染物的存在不仅使酵母发酵过程中额外损耗原料,破坏原有营养条件,增加生产成本,而且严重影响酵母的品质、保存与应用,甚至会导致生产失败,给企业带来严重经济损失。
加速溶剂萃取 (Accelerated Solvent Extraction,ASE)是在一种高温度和高压条件下,设定溶剂和萃取时间,实现自动萃取的方法。该方法大大减少了溶剂用量,方法快速,回收率高,在实际工作中被广泛应用[4-10],已被美国国家环境保护局(EPA)收录为处理固体样品的标准方法之一[11]。QuEChERS技术以快速、简单、廉价、高效、耐用、安全著称,已广泛用于农药的检测[12-16]。本文作者结合实际检测工作需要,将ASE萃取和QuEChERS净化有效结合,利用GC-MS建立了高活性干酵母粉中12种有机持久污染物残留检测方法。本方法前处理操作简单、快速、对人体毒害性小、节省溶剂用量,各项检测指标均能满足国内外MRL要求。
1 材料
1.1 仪器和试剂
7890A-7975C型气相色谱-质谱联用仪 (配置7683系列自动进样器,增强型化学工作站),Agilent公司产品;ASE 350型加速溶剂萃取仪,美国Dionex公司产品;涡旋混合器,德国IKA公司产品;MG-2200型氮气吹扫浓缩装置,日本EYE公司产品;SK8210LHC超声波清洗器,上海科导超声仪器有限公司产品;AIIegra X-22R多功能台式冷冻离心机,美国贝克曼公司产品;RV10旋转蒸发仪,德国IKA公司产品。
乙腈、正己烷、甲醇、丙酮(均为色谱纯),TEDIA天地试剂公司产品;C18散装吸附剂、N-丙基乙二胺粉(PSA)、氨丙基粉(均为粒径 40 μm),Agilent公司产品;标准品:六氯苯、α-666、β-666、δ-666、p,p′-DDE、狄试剂、γ-666、七氯、艾氏剂、o,p′-DDD、o,p′-DDT、p,p′-DDT (纯度>98.5%), 均购自德国 Dr Ehrenstorfer公司产品。
标准溶液的配制:称取各标准品适量,将标准品以丙酮配制成1 000 μg/mL的标准储备液,置于4℃冰箱保存,做样时将此溶液依次用正己烷稀释成 0.025、0.100、0.200、0.500、1.00、2.50 μg/mL 的系列质量浓度混合标准工作溶液。
1.2 色谱和质谱条件
色谱条件:DB-1701石英毛细管柱 (30 m×0.25 mm×0.25 μm);载气:高纯氦气(纯度>99.999%),流速为1 mL/min;脉冲压力为206.8 kPa,脉冲时间0.75 min,吹扫时间 1 min;进样口温度:260℃;柱升温程序:初始温度70℃保持1 min,以20℃/min升温至270℃,保持12.5 min;进样方式为不分流进样,进样量 1 μL。
质谱条件:离子源EI(70 eV);离子源温度230℃;四极杆温度150℃;辅助加热器温度:280℃;溶剂延迟:7 min;采集方式:选择离子监测(SIM),条件参见表1。
1.3 加速溶剂萃取(AES)条件
以乙腈为提取剂,系统压力为1 500 psi,温度80℃,静态萃取9 min,循环次数1次,冲洗体积为34 mL不锈钢萃取池的60%,氮气吹扫时间60 s。

表1 12种POPs的保留时间和特征离子Table 1 Retention times and Selected ions of 12 POPs
1.4 样品提取与净化
提取:准确称高活性干酵母粉取5.0 g、4.0 g硅藻土混合均匀,全部转入34 mL萃取池中(池底部铺专用滤膜),按照1.3萃取条件提取。
净化:将提取溶剂转移至入鸡心瓶中于50℃下旋蒸近干,用正己烷定容至10.0 mL,移取8.0 mL于15 mL离心管中加入50 mg PSA,涡旋,离心,吸取上清液5.0 mL置于具塞试管中,氮吹近干,用正已烷准确定容至1.0 mL,旋涡混合混匀,供气相色谱-质谱测定。
2 结果与讨论
2.1 提取温度的选择
以乙腈为提取溶剂,静态萃取时间为9 min时,比较了 30、50、70、80、90 ℃ 5 种温度条件下的萃取效果,30℃时部分有机持久性污染物的回收率达不到检测要求,α-666的回收率仅为48.0%;随着温度的增高,大部分的有机持久性污染物回收率逐渐上升,当温度达到80℃时,除α-666外12种POPs的回收率不再上升,回收率范围在74.5%~111.7%;然而当提取温度为90℃时,虽然α-666的回收率有所改善,但基质干扰显著增加(不同提取温度下样品的色谱图见图1所示),故提取温度选择80℃。随着温度的增高,目标提取物分子和样品基体之间的作用力如范德华力、氢键减弱,加速了目标提取物分子的解析动力学过程,提取效果改善明显。
2.2 静态萃取时间的选择
以乙腈为提取溶剂,萃取温度为80℃时,进一步确定最佳的萃取时间,比较了静态萃取时间为3、6、9、12 min的提取效果。结果如图2所示,静态萃取时间小于6 min时,部分分析物的回收率达不到检测要求;当前萃取时间超过9 min时,12种分析物的回收率无明显的提升。综合考虑,静态萃取9 min可满足分析测试的需求,故选择静态萃取时间为9 min。
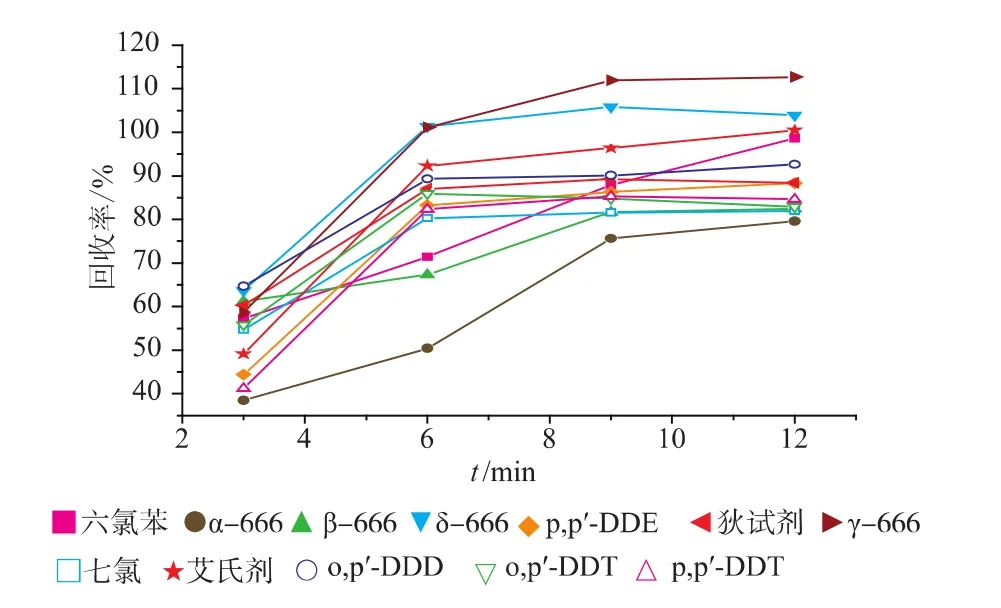
图2 静态萃取时间的影响Fig.2 Effect of static extraction time
2.3 循环次数
增加萃取循环次数,目标物的回收率增加,当循环次数为1次时,目标物的回收率达到检测要求,再增加循环次数会增加萃取时间,浪费溶剂,因此循环次数选择1次。
2.4 净化条件的选择
活性干酵母富含蛋白质、脂肪、维生素、糖等物质,这些物质会严重干扰目标分析物的测定[17-18],在QuEChERS净化方法中,PSA、C18及石墨化炭黑(GCB)是常用的吸附剂。其中PSA吸附在硅胶键合了乙二胺-N-丙基官能团,主要作用力是极性相互作用及弱阴离子交换作用,可去除提取液中的脂类和糖类物质,去除色素、甾醇和维生素效果一般,C18具有良好的除脂能力。
按照1.4处理样品,经实验比较了未净化、50 mg氨丙基粉、100 mg氨丙基粉、50 mg PSA、100 mg PSA、200 mg PSA、50 mg C18+100 mg PSA 净化时的效果。如图3所示,加入净化剂均能改善样品基质干扰,加入 100 mg氨丙基粉、200 mg PSA、50 mg C18+50 mg PSA在12.5~13.5 min谱图基线起伏,结合加标回收率结果如图4所示,加入氨丙基粉净化α-666回收率偏低;加入50 mg C18+50 mg PSA净化 p,p′-DDT的回收率仅为43.8%;加入PSA的量增加,p,p′-DDT的回收率降低较明显;加入50 mg PSA时12种POPs的回收率在74.5%~111.7%,能达到较好的净化效果,故确定添加50 mg PSA净化。
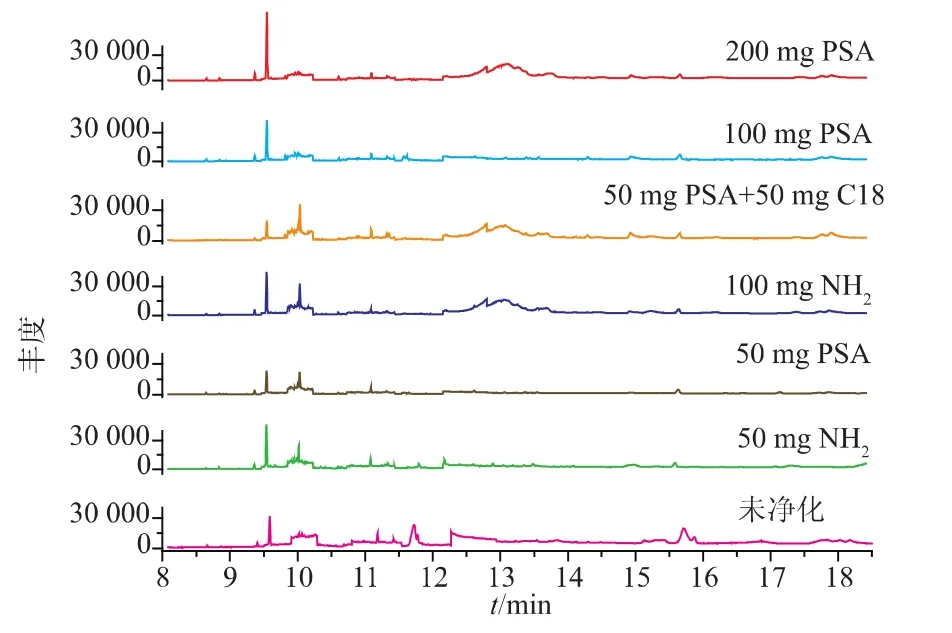
图3 高活性干酵母粉样品不使用及使用不同净化剂的提取效果图Fig.3 Chromatogram of purification by without or using differents purification in highly active dry yeast powder
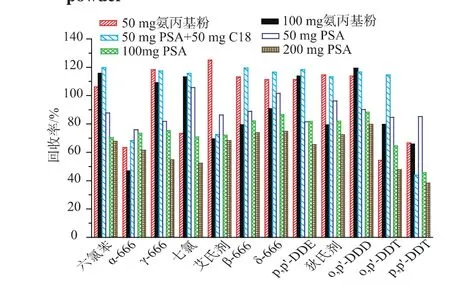
图4 高效活性干酵母粉中添加12种POPs不同净化方式的回收率Fig.4 Recoveries of 12 POPs spiked in highly active dry yeast powder using different purification method
2.5 线性关系与检出限
配制12种有机持久性污染物的系列混合标准溶液,浓度在0.025~2.5 μg/mL之间,以峰面积对质量浓度作线性回归,绘制标准曲线,12种POPs线性相关系数R2≥0.992。以信噪比(S/N)≥3时确定方法的检出限,12种POPs的检出限在0.002~0.009 mg/kg,线性系数、方法检出限详见表2。图5为高活性干酵母粉中添加12种POPs的选择离子(SIM)色谱图。
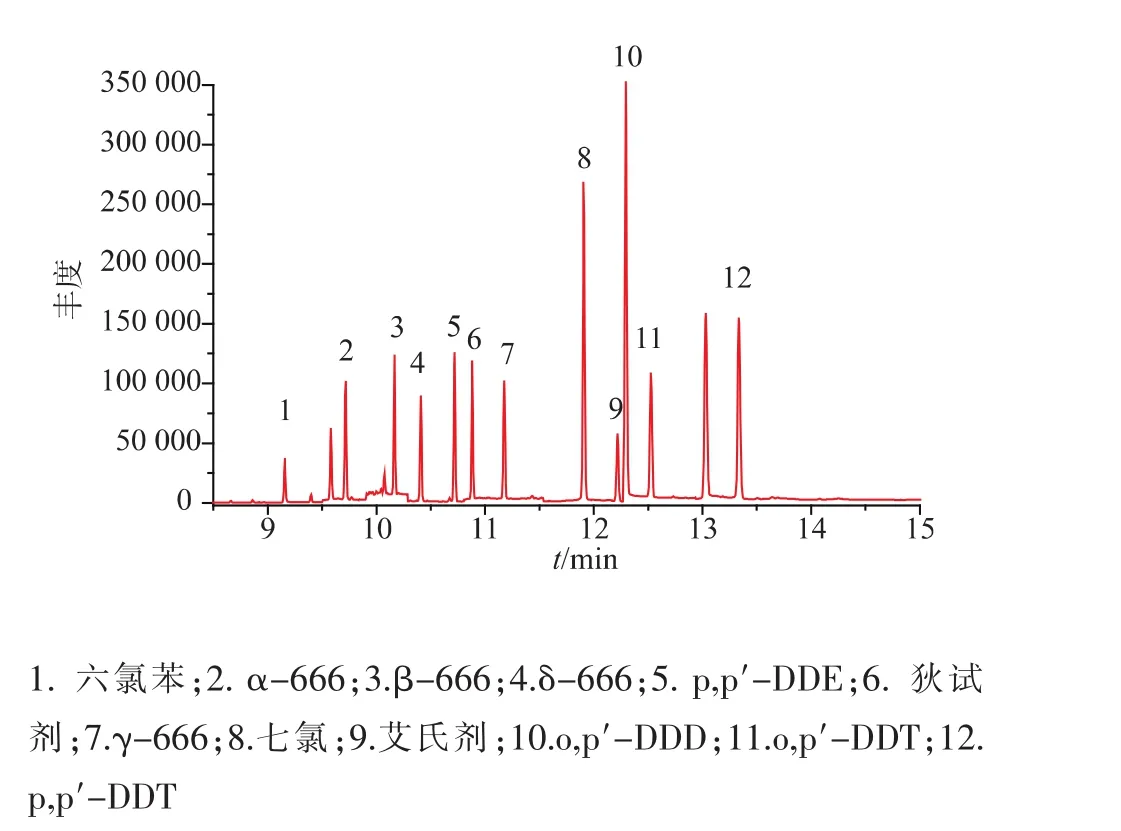
图5 高效活性干酵母粉中添加持久有机12种POPs的SIM色谱图Fig.5 SIM Chromatogram of 12 POPs spiked in Highly active dry yeast powder
2.6 回收率和精密度
按照1.4,用高活性干酵母粉样品进行加标回收试验,每个水平6次重复,3个加标水平添加质量浓度分别为 0.05、0.25、1.00 mg/kg,12 种 POPs的回收率在74.5%~111.7%之间,见表3。
2.7 实际样品分析
应用本方法对36批高活性干酵母中上述12种有机持久污染物进行分析,结果均未检出目标分析物,应用本方法能有效降低基质干扰,加标回收率良好,满足实际样品分析的要求。
3 结 语
本文中建立了QuEChERS-加速溶剂萃取测定高活性干酵母粉中12种有机持久污染物的气相色谱-质谱联用(GC-MS)分析方法,应用该方法进行对高活性干酵母粉进行加标回收实验,标回收率为74.5%~111.7%,相对标准偏差为3.1%~11.3%,结果表明,此方法操作简便、快速、节省溶剂、加标回收率良好、方法稳定,能有效降低基质干扰,能够满足实际样品分析的要求。

表2 12种POPs的线性方程、相关系数、检出限Table 2 Linear equations,correlation coefficients and LODs of 12 POPs(n=6)

表3 高活性干酵母粉中添加12种POPs的平均回收率(n=6)Table 3 Average recoveries and RSDs of 12 POPs spiked in highly active dry yeast powder(n=6)
参考文献:
[1]YOU Yuanhang,QI Shihua,YE Qin,et al.Advances in study of organochlorine pesticides’ residue in soils[J].Resource Environment&Engineering,2005,19(2):115-119.(in Chinese)
[2]王大宁,董益阳,邹明强,等.农药残留检测与监控技术[M].北京:化学工业出版社,2006:468.
[3]刘绪斌,武运,孟茹,等.酵母生产技术及安全性检测分析[M].北京:中国质检出版社,中国标注出版社,2014:2-3.
[4]WANG Yao,LIU Shaobin,XIE Cuimei,et al.Determination of organophosphate pesticide residues in salt fish using accelerated solvent extraction and gel permeation chromatography/solid phase extraction with gas chromatography-mass spectrometry[J].Chinese Journal of Analytical Chemistry,2011,39(1):67-71.(in Chinese)
[5]XU Dunming,LU Shengyu,CHEN Dajie,et al.Determination of ten pesticides of pyrazoles and pyrroles in tea by accelerated solvent extraction coupled with gas chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography,2013,31(3):218-220.(in Chinese)
[6]CHEN Qirong,LANG Shuang,WEI Yan,et al.Determination of 15 organochlorine pesticides in soil by gas chromatographymass spectrometry with accelerated solvent extraction and gel permeation chromatograph[J].Journal Instrumtal Analysis,2010,29(5):473-477.(in Chinese)
[7]OUYANG Yunfu,TANG Hongbing,WU Ying.Rapid determination of pesticide multiresidues in vegetables and fruits by accelerated solvent extraction coupled with online gel permeation chromatography-gas chromatography-mass spectrometry[J].Chinese Journal of Chromatography,2012,30(7):654-659.(in Chinese)
[8]WANG Na.Determination of polycyclic aromatic hydrocarbons and organochlorine pesticides in Soil by ASE-SPE and gas chromatography accelerated solvent extraction[J].Environmental Chemistry,2013,32(3):524-525.(in Chinese)
[9]WANG Daowei,ZHAO Shiming,JIN Wei,et al.Determination of polychlorinated biphenyls and polycyclic aromatic hydrocarbons in Soil by ASE-SPE and gas chromatography accelerated solvent extraction[J].Chinese Journal of Analytical Chemistry,2013,41(6):861-868.(in Chinese)
[10]GUI Jianye,WEI Fuxiang,QI Jixiang,et al.Simultaneous determination of organochlorine pesticides and acid herbicides in soil by in situ derivatization method with accelerated solvent extraction[J].Chinese Journal of Analytical Chemistry,2011,39(12):1877-1881.(in Chinese)
[11]EPA SW-846.Method 3545A pressurized fluid extraction[S].United States:United StatesEnvironmentalProtection Agency(EPA),2000.
[12]WANG Lianzhu,ZHOU Yu,CHEN Yong,et al.Evaluation of QuEChERS methods for the analysis of 66 organophosphorus pesticide residues in vegetables by liquid chromatography-tandem[J].Chinese Journal of Chromatography,2012,30(2):146-153.(in Chinese)
[13]JESSICA L W,FRANDK L D.QuEChERS extraction of benzodiazepines in biological matrices[J].Journal of Pharmaceutical Analysis,2013,3(6)509-517.
[14]ENOCK D,CHRISTOPHER G,DERICK C,et al.Fomsgaard.Quantification of neonicotinoid insecticide residues in soils from cocoa plantations using a QuEChERS extraction procedure and LC-MS/MS[J].Science of The Total Environment,2014,499:276-283.
[15]XU R,WUA J W,LIUC Y G.Analysis of pesticide residues using the quick easy cheap effective rugged and safe(QuEChERS)pesticide multiresidue method in traditional Chinese medicine by gas chromatography with electron capture detection[J].Chemosphere,2011,84(7):908-912.
[16]JONAS D S S,RUBENS C D C,GILLIANE D A A,et al.Evaluation of an analytical methodology using QuEChERS and GC-SQ/MS for the investigation of the level of pesticide residues in Brazilian melons[J].Food Chemistry,2013,141(3):2675-2681.
[17]BI Ruifeng,FAN Zhixian,FU Meng.Determination of aflatoxins in cashew by high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography,2011,29(12):1155-1159.(in Chinese)
[18]PENG Xiaojun,ZENG Yi,PANG Jinshan,et al.Determination of aflatoxin B1,M1 in foods using homemade mixed solid phase extraction column coupled with high performance liquid chromatography[J].Journal of Instrummental Analysis,2013,32(8):958-962.(in Chinese)

