诺丽发酵果汁中总香豆素质量浓度的测定
梁寒峭, 陈建国, 张 露, 程 池
(中国食品发酵工业研究院 中国工业微生物菌种保藏管理中心,北京100015)
已有研究表明多酚类物质是诺丽植物中重要的活性成分,在发酵果汁中的质量浓度可达1.14 mg/mL[5]。目前从诺丽果实、根、茎和叶中分离得到酚类化合物主要有黄酮类、香豆素类、木脂素类和酚酸类,其中香豆素是一类具有抗肿瘤,抗炎,抗病毒,保肝及抑制血小板活化因子(PAF)等生理活性的成分[6]。研究报道从诺丽果实中分离得到香豆素类成分如东莨菪亭(scopoletin)、异东莨菪亭(isoscopoletin)、东莨菪苷(scopolin)对脂肪氧合酶和低密度脂蛋白氧化反应具有明显地抑制作用,并且对黑色素的生成也具有抑制活性[7-9],此外从诺丽叶中也分离得到了香豆素类成分pteryxin和peucedanocoumarin III[10],但目前仍未见诺丽发酵果汁中香豆素成分含量的文献报道。因此本研究建立了香豆素成分含量的测定方法,并对不同发酵时间的诺丽果汁样品进行了含量的测定与比较。
1 材料与方法
1.1 仪器与材料
UNICO-JV2000紫外分光光度计,北京五洲东方科技发展有限公司产品:AB204-N万分之一电子天平,瑞士梅特勒仪器有限公司产品;电子天平,METTLER-TOLEDO公司产品;离心机,Eppendorff公司产品。
诺丽发酵果汁由海南诺尼生物工程开发有限公司提供;东莨菪内酯对照品由北京盈泽纳新化工技术研究院提供(批号14081804),甲醇、乙醇等其它试剂均为分析纯,北京化工厂生产。
1.2 样品溶液的制备
精密量取样品10.0 mL,置于100 mL的容量瓶中,用甲醇稀释至刻度,摇匀,精密移取31.25 mL置于100 mL的容量瓶中,加甲醇稀释至刻度,摇匀离心,上清液即得样品溶液。
1.3 对照品溶液的制备
精密称取东莨菪内酯(scopoletin)对照品11.20 mg置于50 mL的容量瓶中,用甲醇溶解,制成母液。精密移取3 mL母液置于10 mL的容量瓶中,加甲醇稀释至刻度,即得标准溶液。
2 结果与讨论
2.1 测定波长的选择
吸取对照品溶液和样品溶液在190~400 nm波长范围内进行扫描,结果见图1和图2。
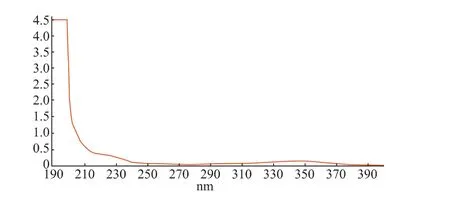
图1 对照品溶液吸收光谱Fig.1 Absorption spectrum of reference
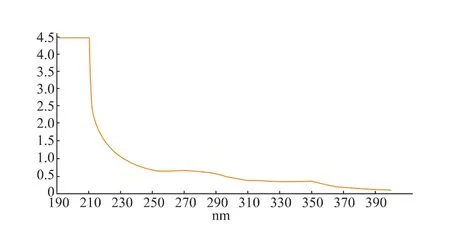
图2 样品溶液吸收光谱Fig.2 Absorption spectrum of sample
由上图可知,对照品溶液和样品溶液在348 nm处都有最大吸收峰,因此确定348 nm为测定波长。
(1)将配置好的黑色橡胶混合料运至摊铺区域,开始人工摊铺,控制好摊铺速度,以确保塑胶面层的密实度和平整度,将搅拌好的黑色橡胶颗粒用送料车送到铺设地点,用刮尺摊铺,均匀摊平。
2.2 线性关系考察
精密吸取东莨菪内酯标准溶液 0.5、1.0、2.0、3.0、4.0、5.0、6.0 mL 分别置于 10 mL 的容量瓶中,加甲醇稀释至刻度,配制成系列质量浓度的对照品溶液,在348 nm处进行测定,并以吸光度(y)对质量浓度(x)进行线性回归,绘制标准曲线,得回归方程:y=0.067 7x+0.019 8(r=0.999 2),结果表明对照品在0~0.020 mg/mL具有良好的线性关系。
2.3 精密度试验
取1.2项下制备的样品溶液,以甲醇为空白对照,连续6次测定其在348 nm处的吸光度,计算RSD为0.16%,表明仪器精密度良好。
2.4 重复性试验
取1.2项下制备的样品溶液,以甲醇为空白对照,在348 nm处测定吸光度,测得其吸光度并计算RSD值为1.88%,表明样品的重复性良好(n=6)。
2.5 稳定性试验
精密吸取东莨菪内酯对照品溶液,分别在0、10、20、40、80、120、240 min 时 348 nm 处进行紫外测定,测得吸光度并计算RSD值为0.62%,表明对照品在240 min内的稳定性良好。取1.2项下制备的样品溶液,分别在 0、10、20、40、80、120、240 min,以甲醇为空白对照,在348 nm处测定吸光度,测得其吸光度并计算RSD值为1.34%,结果表明样品在240 min内的稳定性良好。
2.6 加样回收率的考察
精密量取1.2项下所配样品溶液9份,各1.0 mL分别置于5 mL的容量瓶中,精密量取对照品标准液1.00 mL(0.067 2 mg),1.35 mL(0.090 7 mg),1.60 mL(0.107 5 mg)3个水平各3份加入样品溶液中,加甲醇稀释至刻度,并以甲醇为空白对照,在348 nm处测定吸光度,由标准曲线计算平均回收率为102.44%,RSD为1.81%,结果见表1,表明该测定方法准确可靠。
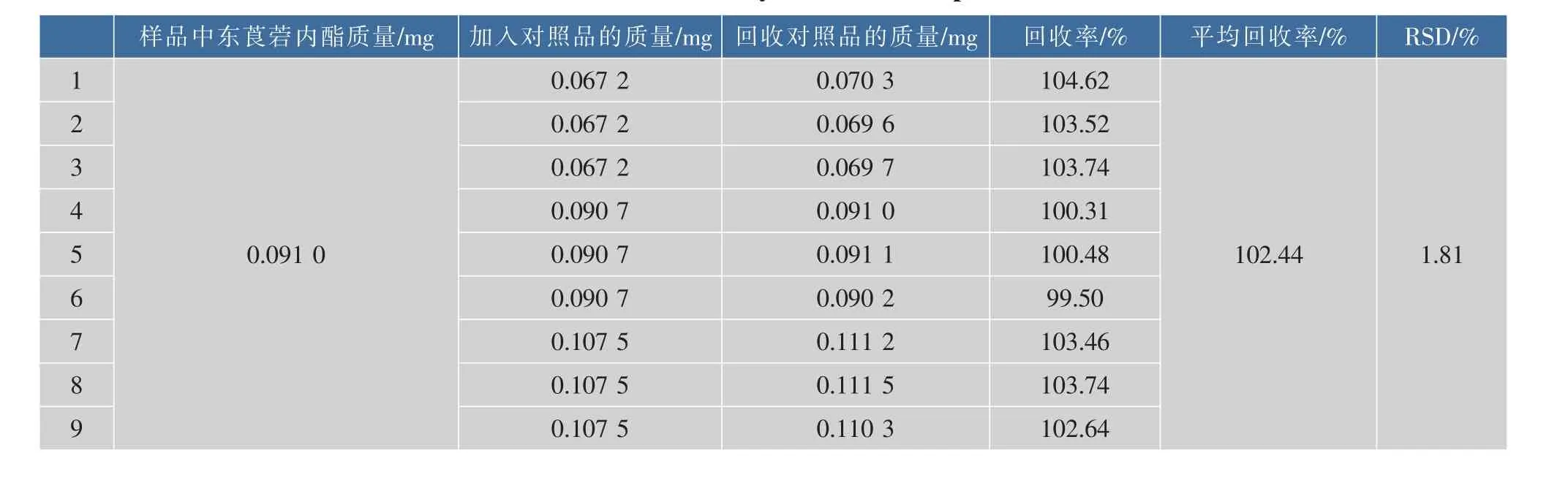
表1 样品加样回收率试验结果Table 1 Recovery test of the samples
2.7 样品测定
精密量取4个不同发酵时间的诺丽果汁样品,按照1.2项下方法制备供试品溶液,以甲醇为空白对照,在348 nm处测定吸光度,由标准曲线计算香豆素质量浓度。发酵25 d至500 d的诺丽果汁中香豆素质量浓度在17.59~24.26 mg/dL范围内,结果见表2。

表2 不同发酵时间诺丽果汁的香豆素质量浓度结果Table 2 Coumarins content in Noni jucie with different fermented time
3 结语
本实验建立的紫外分光光度法测定诺丽发酵果汁中总香豆素质量浓度的方法简便快捷且稳定可靠,适用于液体类样品中香豆素成分质量浓度的检测。
前期文献报道诺丽植物中所含香豆素主要为吡喃型香豆素,已分离得到东莨菪内酯、异东莨菪内酯、东莨菪苷,东莨菪内酯具有解热、舒张血管和抑制PC3细胞增殖与诱导凋亡等生理活性[11-13],是诺丽发酵果汁中的一类重要活性物质。本研究结果显示诺丽发酵果汁中香豆素成分的质量浓度随发酵时间的增长变化不大,表明此类成分在发酵过程中较稳定。本研究为后期诺丽发酵工艺的研究及相关生产的质量控制奠定了理论基础。
参考文献:
[1]黄婧婧.海巴戟果化学成分研究及药理活性初步筛选[D].北京:北京协和医学院,2011.
[2]WANG M Y,WEST B J,JENSEN C J.Morinda citrifolia (Noni):a literature review and recent advances in Noni research[J].Acta Pharmacol Sin,2002,23:1127-1141.
[3]HIRAZUMI A,FURUSAWA E,CHOU C,et al.Immunomodulation contributes to the anticancer activity of Morinda citrifolia(noni) fruit juice[J].Proc West Pharmacol.Soc,1996,39:25-27.
[4]KAMIYA K,TANAKA Y,ENDANG H,et al.Chemical constituents of Morinda citrifolia fruits inhibit copper-induced low-density lipoprotein oxidation.[J].J Agric Food Chem,2004,22;52(19):5843-5848.
[5]CHEN Jianguo,LI Xue,LI Jinxia,et al.Determination of total polyphenol content in Xisha noni juice[J].Journal of Anhui Agri Sci,2014,42(29):10127-10128.(in Chinese)
[6]LIN C F,NI C L,HUANG Y L,et al.Lignans and anthraquinones from the fruits of Morinda citrifolia[J].Nat Prod Res,2007,21(13):1199-1204.
[7]SIDDIQUI S,SATTAR A,AHMAD F,et al.Isolation and structural elucidation of chemical constituents from the fruits of Morinda citrifolia Linn[J].Arch Pharm Res,2007,30(8):919-923.
[8]BEH H K,SEOW L J,ASMAWI M Z,et al.Anti-angiogenic activity of Morinda citrifolia extracts and its chemical constituents.[J].Nat Prod Res,2012,26(16):1492-1497
[9]DENG S,PALUK,WEST J,er al.Lipoxygenase inhibitory constituents of the fruits of noni(Morinda citrifolia) collected in Tahiti[J].Nat Prod,2007,70(5):859-862.
[10]TAKASHIMA J,IKEDA Y,KOMIYAMA K,et al.New constituents from the leaves of Morinda citrifolia[J].Chem Pharm Bull(Tokyo),2007,55(2):343-345.
[11]YANGKe,ZENGChunhui.Experimentalstudiesonantipyreticmechanismsofscpoletin[J].Chinese Journal of Drug Application and Monitoring,2006,3(27):24-27.(in Chinese)
[12]LIU Xueli,ZHANG Liang, FU Xinlu,et al.Effect of scopoletin on PC3 cell proliferation and apoptosis[J].Acta Pharmacol Sin,2001,22(10):929-933.(in Chinese)
[13]OLIVEIRA J,ROMERO A,SILVA S,et al.Intracellularcalcium mobilization as a target for the spasmolytic action of scopoletin[J].Planta Med,2001,67(7):605-608.

