醋酸棉酚诱导三株宫颈癌细胞DNA双链断裂研究
何人可, 汤小玲, 冉晨曦, 钟建斌, 马 影, 聂 聪, 赵 晋, 郭 忠
(西北民族大学 医学院,甘肃 兰州730030)
棉酚(gossypol)是一种天然黄色多酚羟基双萘醛类化合物,主要存在于锦葵科植物棉花的根、茎和种子中。目前棉酚制剂主要有3种:醋酸棉酚、精制棉酚及甲酸棉酚[1]。棉酚最初作为男性避孕药广泛运用于临床。而近年来研究表明,醋酸棉酚(gossypol acetic acid,GAA)具有很显著的抗肿瘤活性,对多种肿瘤细胞系如宫颈癌、结肠癌、淋巴癌等产生抑制肿瘤细胞增殖并引起DNA损伤。抗肿瘤药物可以引起DNA损伤,其中,DNA双链断裂(double strand break,DSB)是最严重的,常常导致染色体畸变和细胞死亡[2]。本课题组的前期研究成果也证实了醋酸棉酚能够诱导人粘液表皮样癌MEC-1细胞DNA双链断裂[8]。
宫颈癌是女性常见的恶性肿瘤,据2012年报道,全球女性有宫颈癌52.8万病例,26.6万例死亡。尤其是发展中国家,宫颈癌发病率呈上升和年轻化趋势,占全球宫颈癌发病的80%,严重威胁着广大育龄妇女的健康和生命。人乳头瘤病毒(HPV)是宫颈上皮内瘤变(CIN)和宫颈癌的病原体,是最常见的性传播全球病毒感染[3-4]。
本研究中根据细胞种类和感染HPV(人乳头瘤病毒)16和HPV18的情况,分为宫颈腺癌Hela(HPV16-/HPV18+)、宫颈鳞癌 Siha(HPV16+/HPV18-)和 C-33A(HPV16-/HPV18-)[5]。本实验将不同浓度的GAA作用于这3株宫颈癌细胞,初步探讨其杀伤肿瘤细胞的DNA双链损伤机制,为GAA临床用于化学治疗宫颈癌提供实验依据。
1 材料与方法
1.1 材料与试剂
宫颈癌细胞系Hela、Siha、C-33A,购自中国科学院上海生科院细胞资源中心。GAA,陕西宏达植物化工有限公司产品;DMEM,美国Gibco公司产品;胎牛血清,兰州民海生物工程有限公司产品;MTT,美国Sigma公司产品;二甲基亚砜(DMSO),天津市德恩化学试剂有限公司产品;DAPI,美国Molecular probes公司产品;PI,美国lsbio公司产品;鼠抗γH2AX单克隆抗体,美国Upstate Technology公司产品;FITC标记山羊抗小鼠IgG,北京中山金桥生物技术有限公司产品,其余试剂均为国产分析纯。Olympus AX70荧光显微镜,日本Olympus公司产品;酶联免疫分析仪,美国Bio-Rad公司产品;DYY-6C型电泳仪,北京市六一仪器厂制造。
1.2 方法
1.2.1细胞培养及药物配制Hela、Siha、C-33A细胞在体积分数5%CO2、37℃的孵育箱中贴壁培养。培养基为含有体积分数10%灭活胎牛血清、抗生素(100 μg/L 青霉素和 100 μg/L 链霉素)的 DMEM。每3~4天传代一次,取对数生长期细胞用于实验。观察终浓度为 2.5、5、10、20、40、80、160 μmo1/L 的 GAA对宫颈癌细胞Hela、Siha、C-33A的作用。以未加药物组(control)作为对照。
1.2.2MTT细胞活性测定细胞培养同1.2.1方法,调整细胞浓度为2×108个/L,接种至6孔板中,每孔2 mL,置37℃孵箱孵育。培养24 h后,吸弃上清液,加入含 GAA(20 μmol/L)的新培养基,37 ℃、体积分数5%CO2继续培养,在不同时间点取出。在倒置显微镜下观察细胞形态。
取对数生长期的Hela、Siha、C-33A细胞,将细胞制成单细胞悬液后,调节细胞浓度至7×107个/L,按每孔100 μL接种到96孔板,每组设6个复孔。间隔8~12 h后,吸弃培养液,用含2.5~160 μmol/L GAA的新培养液处理细胞,同时设立空白对照和DMSO溶剂对照,37℃、体积分数5%CO2继续培养24、48 h和72 h后,每孔加入5 mg/mL MTT溶液20 μL,37℃继续孵育4 h,终止培养。小心吸弃孔内培养上清液,每孔加入150 μL DMSO,振荡10 min,使结晶物充分溶解。酶标仪上测定各孔490 nm的吸光度值(A490)。本实验重复3次。按下式计算出
细胞生长抑制率(%)=(1-M1/M0)×100%(1)式(1)中,M0为对照组吸光值平均值;M1为实验组吸光值平均值。
以Excel Forcast函数计算半数抑制浓度(IC50值)。
1.2.3中性单细胞凝胶电泳实验收集不同浓度GAA处理24 h以及用20 μmo1/LGAA处理不同时间的Hela、Siha、C-33A细胞进行中性单细胞凝胶电泳。
细胞计数:制成单细胞悬液,调整细胞浓度为4×107个/L。
制片:将50 μL 1 g/dL的低熔点琼脂糖凝胶(Agarose typeⅦ)均匀铺开于毛玻片上,室温下放置备用。将400 μL的细胞和1.2 mL 1 g/dL低熔点琼脂糖凝胶40℃下预热,混匀后迅速铺到第一层凝胶上(约1.4 mL),冰上固化3 min。
裂解:将载玻片浸没于新配制的预冷裂解液中(含0.4~0.5 mg/mL蛋白酶K,使用前加入),4℃裂解l h,小心移入37℃孵箱孵育18~20 h。
解旋:TBE漂洗载玻片3次,每次30 min。将载玻片静置于电泳槽中30 min。注意液面高于载玻片2 mm,避光。
电泳:调整缓冲液液面高度,使电压为16~18 V,电流约 7 mA,电泳 25 min。
染色:体积分数1%H2O2固定玻片10 min,双蒸水充分洗涤。PI(终质量浓度为5 μg/mL)染色30 min,置于密闭湿盒中,4℃保存。(在24 h内观察,以防止荧光淬灭)
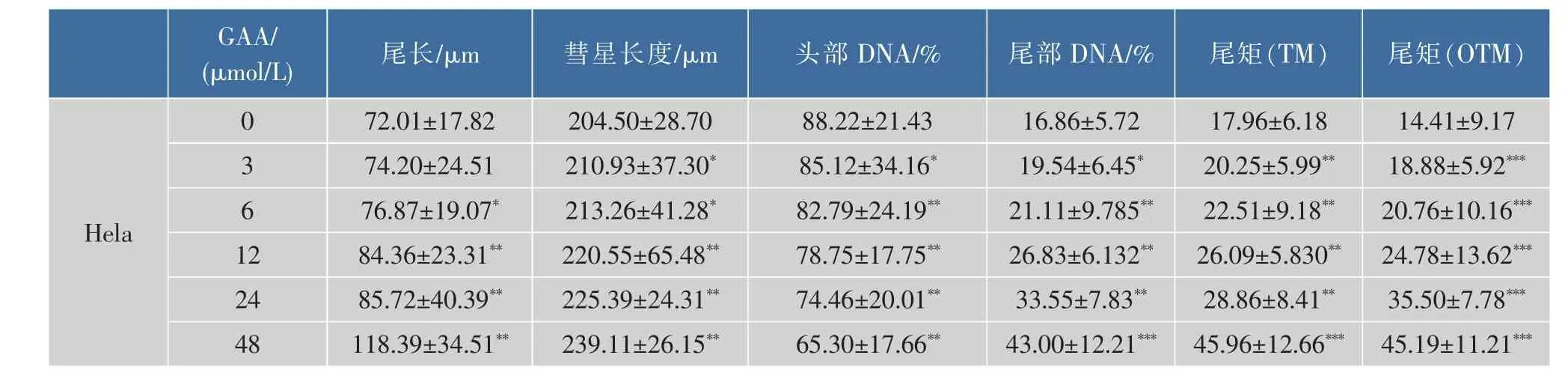
观察:在荧光显微镜(10×40 倍)紫外光(UV)的激发下,DNA图像呈橘红色。每个载玻片拍摄至少50个细胞,每个药物剂量3张片子。本实验重复3次。图片用CASP软件分析。计算尾长(Tail length)、头部DNA百分含量(Head DNA%),尾部DNA百分含量(Tail DNA)、尾矩(TM)和 Olive尾矩(OTM)等指标。TM定义为:迁移的平均距离与彗尾部DNA的分数的乘积。OTM计算方法:尾部光密度重心与头光密度重心之间的距离×尾部DNA百分含量[6]。
1.2.4免疫荧光染色
1) 细胞培养及处理:Hela、Siha、C-33A 细胞培养同1.2.1方法,调整细胞浓度为2×108个/L,各取35 mm×10 mm培养皿6个,取100 μL细胞悬液接种至已放有盖玻片上的 (盖玻片硫酸浸泡过夜,清洁后用体积分数95%乙醇浸泡后过火,预先放入培养皿中),置37℃孵箱孵育2 h。每个皿加入DMEM培养基2 mL,培养24 h后,吸去上清液,加入含GAA(20 μmol/L)的新培养基,继续培养。 37 ℃、体积分数5%CO2继续培养,在不同时间点取出。另外,用不同浓度GAA处理Hela、Siha、C-33A细胞24 h后取出。
2)免疫荧光染色检测γH2AX焦点:免疫荧光检测参照Macphail等[7]的方法,并稍作改动[8]。被处理的细胞到达时间点后,预冷的TBS洗涤2次;
固定:4 g/dL多聚甲醛固定20 min;TBS洗涤,5 min×3次;
破膜:体积分数0.2%Triton-X 100破膜,15 min;TBS 洗涤,5 min×3 次;
封闭:TTN 浸泡 10 min;PBS洗涤,5 min×3次;
孵一抗:TTN稀释鼠γH2AX单克隆一抗,体积比为 1∶500, 孵育过夜,TBS 洗涤,1 min×2 次;TTN洗涤1 min;
孵二抗:TTN稀释山羊抗鼠FITC-IgG,体积比为 1∶200,孵育 1 h,TBS 洗涤,5 min×3 次,避光;
染核:DAPI终质量浓度为 0.05 μg/mL,5 min,TBS 洗涤,5 min×3 次,注意避光;
封片:水性封片液封片,Olympus IX51荧光显微镜下观察;
γH2AX焦点定量按Daniel等的方法[9],用Image Pro Plus软件进行,γH2AX焦点定量计数,γH2AX焦点>5为阳性细胞。每张片子至少统计800个细胞。
数据统计:数据进行Fish student t检验。t检验,p<0.05,差异具有显著性。
1.2.5统计分析方法实验数据用mean±SEM表示,采用SPSS 19.0分析数据,单因素方差分析检验多组平均数之间的差别,P<0.05时认为差别具有统计学意义。
2 实验结果
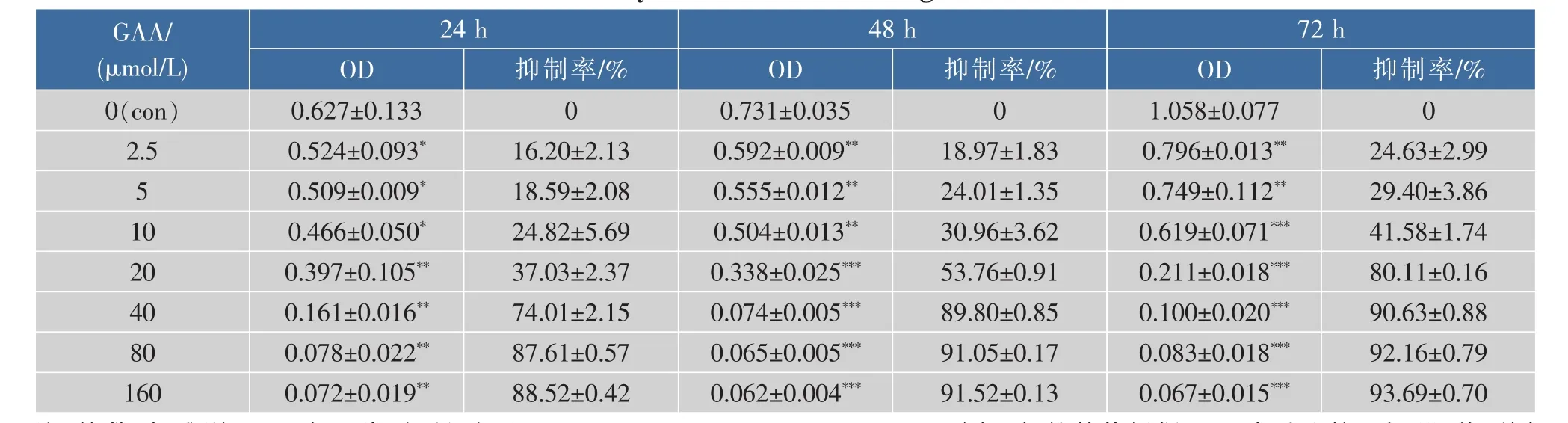
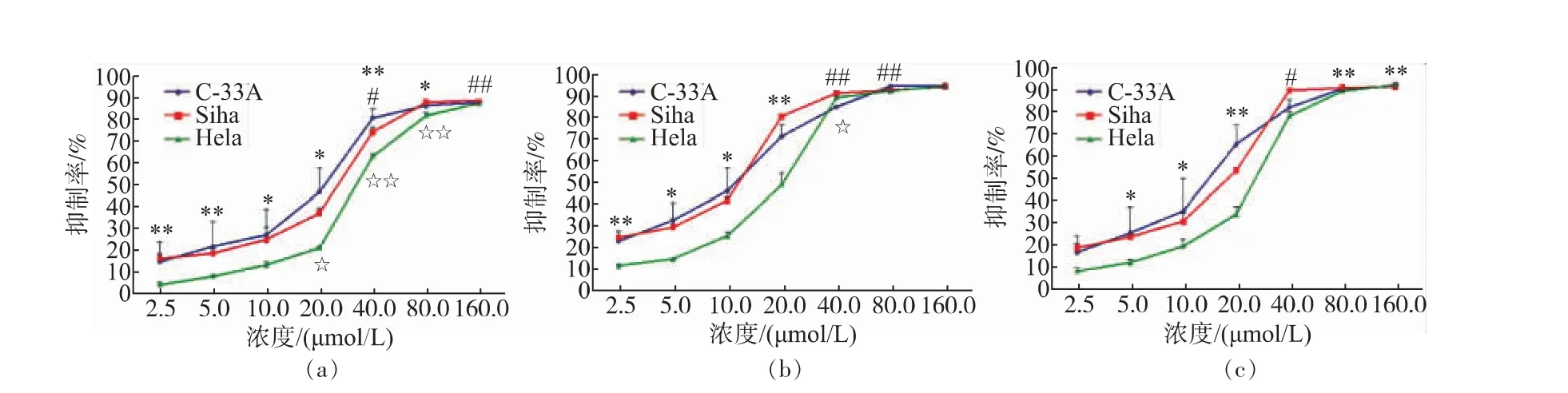
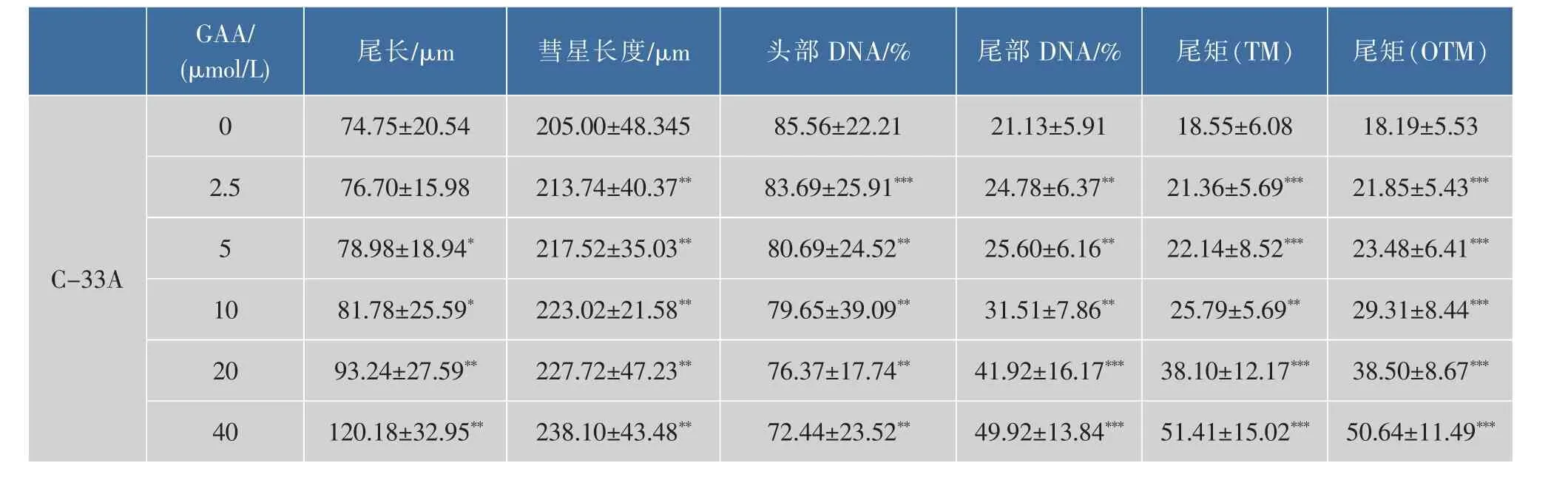
2.1 GAA对C-33A、Siha、Hela细胞增殖的影响
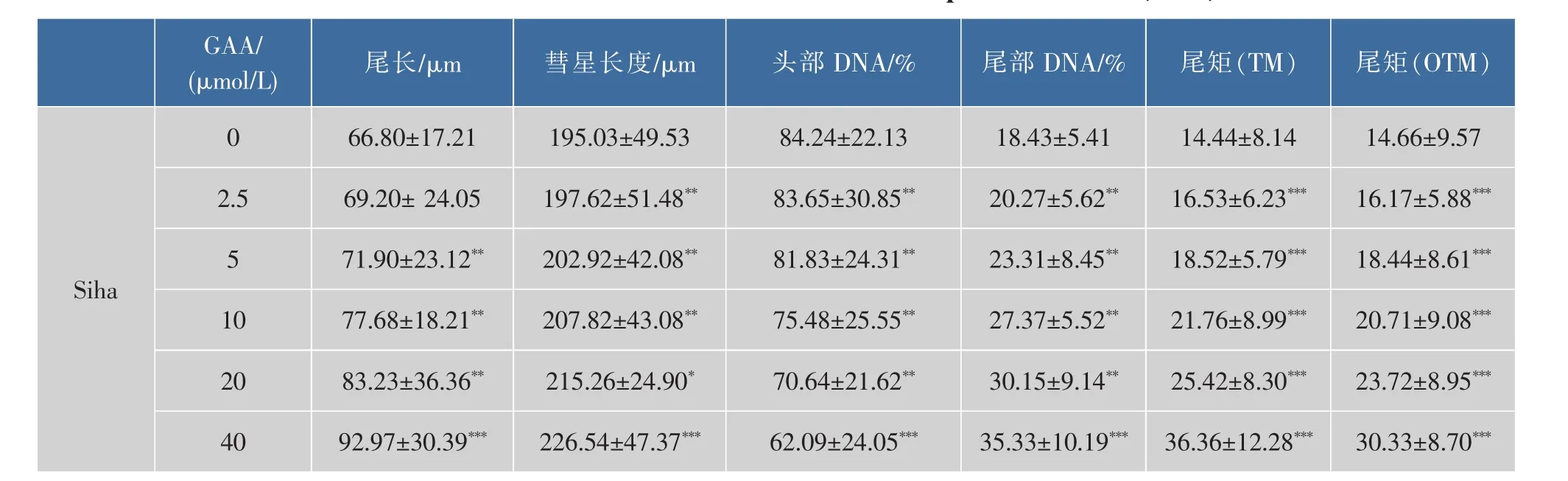
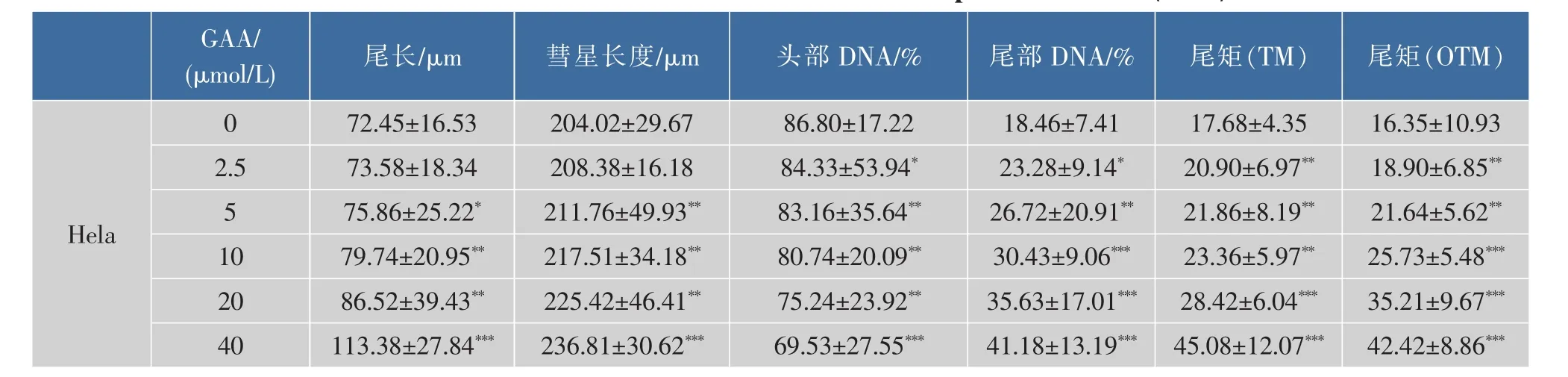
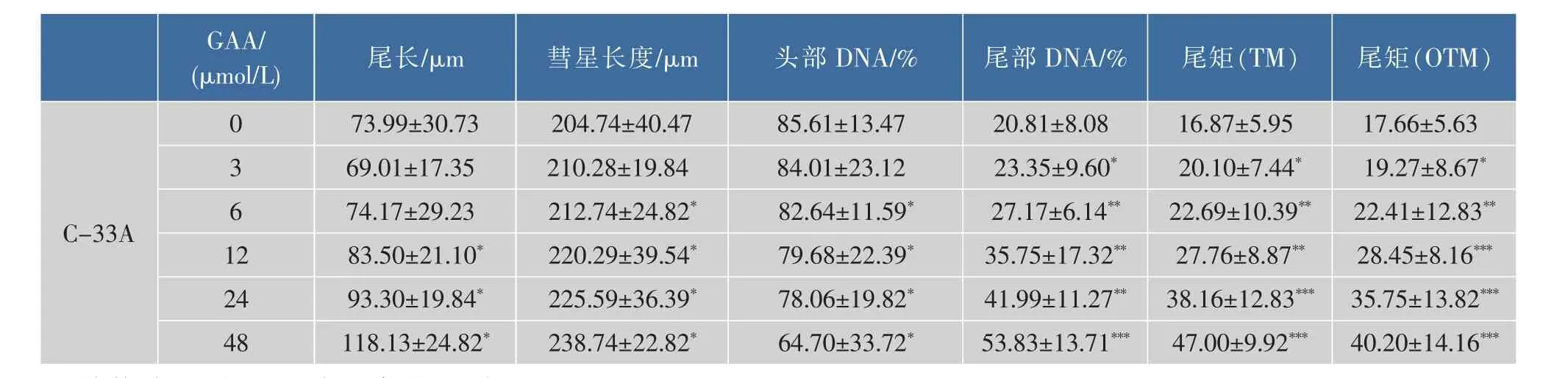
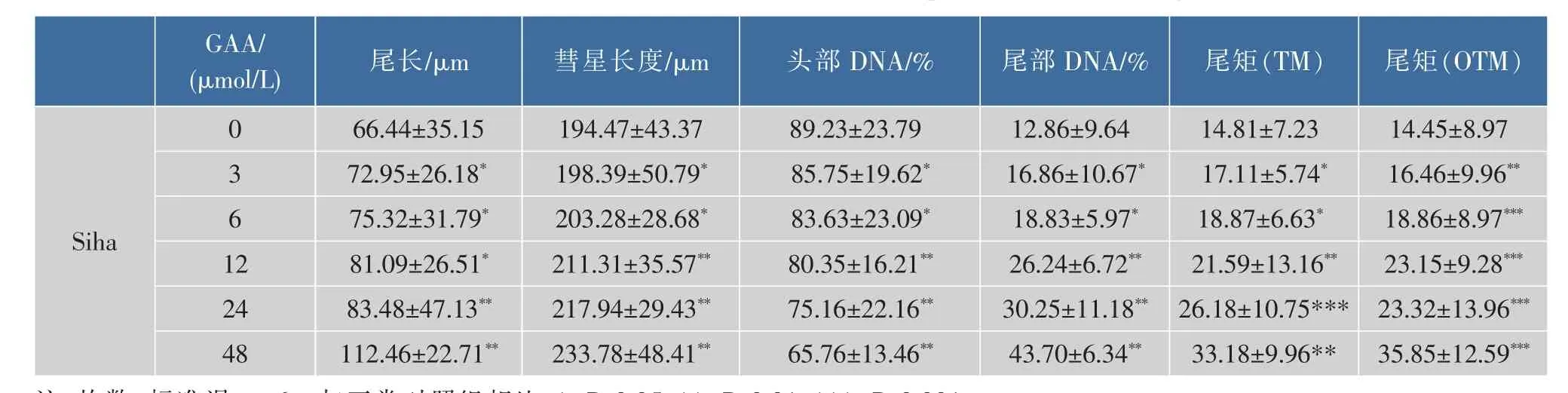
通过体外GAA药敏试验对肿瘤细胞进行加药培养,然后观察细胞形态的变化并用MTT法检测GAA对3种细胞的增殖抑制作用,并用抑制率(%)和IC50来表示。IC50是衡量细胞化疗敏感性的指标之一。它是指细胞存活率为50%时的药物浓度,IC50越大,化疗敏感性越低。2.5~160 μmol/L的浓度范围内GAA对Hela、Siha、C-33A细胞的生长呈明显的抑制作用,呈时间-浓度依赖性。GAA对Hela、Siha、C-33A细胞作用 24 h的 IC50分别为 60.64、48.37、43.27 μmol/L,48 h 的 IC50分 别 为 49.59、39.61、37.25 μmol/L,72 h 的 IC50分 别 为 43.29、37.40、32.68 μmol/L。实验结果发现,GAA能够明显抑制3种细胞的生长,IC50大小为C-33A 表1 GAA对C-33A细胞增殖的抑制作用Table 1 Inhibitory effect of GAA on the growth of C-33A cells 表2 GAA对Siha细胞增殖的抑制作用Table 2 Inhibitory effect of GAA on the growth of Siha cells 表3 GAA对Hela细胞增殖的抑制作用Table 3 Inhibitory effect of GAA on the growth of Hela cells 图1 GAA对C-33A、Siha、Hela细胞增殖抑制作用的差异性比较Fig.1 Difference comparison of inhibitory proliferation effect of GAA on C-33A、Siha and Hela cells 基于3株细胞IC50的数值,确定最佳药物干预浓度为20 μmol/L。选取20 μmol/L GAA处理后不同时间,观察细胞形态变化的时间依赖性。随着药物作用时间延长,越来越多的细胞皱缩、变圆、脱落。至48 h,细胞体积变小,大面积脱落,见图2。 图2 20 μmol/L GAA作用Hela细胞不同时间点形态学变化Fig.2 Effect of 20 μmol/L GAA on cellular morphology of Hela cells at different time 随着GAA浓度的增加 (作用24 h),Hela细胞头部DNA百分含量 (Head DNA%)降低,而尾长(Tail length)逐渐变长。 2.5~40 μmol/L 的 GAA 作用细胞24 h,或 20 μmol/LGAA分别作用 0~48 h,Hela、Siha、C-33A彗星细胞的头部DNA百分含量(Head DNA%)减少,尾长(Tail length)、彗星长度(LComet)、尾部 DNA 百分含量(Tail DNA%)、尾矩(TM)和 Olive尾矩(OTM)增加,说明 GAA对细胞DNA双链损伤程度呈浓度时间-依赖性 (图3,表4—表9)。其中,GAA对C-33A产生的DSB损伤最为严重,Siha次之,Hela最弱,但均明显(图4)。 观察免疫组织化学法结果,20 μmol/L的GAA作用3 h,细胞内即出现大量的绿色荧光焦点,且随着时间延长,焦点数越多,亮度也增强,48 h时达峰值(图 5)。 0~40 μmol/L 的 GAA 诱导 Hela、Siha、C-33A内H2AX发生磷酸化,形成焦点,且呈剂量-效应关系(P<0.05)。我们发现,在同一浓度、同一时间下,C-33A产生的焦点最多,而Hela是最少的(图6—图 8,P<0.05)。 宫颈癌是唯一病因明确、可以早期进行预防的癌症,但宫颈癌迄今仍是严重威胁妇女健康的常见恶性肿瘤之一,全球范围内其发病率居恶性肿瘤的发病率第三位,仅次于大肠癌和乳腺癌,其死亡率位居恶性肿瘤死亡率的第四位,仅次于大肠癌、肺癌和乳腺癌[9]。我国宫颈癌导致的患者死亡率从25岁开始呈持续上升趋势,在85岁达到顶峰。性生活混乱、早孕、多育、人口流动性增大,使妇女罹患宫颈癌的危险性随之增大[10]。 图3 GAA处理Hela细胞24 h的中性彗星图像Fig.3 Representative images from the neutral comet assay showing the effects of different concentrations of GAA on Hela cells at 24 h 表4 GAA诱导C-33A细胞DNA断裂的浓度效应(24 h)Table 4 GAA induces DSB in C-33A cells in a dose-dependent manner(24 h) 表5 GAA诱导Siha细胞DNA断裂的浓度效应(24 h)Table 5 GAA induced Siha cells DSB in a dose-dependent manner(24 h) 表6 GAA诱导Hela细胞DNA断裂的浓度效应(24 h)Table 6 GAA induced Hela cells DSB in a dose-dependent manner(24 h) 表7 GAA诱导C-33A细胞DNA断裂的时间效应(20 μmol/L)Table 7 GAA induced C-33A cells DSB in a time-dependent manner(20 μmol/L) 表8 GAA诱导Siha细胞DNA断裂的时间效应(20 μmol/L)Table 8 GAA induced Siha cells DSB in a time-dependent manner(20 μmol/L) 表9 GAA诱导Hela细胞DNA断裂的时间效应(20 μmol/L)Table 9 GAA induced Hela cells DSB in a time-dependent manner(20 μmol/L) 图4 GAA诱导C-33A、Siha、Hela细胞DNA断裂的浓度、时间效应的差异性比较(以Tail length为例)Fig.4 DNA damage difference comparison of dose and time effect of GAA on C-33A、Siha and Hela cells (Taking Tail length as an example) 图5 20 μmol/L GAA处理不同时间诱导Hela细胞γH2AX焦点形成Fig.5 Immunofluorescence staining of γH2AX foci in Hela cells treated with 20 μmol/L GAA for different time 图6 GAA诱导Hela、Siha、C-33A 细胞生成 γH2AX的浓度效应(24 h)Fig.6 GAA induces γH2AX foci in Hela、Siha、C-33A cells in a dose-dependent manner 图 7 GAA(20 μmol/L)诱导 Hela、Siha、C-33A 细胞生成γH2AX的时间效应Fig.7 GAA (20 μmol/L)induces γH2AX foci in Hela、Siha、C-33A cells in a time-dependent manner 图8 GAA诱导Hela、Siha、C-33A细胞γH2AX焦点的形成差异性比较Fig.8 Difference comparison of foci formation of GAA on C-33A、Siha and Hela cells 无论是外源性的物理因素 (电离辐射、紫外线)、化学因素(化疗药物),还是内源性的代谢产物,都能引起DNA双链断裂损伤,且这些损伤均能引起组蛋白H2AX发生磷酸化。当轻微损伤时,细胞的细胞周期检查点发生停滞,DNA会对损伤进行有效的修复;当损伤过度时,则会激发细胞启动凋亡程序,造成细胞凋亡。而其中,DNA断裂是损伤最严重的一种[11]。 本研究中采用3株同源细胞株:Hela、Siha、C-33A为研究对象,用MTT(Methyl Thiazolyl Tetrazolium)比色法和单细胞凝胶电泳(SCGE)分别对3株宫颈癌细胞的化疗敏感性与DNA损伤进行评估,并将SCGE与以γH2AX为指标的免疫组织化学染色的结果进行比较,探讨将γH2AX做为一个潜在的分子靶点,增加肿瘤细胞对化疗的敏感性,提高化疗治癌疗效的可能性。 我们知道,棉酚作为一种多酚类化合物,体外实验证实其具有抑制肿瘤细胞增殖及诱导细胞凋亡的作用[11]。它可以通过多种方式和分子靶向对肿瘤细胞进行抑制增殖和(或)诱导凋亡,包括通过直接损伤线粒体抑制细胞能量代谢,调低细胞周期调节蛋白Rb和cyclinD1蛋白的表达,抑制蛋白激酶C活性,调节多元耐药基因的表达等[12]。本研究通过MTT法检测表明,在2.5~160 μmol/L浓度范围内,GAA对宫颈癌细胞的生长具有明显的抑制作用,在对 C-33A,Siha,Hela 3 株细胞的作用中,对 HPV(-)的C33A细胞的生长抑制作用最为明显。在HPV(+)的2种细胞中,对Siha的抑制作用较Hela细胞明显,这可能与GAA对宫颈鳞癌的抑制作用强于宫颈腺癌有关。 检测DNA损伤的方法有很多,比如荧光原位杂交、彗星试验、高效毛细管电泳、序列凝胶电泳等[7]。但为了更准确地通过DNA损伤程度来反应肿瘤内在敏感性,选取2个或多个生物标志物联合测定是明智的[13]。本研究借助中性彗星电泳和免疫细胞化学法同时检测DSB。γH2AX焦点与DSB的数量关系呈一一对应关系,γH2AX抗体荧光染色是检测DSB存在的金标准[14]。H2AX磷酸化形成γH2AX其实是一种保护机制,其主要功能是维持DNA损伤修复应答分子持续地聚集在损伤位点周围,从而间接修复DNA损伤[15]。所以,γH2AX可作为一个非常敏感的指标来评价各种原因所致的DNA损伤程度。相比于传统的DSBs的检测方法,细胞免疫化学法不仅能够判断DNA双链的断裂,还可以直观计数γH2AX的表达和斑点数,操作简便,而且灵敏度高,是可行、可靠、经济的检测DSBs的方法[16]。SCGE结果表明,GAA造成Hela、Siha、C-33A各细胞DNA双链断裂具有时间和浓度效应(P<0.05)。本实验采用 的 Tail length(μm)、Comet length (μm)、Head DNA (%)、Tail DNA (%)、Tail moment(TM)、Olive tail moment(OTM)等多项指标,能够对DNA的损伤情况有较为全面的观察。实验结果与MTT实验相符,3株细胞对化学药物的敏感性越强,所需干预浓度越低,而产生的DNA损伤效果越强。SCGE方法发现3株细胞在药物处理48 h(20 μmol/L)或浓度40 μmol/L(24 h)后 DNA 断裂最明显,差异有统计学意义。同时,我们引入γH2AX这个分子靶点进行DSB分析。免疫组织化学法结果与SAGE一致,即GAA有效地诱导了3株细胞DNA双链断裂,在同一浓度、同一时间下,C-33A产生的焦点最多,而Hela是最少的。另外我们知道,E6、E7是存在于高危型HPV16/18病毒DNA上的决定性基因片段,2个经典肿瘤抑制蛋白E6和E7通过与宿主细胞蛋白相互作用参与处理基因组稳定,细胞黏附,细胞增殖、凋亡,细胞周期,DNA修复,代谢,翻译和转录信号[17]。当GAA造成细胞DSBs时,可能破坏或删除了E6和E7基因且阻遏了E1和E2区域,导致其表达丧失,导致E6和E7表达水平增加[18-19],导致细胞周期、有丝分裂异常。另外,有研究将HPV16 E6抗核酶导入宫颈癌细胞可显著降低细胞的端粒酶活性,从而提高肿瘤细胞对化疗药物的敏感性,说明抑制HPV DNA的表达,可提高肿瘤的化疗敏感性[20]。同理,GAA可以通过抑制端粒酶活性和损伤DNA,提高两种HPV阳性细胞Siha和Hela的化疗敏感性,故二者在相同浓度或相同时间作用下,产生的γH2AX比HPV阴性的C-33A更少。而宫颈鳞癌对GAA的敏感性强于宫颈腺癌,故Siha γH2AX阳性率高于Hela。 在药物损伤DNA后,若不能及时修复,DNA转录、复制无法进行,细胞从而走向凋亡。DNA断裂修复分为以ATM重组为主的同源性重组和以DNAPK(Ku70/Ku80 异二聚体、DNA-PKcs)为主的非同源重组(NHEJ)2 条途径[21]。 其中,NHEJ修复是人类最主要的途径,低浓度GAA具有抑制DNA双链断裂的修复和具有增强化疗敏感性的作用。有报道GAA诱导的MEC-1细胞 DNA双链断裂机制,有可能与NHEJ修复途径中的DNA-PKcs有关,其过程大概是Ku70与Ku80形成异二聚体,再附于受损的DNA末端,共同激活DNA-PKcs,最后完成修复[22]。 综上所述,近年来,棉酚作为一种抗肿瘤药物受到越来越多的关注,棉酚的抗肿瘤研究展现了其药用价值和临床应用的可能性,它引起的Hela、Siha、C-33A细胞DNA的断裂为它成为有效的抗癌药物提供了重要的理论依据。然而,引起双链断裂的机制并不是完全清楚。目前,有研究表明PI3K家族,包括DNA-PK,ATM和ATR参与了H2AX磷酸化的形成[23]。另外有研究表明,使用PI3K抑制剂渥曼青霉素作用细胞,再用IR处理后,γH2AX焦点形成急剧减少,提示H2AX的磷酸化是PI3K家族成员催化的[24]。随着对棉酚的DSB机制的不断研究和完善,为临床应用治疗肿瘤打下坚实的基础。 参考文献: [1]GUO Zhong,ZHAO Jin,MA Jianxiu.Progress in phamacological action of gossypol[J].Basic&Clinial Medicine,2010,30(1):93-96.(in Chinese) [2]TANAKA T,HALICKA H D,HUANG X,et al.Constitutive histone H2AX phosphorylation and ATM activation,the reporters of DNA damage by endogenous oxidants[J].Cell Cycle,2006,5(17):1940-1945. [3]SATTERWHITE C L,TORRONE E,MEITES E,et al.Sexually transmitted infections among US women and men:prevalence and incidence estimates 2008[J].Sex Transm Dis,2013,40(3):187-193. [4]Dennyl,Cytological screening for cervical cancer prevention[J].Brest Pract Res Clin Obstest Gynecol,2012,26(2):189-196. [5]ZHANG Z,KNOBLOCH T J,SEAMON L G,et al.A black raspberry extract inhibits proliferation and regulates apoptosis in cervical cancer cells[J].Gynecol Oncol,2011,123(2):401-406. [6]LIU Xiuling,WANG Li,JIANG Chunhua,et al.Effects of thiamine and riboflavin on H2O2-induced DNA oxidative damage[J].Shanghai Jiaotong Univ(Med Sci),2009,29(9):1049-1052.(in Chinese) [7]MACPHAIL S H,BANATH J P,YU Y,et al.Cell cycle-dependent expression of phosphorylated histone H2AX:reduced expression in unirradiated but not X-irradiated G1-phase cells[J].Radiat Res,2003,159(6):759-767. [8]GUO Zhong,ZHAO Jin,XUE Tongmin,et al.Gossypol acetic acid induces DNA double-strand breaks in human mucoepidermoid carcinoma cell MEC-1[J].Acta Physiologica Sinica,2011,63(2):164-170.(in Chinese) [9]DENNYL.Cervicalcancerprevention:newopportunitiesforprimaryandsecondarypreventioninthe21stcentury[J].Int J Gynecol Obstet,2012,119(Suppl 1):80-84. [10]QIAO Youlin,ZHAO Yuqian.Epidemiologyand prevention ofcervical cancer[J].Chinese Journal of Obstetrics&Gynecology and Pediatrics(Electronic Edition),2015,11(2):141-147.(in Chinese) [11]GONG Ping,WANG Yuli,JIANG Ling,et al.Study on the effect of gossypol combined with radiotherapy in inducing apoptosis of human cervical carcinoma HeLa cells[J].Tumor,2009,29(9):838-841.(in Chinese) [12]WANG Yuli.Research progress in gossypol for anti-cancer[J].China Cancer,2008,17(7):576-579.(in Chinese) [13]ZHANG Yipei,CAO Jia,WANG Yan,et al.Radiosensitivity evalution of human tumor cell lines by single cell gel electroresis[J].Chin J Radiol Health,2011,20(3):259-261.(in Chinese) [14]ROTHKAMM K,LOBRICH M.Evidence for a lack of DNA double-strand break repair in human cells exposed to very low X-ray doses[J].Proc Natl Acad Sci USA,2003,100(9):5057-5062. [15]CELESTE A,FERNANDEZ C O,KRUHLAK M J,et al.Histone H2AX phosphorylation is dispensable for the initial recognition of DNA breaks[J].Nat Cell Biol,2003,5(7):675-679. [16]SEDELNIKOVA O A,BONNER W M.Gamma H2AX in cancer cells:a potential biomarker for cancer diagnostics,prediction and recurrence[J].Cell Cycle,2006,5(24):2909-2913. [17]NARISAWA S M,KIYONO T.Basic mechanisms of high-risk human papil-lomavirus-induced carcinogenesis:roles of E6 and E7 proteins[J].Cancer Sci,2007,98(10):1505-1511. [18]FERNANDEZ A F,ESTELLER M.Viral epigenomes in human tumorigenesis[J].Oncogene,2010,29(10):1405-1420. [19]MOODY C A,LAIMINS L A.Human papillomavirus oncoproteins:pathwaysto transformation[J].Nat Rev Cancer,2010,10(8):550-560. [20]WANG Fang.Clinical analysis of the short-term effect of neoadjuvant chemotherapy on cervical carcinoma with different types of HPV[J].Journal of Frontiers of Medicine,2013(13):43-44.(in Chinese) [21]PAWELCZAK K S,ANDREWS B J,TURCHI J J.Differential activation of DNA-PK based on DNA strand orientation and sequence bias[J].Nucleic Acids Res,2005,33(1):152-161. [22]COLLIS S J,DEWEESE T L,JEGGO P A,et al.The life and death of DNA-PK[J].Oncogene,2005,24(6):949-961. [23]Zhong Guo,Jin Zhao,Lei Song,et al.Induction of H2AX phosphorylation in tumor cells by gossypol acetic acid is mediated by phosphatidylinositol-3-kinase(PI3K) family[J].Cancer Cell International,2014,14:141. [24]PAULL T T,ROGAKOU EP,YAMAZAKI V,et al.A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage[J].Curr Biol,2000,10(15):886-895.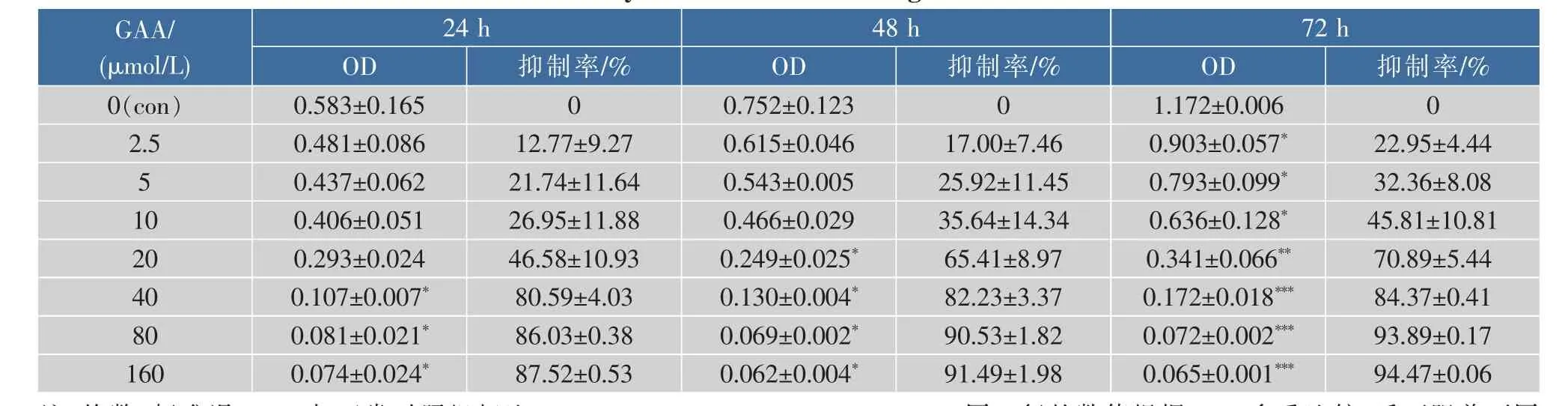


2.2 中性单细胞凝胶电泳检测DSB
2.3 GAA 诱导 Hela、Siha、C-33A 细胞 γH2AX焦点的形成
3 讨论





4 结 语

