聚己内酯与陶粒系统强化反硝化研究
朱潇伟, 缪恒锋, 阮文权
(江南大学 环境与土木工程学院,江苏 无锡214122)
随着工农业的飞速发展以及人民生活水平的提高,地表水中硝酸盐氮(NO-N)污染日益严重,其对人体的危害主要是通过转化为亚硝酸盐和亚硝胺而造成[1-2]。目前去除地表水中硝酸盐氮通常采用生物法[3],即在碳源充足情况下通过反硝化作用将NO-N最终还原为氮气(N2)而彻底将氮素从水中去除[4]。然而我国城市中地表水通常表现为低溶解性有机碳(DOC)、高营养盐的特点,所以碳源缺失就成为生物法处理地表水脱氮的主要矛盾。传统异养反硝化工艺常添加易被微生物利用的甲醇、乙酸钠、葡萄糖等可溶性碳源来提供电子供体强化该生物过程。但其存在不少缺点,比如当进水硝酸盐氮浓度波动时,精确控制液体碳源投加量而不造成溢出风险是一大难题。为了避免上述风险,以固体有机物同时作为反硝化碳源和微生物生长载体的方法近年来逐步得到认可,被称为“固相反硝化”[5]。可生物降解聚合物(BDPs)如聚乳酸(PLA)、聚羟基丁酸戊酸共聚酯(PHBV)、聚丁二酸丁二酯(PBS)[6-8]常被作为固体碳源,但其较高的价格阻碍了实际的推广。随着社会对环境友好型材料的日益关注,BDPs类物质将通过大量生产和技术革新,从而降低其使用成本。
聚己内酯(PCL)是以ε-己内酯为原料合成的开环聚合物,是一种良好的固体碳源。多数以PCL作为固体碳源的研究都采用污泥作为接种物,如封羽涛等[9]采用污水处理厂生物曝气池活性污泥作为接种物研究PCL填充床反应器,获得了良好的反硝化效果。活性污泥的优点是生物量大,接种时间短。但是作为实际处理地表水,引入额外的微生物菌群会引起出水质量的不稳定以及有危害接纳水体土著微生物的风险[10]。另外,为提高反硝化系统中的生物量,有研究者采用添加惰性载体的方法,如刘佳等[11]在PCL与淀粉共混物中添加砾石,结果显示添加砾石能提高系统生物量并略微加快反硝化速率。相比较砾石,陶粒由于其内部有大量细密蜂窝状微孔,更易于附着微生物,而被广泛应用于地表水处理中[12]。
本研究中以天然湖水作为接种物,比较性地研究固体碳源PCL在非生物与湖水微生物作用下的释碳性能,并通过在PCL中添加惰性载体陶粒,探究其对湖水反硝化脱氮效果的促进作用。
1 材料与方法
1.1 实验材料
实验所用PCL为白色圆柱形颗粒,直径1.0 mm,高约2.5~3.0 mm,购自深圳光华伟业实业有限公司。所用陶粒粒径为5.0 mm,密度为2 200 kg/m3,比表面积为6.0 cm2/g,孔隙率为40%,使用前用去离子水冲洗3遍。反硝化接种物来自江南大学校内小蠡湖湖水。实验用湖水初始指标为:NO-N 1.20 mg/L,亚硝酸盐氮(NO-N)0.14 mg/L,氨氮(NH-N)0.81 mg/L,总磷(TP)0.05 mg/L,DOC 2.20 mg/L。反硝化所用实验配水在上述湖水基础上,添加30.00 mg/L或 50.00 mg/L硝酸钾(KNO3,以 NO-N计)以及一定量的磷酸二氢钾(KH2PO4,以PO-P计)保证N/P=5∶1(质量比)。因试验方式为非动态批次实验,故本研究需添加高质量浓度NO-N以维持反应持续进行。
DELTA320型pH计,梅特勒-托利多仪器(上海)有限公司产品;TOC-VWP测定仪,岛津企业管理 (中国)有限公司产品;F-7000型荧光分光光度计,日立高新技术公司产品。
1.2 实验方法
1.2.1PCL释碳性能研究非生物作用碳源释放实验:将20.00 g PCL加入经0.1 MPa、121℃高压蒸汽灭菌20 min的1 000 mL去离子水中,于25℃培养箱中密闭保存。定期取水样分析样品DOC值,并补回去离子水以维持1 000 mL容量。
生物作用碳源释放实验:将20.00 g PCL和1 000 mL湖水加入经0.1 MPa、121℃高压蒸汽灭菌20 min的锥形瓶中,并补充30.00 mg/L NON,于25℃培养箱中密闭反应,定期取水样分析样品的DOC与NO-N值。为保持实验体系中氮源充足,若测得NO-N低于3.00 mg/L,再次添加KNO3溶液使NO-N质量浓度为30.00 mg/L,整个实验过程维持1 000 mL的容量。
1.2.2PCL脱氮研究在4个1 000 mL的锥形瓶中分别加入100 g PCL颗粒,并分别加入PCL颗粒质量的0%、20%、50%、100%陶粒共混,以此分为4组,分别记为实验组 1(PCL)、实验组 2(PCL+20%陶粒)、实验组 3(PCL+50%陶粒)和实验组 4(PCL+100%陶粒)。并加入配有30.00 mg/L NO-N和6.00 mg/L POP的1 000 mL湖水。密封后放入25℃恒温培养箱中反应。鉴于陶粒对于NON吸附作用的惰性,以及实验条件设置的针对性(模拟实际原位处理情况,不设置震荡,同时不对pH和溶解氧(DO)加以控制),本实验未设置单独陶粒吸附对照组。实验中每当NO-N质量浓度低于3.00 mg/L时,换入250 mL湖水以去除悬浮颗粒,并补充30.00 mg/L NO-N维持驯化进行[11]。
反应体系稳定后,为进一步研究反硝化性能,4组实验体系中分别添加含有50.00 mg/L NO-N、的反应液,定时取样测定稳定体系反硝化过程中等指标。
1.3 分析方法
2 结果与讨论
2.1 PCL释碳性能
PCL在非生物与湖水微生物作用下的释碳对比情况如图1所示。

图1 PCL在湖水微生物与非生物作用下释碳效果Fig.1 DOC releasing performance of PCL under microbial and amicrobic conditions
PCL在去离子水中非生物作用的静态释放实验显示,PCL颗粒在24 h内迅速释碳,释碳速率达0.656 mg/(g·d),之后进入稳定释碳阶段,整个释碳过程的平均释碳速率为 0.123 mg/(g·d)。 PCL在实验初期释碳速率较快,这可能是因为PCL颗粒上无定形区和结晶区的边缘首先发生水解而释放出小分子物质[14],使初始释碳量增加。24 h后释碳速率放缓,并逐渐达到稳定缓释状态(0.095 mg/(g·d))。 与非生物作用不同,本研究中湖水微生物作用下的DOC变化过程分为释碳与耗碳2部分。释碳过程主要包括水解释碳与微生物分解PCL后释出;而耗碳过程主要通过湖水微生物的反硝化反应消耗,溶液中的DO氧化消耗。根据DOC质量平衡的计算方法[15],以PCL为碳源的反硝化计量方程如下:

因实验相对密闭,换水而带入的DO影响很小,故计算中忽略DO对碳源的消耗。以3 d内稳定反硝化30.00 mg/L所需DOC量与反应结束后残留DOC量的加和计算可得,PCL在湖水微生物反硝化反应中稳定释碳速率为0.286 mg/(g·d),是静态实验总平均释碳速率的2.33倍,说明在存在湖水微生物情况下,有机物溶出主要来自微生物作用下固体碳源的降解。PCL作为一种可生物降解聚合物,是良好的固体碳源,水中微生物会产生脂肪酶和水解酶作用于PCL而加速降解[16]。反应第3天后,DOC值随着时间迅速下降,表明此时微生物利用碳源的速率大于碳源释放速率。之后系统的DOC值基本稳定在4.5~15.0 mg/L范围内。反应周期中第11天、18天出现DOC质量浓度的略微上升,主要由于NO-N被消耗完,反硝化微生物因缺乏氮源无法进一步利用碳源,造成DOC质量浓度短暂上升。重新添加氮源后DOC值再次下降(第13天和20天),说明当氮源充足时,微生物能够通过持续反硝化过程消耗溶液中的DOC,因此微生物作用实验组中仅在反应初期因固体碳源快速释放而导致DOC质量浓度较高,后续阶段中不存在DOC的明显累积,检测到最低DOC质量浓度仅为4.5 mg/L。另一方面,基于微生物作用的碳源缓释过程,能够自身调节DOC的释放和利用,保证DOC质量浓度的平衡。且PCL作为良好的可生物降解聚合物,本身属于环境友好材料[17],释放进入湖体中会被迅速消耗。因此在本实验中PCL展现出缓释碳源的特性,同时湖水微生物作用下能提供适量碳源而不造成二次污染。
2.2 PCL与陶粒共混反硝化研究
对PCL、PCL+20%陶粒、PCL+50%陶粒和PCL+100%陶粒4组实验组分别进行驯化,当监测到体系最低反硝化速率保证维持在30.00 mg/(L·d)以上,即认为反应体系稳定。4组实验经过22 d驯化过程达到稳定后,进行PCL与陶粒共混的反硝化效果研究。

图2 不同陶粒添加条件下的PCL反硝化性能Fig.2 Denitrification performance of PCL with different ceramsite additions
由于本研究主要分析PCL作为电子供体对于反硝化的作用,因此在实验过程中主要考察其第二阶段(利用PCL释放DOC进行反硝化阶段)。拟合第二阶段反硝化动力学方程如表1所示,其中y表示NO3--N降解速率,t表示反应时间。表1结果显示,4组实验反应均为零级动力学反应,R2在0.985~0.996之间,拟合度好。通过反应动力学指前系数比较各实验组反硝化速率,可以发现加入陶粒的实验组2、3、4的反硝化速率均高于空白组1。实验所用PCL颗粒大多表面光滑,不易附着微生物,而添加的陶粒多微孔结构,易于附着微生物并形成生物膜。因此,添加陶粒可以实现系统内微生物量的提高。另外,发现随着陶粒添加量的提高,组3(+50%陶粒)和组4(+100%陶粒)间的反硝化速率差别很小,说明添加过量陶粒并不会明显提高反硝化效率,这可能是因为附着于陶粒表面微生物需要利用水中溶解性碳源生长,而固相反硝化体系中碳源为缓释碳源,释放到水中的碳源有限,所以无法再进一步提高反硝化速率。刘佳等[19]在PBS与砾石混合的体系中发现过多添加砾石会使反硝化效率下降明显。本实验中未发现反作用,原因可能是与使用污泥的实验体系相比,本实验使用了湖水原位微生物,相对生物量较低,微生物合成细胞物质消耗有机质量不会过高,所以不会造成碳源明显缺乏而降低反硝化速率。
2.2.2DOC的变化实验中DOC的变化如图3所示,在反应初期4组实验的DOC质量浓度由反应前残存的15.32~18.92 mg/L开始快速下降,说明此时反硝化反应的DOC消耗速率高于释碳速率。随着反应的进行,观察到DOC质量浓度略微上升,但是反硝化速率与初期快速反硝化相比却下降。由于PCL作为一种高聚物,附着于其表面的微生物不是常规地从末端开始分解,而是随机断裂任意酯键产生溶解性单体或是二至五聚物[16],与直接利用产生的可溶性多聚物相比,微生物更倾向于继续分解PCL产生单体作为碳源。而且微生物分解利用PCL的速率低于反应开始阶段微生物对溶出脂肪酸与醇类碳源的利用速率,导致反硝化速率降低。到了反应末期,反应液中质量浓度降低,PCL被微生物利用的量减少,PCL的水解释碳导致DOC质量浓度稳定上升。释碳实验中未发现明显的DOC累积,这主要是因为本实验中氮源相对充足,微生物能够调节PCL的水解速率从而平衡体系的DOC质量浓度。尽管过程中会产生PCL水解产生的部分二至五聚物,但是也会在系统中不断进一步水解为单体而被迅速利用。
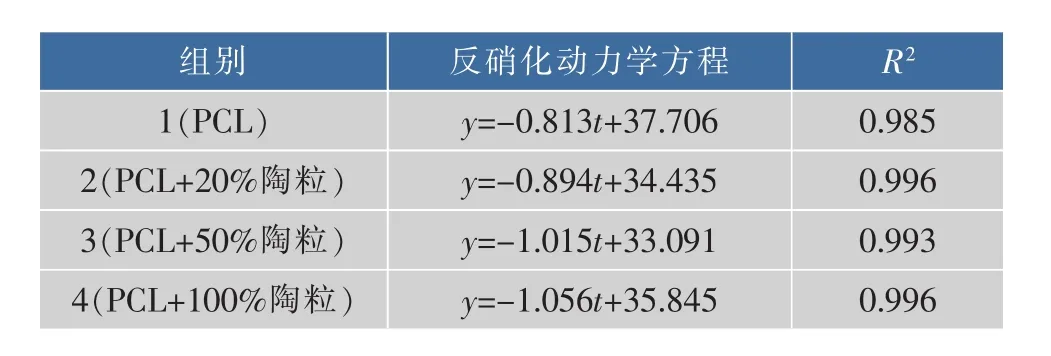
表1 不同陶粒添加条件下的反硝化动力学方程Table 1 Denitrification kinetic equations by different ceramsite additions
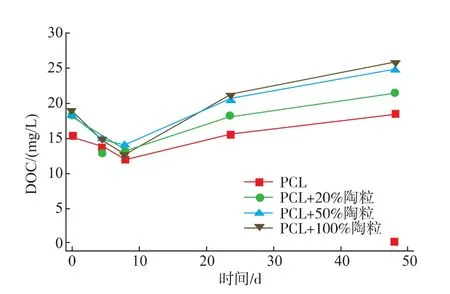
图3 反硝化过程中DOC的变化Fig.3 Change of DOC during denitrification
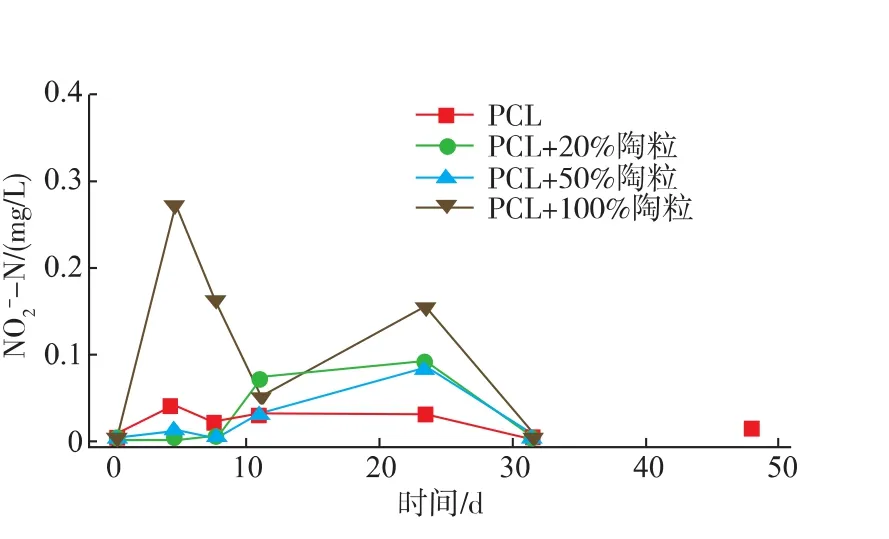
图4 反硝化过程中NO2--N的变化Fig.4 Change of NO2--N during denitrification
反应开始前用K2HPO4溶液调整各组实验pH值为7.5,如图5所示,随着反应进行,pH值先上升后下降,最终各组pH值维持在7.3~7.7之间。相关研究表明,厌氧反硝化过程是一个产碱过程,会导致pH上升;然而有机质厌氧消化的第一个阶段(涉及到PCL的水解和酸化)会导致pH下降[20]。本反应初始阶段,反硝化速率较快,释放的DOC被微生物作为碳源利用,故pH值因反硝化反应而上升;反应24 h后,随着质量浓度下降,反硝化效率的降低和水解酸化效率的提高使体系内pH逐渐下降,并根据系统微生物的调节趋于平衡。这与刘佳等[11]以PCL与淀粉共聚物作为碳源的固相反硝化研究中发现的pH变化趋势吻合。

图5 反硝化过程中pH的变化Fig.5 Change of pH during denitrification
2.2.4三维荧光光谱分析三维荧光光谱能够表征水中各种溶解性有机物的存在形式与含量,比如城市污水中常见腐植酸类与类蛋白类[22]。因4组实验仅反硝化速率不同,反应产物相似,故选取实验组4实验结束后的溶液作为出水以及湖水作为进水进行三维荧光分析比较。分析结果如图6所示,湖水进水(左图)存在一个Ex=345 nm,Em=430 nm的荧光峰,表现为腐殖酸类物质(大分子有机物);而反硝化出水 (右图)该峰明显加强,另外在Ex=280~290 nm,Em=330~360 nm处出现一个较弱的荧光峰,表现为类蛋白类物质。这说明了反硝化过程会产生额外的有机物,除了PCL释放的大分子有机物外,还会富集部分由于微生物代谢产生的可溶性微生物产物(SMP)。张雪宁[23]通过对序批式活性污泥法(SBR)系统研究发现SMP在碳源缺失时可被作为反硝化碳源,所以释放到环境中易于被微生物降解,不会对环境造成影响。


图6 进出水三维荧光图Fig.6 Fluorescence EEM spectra of influent and effluent
3 结语
对PCL作为湖水反硝化碳源的释放性能和其在与陶粒共混条件下的强化脱氮效果研究结果显示:PCL稳定释碳主要依靠微生物作用下的水解反应,其稳定释碳速率(0.286 mg/(g·d))为非生物条件下静态实验平均释碳速率 (0.123 mg/(g·d))的2.33倍。微生物可以通过对于水解和反硝化作用的自身调节,保证体系DOC质量浓度的平衡。系统中添加适量陶粒可以增加体系内微生物量,进而增强反硝化速率。进一步对反硝化过程其他关键指标的分析发现,体系pH保证在合理范围内,不存在NO2--N的累积,尽管有部分SMP富集,但是能够实现系统的稳定运行。
参考文献:
[1]ASLAN S,CAKICI H.Biological denitrification of drinking water in a slow sand filter[J].Journal of Hazardous Materials,2007,148(1-2):253-258.
[2]KARANASIOS K A,VASILIADOU I A,PAVLOV S,et al.Hydrogenotrophic denitrification of potable water:A review[J].Journal of Hazardous Materials,2010,180(1):20-37.
[3]RIVETT M O,BUSS S R,MORGAN P,et al.Nitrate attenuation in groundwater:A review of biogeochemical controlling processes[J].Water Research,2008,42(16):4215-4232.
[4]HUANG H K,TSENG S K.Nitrate reduction by Citrobacter diversus under aerobic environment[J].Applied Microbiology and Biotechnology,2001,55(1):90-94.
[5]WANG Yun,ZHANG Xu,ZHANG Dayi,et al.Performance of slow-release organic carbon-source (SOC) materials for in-situ biological denitrification in groundwater[J].Environment Science,2008,29(8):2183-2188.(in Chinese)
[6]WU C,TANG D,WANG Q,et al.Comparison of denitrification performances using PLA/starch with different mass ratios as carbon source[J].Water Science&Technology,2015,71(7):1019-1025.
[7]WU W,YANG L,WANG J.Denitrification using PBS as carbon source and biofilm support in a packed-bed bioreactor[J].Environmental Science and Pollution Research,2013,20(1):333-339.
[8]WU W,YANG F,YANG L.Biological denitrification with a novel biodegradable polymer as carbon source and biofilm carrier[J].Bioresource Technology,2012,118(4):136-140.
[9]FENG Yutan,WU Weizhong.The comparison of nitrogen removal effect between biodegradable polymers of PCL and PBS in the low organic pollution water[J].Ecology and Environmental Sciences,2011,20(6-7):1127-1132.(in Chinese)
[10]WANG X M,WANG J L.Nitrate removal from groundwater using solid-phase denitrification process without inoculating with external microorganisms[J].International Journal of Environmental Science&Technology,2013,10(5):955-960.
[11]LIU Jia,SHEN Zhiqiang,ZHOU Yuexi,et al.Denitrification performance of PCL starch blends and gravel supported system[J].Research of Environmental Sciences,2014,27(4):441-446.(in Chinese)
[12]ZHANG Huiping,CHEN Chang,HOU Wenhua,et al.Utilizing denitrifying bacteria immobilized with ceramsite to remove NO3--N from landscape water[J].Research of Environmental Sciences,2013,26(6):684-688.(in Chinese)
[13]国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002
[14]CHEN Hongli,BEI Jianzhong,WANG Shenguo.Study on biodegradation behavior of PCL/PEO/PLA tri-component copolymer[J].Acta Polymerica Sinica,2000,1(5):626-235.(in Chinese)
[15]TANG Lei,LI Peng,ZUO Jiane,et al.Advanced nitrogen removal using innovative denitrification biofilter with sustained-release carbon source material[J].Environment Science,2013,34(9):3526-3531.(in Chinese)
[16]HONDA Y,OSAWA Z.Microbial denitrification of wastewater using biodegradable Polycaprolactone[J].Polymer Degradation&Stability,2002,76(2):321-327.
[17]董琪.高直链淀粉醋酸酯合成及其与聚已内酯共混纤维的结构与性能[D].上海:东华大学,2004.
[18]汪大翚,雷乐成.水处理新技术及工程设计[M].北京:化学工业出版社,2001:223-230.
[19]LIU Jia,SHEN Zhiqiang,Zhou Yuexi,et al.Denitrification performance of PBS as solid carbon source of denitrification[J].Environment Science,2014,35(7):2639-2644.(in Chinese)
[20]YUAN Yi,HUANG Yong,DENG Huiping,et al.Effect of C/N ratio on nitrite accumulation during denitrification process[J].Environment Science,2013,34(4):1416-1420.(in Chinese)
[21]WAN Y,WU H,CAO X,et al.Compressive mechanical properties and biodegradability of porous poly(caprolactone)/chitosan scaffolds[J].Polymer Degradation&Stability,2008,93(10):1736-1741.
[22]刘小静.地表饮用水源污染物的三维荧光特性研究[D].石家庄:河北科技大学,2012.
[23]张雪宁.可溶性微生物产物的产生及其对反硝化的影响研究[D].哈尔滨:哈尔滨工业大学,2014.

