离子液体超声辅助提取香叶总黄酮及其抗氧化性研究
钟方丽,金龙哲,王晓林*,谷月
(1.吉林化工学院 化学与制药工程学院,吉林 吉林 132022;2.延边朝鲜族自治州农业科学院,吉林 延吉 133001)
香叶为植物香叶天竺葵的茎叶,我国各地均有栽培,全草具有清新芳香气味,香叶含有芳香挥发油,其主要成分是芳樟醇、丁香油酚、香茅醇、桉叶素等[1,2]。香叶作为调味料常用于汤类或肉类烹调时的调味,也是西餐常用芳香调味料之一,香叶除了作为调味品使用外,尚具有祛风除湿、行气止痛、杀虫之功效[3]。香叶除含有芳香挥发油外,还含有大量的黄酮类成分[4],而黄酮类化合物具有清除自由基、提高免疫力、抗衰老等多种生理活性,在药品、饮料、食品领域应用广泛[5-6]。离子液体是由有机阳离子和有机或无机阴离子组成的在室温下呈液体的有机离子体系[7]。由于离子液体具有挥发性小、性质稳定、溶解能力强等独特的物理化学性质,现已在天然产物活性成分提取领域有所应用[8-10],与传统的有机溶剂相比,离子液体具有绿色环保、热稳定性好、不挥发、不易燃烧等特点,被认为是代替传统有机溶剂更环保的溶剂[11]。因此,本研究采用离子液体辅助超声技术,以香叶总黄酮提取率为评价指标,通过单因素和正交试验优化了香叶总黄酮的提取工艺条件,并探索了香叶对DPPH·的清除活性,为香叶的深入开发提供了试验依据。
1 材料与方法
1.1 材料与试剂
香叶,购于亳州康民中药材批发行;芦丁,中国食品药品检定研究院(供含量测定用);溴化-1-丁基-3-甲基咪唑、氯化-1-丁基-3-甲基咪唑、1-丁基-3-甲基咪唑硝酸盐、1-丁基-3-甲基咪唑硫酸氢盐、1-丁基-3-甲基咪唑四氟硼酸盐,上海成捷化学有限公司;纤维素酶,北京鼎国昌盛生物技术有限责任公司;维生素C,天津市永大化学试剂有限公司;DPPH·,上海如吉生物科技有限公司;硝酸铝、氢氧化钠、亚硝酸钠、无水乙醇(均为分析纯),天津市永大化学试剂有限公司;水(重蒸馏水);其余所用试剂(均为化学纯)。
1.2 仪器与设备
TU-1950紫外可见分光光度计北京普析通用仪器有限责任公司;RE-52AA旋转蒸发器上海亚荣生化仪器厂;W5-100SP恒温水浴锅上海申生科技有限公司;FA-3204B电子分析天平上海精密科学仪器有限公司;SHB-ⅢA型循环水式真空泵郑州长城科工贸有限公司;DHG-9076A电热鼓风干燥器上海精密实验设备有限公司;KQ118超声波清洗器昆山市超声仪器有限公司。
1.3 试验方法
1.3.1标准曲线的制备
称取干燥至恒重的芦丁10 mg,精密称定,置于50 mL容量瓶中,加入50%乙醇水溶液,超声使其溶解,定容,摇匀,使之成为每1 mL含0.1856 mg的芦丁对照品溶液,备用。在7个容量瓶中分别放入芦丁对照品溶液12.0,10.0,8.0,6.0,4.0,2.0,1.0 mL,于30 ℃水浴条件下,分别加入0.3 mL 的5% NaNO2溶液,轻轻振摇2 min,然后静置6 min,向每个容量瓶中加入浓度为10%的硝酸铝溶液0.3 mL,慢慢摇晃2 min,然后静置6 min,再向每个容量瓶中加入浓度为4%的氢氧化钠溶液2.0 mL,用50%乙醇定容,摇匀,放置15 min,以相应对照品溶液为空白,按照紫外可见分光光度法,于510 nm波长处测吸光度[12]。以浓度C(mg/mL)为横坐标,吸光度值A为纵坐标,进行直线回归,绘制标准曲线,芦丁的线性范围为0.007424~0.08909 mg/mL,回归方程:A=10.3088C-0.04484,R=0.9993。
1.3.2样品含量测定
精密吸取香叶提取液适量于25 mL容量瓶中,按1.3.1项下所述方法进行测定,以相应香叶提取液为空白,在510 nm波长处测吸光度,计算出总黄酮提取率,计算公式如下:
香叶总黄酮提取率(mg/g)=总黄酮的质量/香叶药粉的质量。
1.3.3离子液体辅助提取香叶总黄酮的试验
取香叶粗粉适量,放入到烧瓶中,加入适量的提取溶剂及离子液体,超声波频率设定为90 W,在一定的温度下提取,过滤,然后将滤液定容至容量瓶中,按1.3.2节方法测定香叶提取液中总黄酮含量,以总黄酮提取率为指标,分别考察离子液体种类、离子液体浓度、乙醇体积分数、提取温度、料液比、提取时间对总黄酮提取率的影响,并在单因素试验基础上,对主要影响因素进行正交试验。
2 结果与分析
2.1 单因素提取试验
2.1.1离子液体种类对总黄酮提取率的影响
取香叶粗粉5份,每份2 g,放入圆底烧瓶中,加入浓度为0.5 mol/L的不同离子液体的50%乙醇水溶液,离子液体分别为溴化-1-丁基-3-甲基咪唑、氯化-1-丁基-3-甲基咪唑、1-丁基-3-甲基咪唑硝酸盐、1-丁基-3-甲基咪唑硫酸氢盐、1-丁基-3-甲基咪唑四氟硼酸盐,水浴温度控制在50 ℃,料液比为1∶20(g/mL),超声波频率为90 W,提取30 min,过滤,滤液用50%乙醇水溶液稀释至适当的容量瓶中。按“标准曲线的制备”中的方法测定提取液的吸光度值,选择适宜提取香叶总黄酮的离子液体,试验结果见表1。

表1 离子液体种类的选择Table 1 Selection of ionic liquid species
由表1可知,离子液体为氯化-1-丁基-3-甲基咪唑时,香叶总黄酮的提取率最高,所以使用氯化-1-丁基-3-甲基咪唑进行后续试验。
2.1.2提取溶剂乙醇体积分数对总黄酮提取率的影响
取香叶粗粉6份,每份2 g,放入圆底烧瓶中,加入浓度为0.5 mol/L的氯化-1-丁基-3-甲基咪唑的乙醇水溶液,乙醇体积分数分别为0,10%,30%,50%,70%,90%,其他操作同2.1.1节,试验结果见图1。
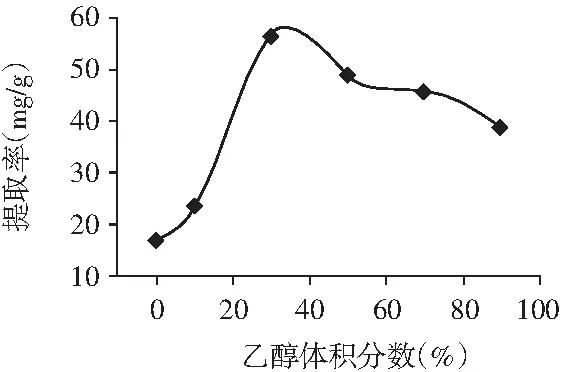
图1 乙醇体积分数的影响Fig.1 The influence of ethanol volume fraction
由图1可知,当乙醇体积分数小于30%时,随着乙醇体积分数的上升,香叶总黄酮提取率不断增加的趋势非常明显,当乙醇体积分数达到30%时,总黄酮提取率也达到了最高值56.23 mg/g。当乙醇体积分数高于30%时,随着乙醇体积分数的持续上升,香叶总黄酮的提取率却表现出不断下降的趋势。因为当乙醇体积分数达到30%时,香叶总黄酮的提取率达到最高值,所以选择30%乙醇水溶液为后续试验的提取溶剂。
2.1.3离子液体浓度对总黄酮提取率的影响
取香叶粗粉6份,每份2 g,放入圆底烧瓶中,加入浓度分别为0.05,0.1,0.2,0.3,0.4,0.5 mol/L的氯化-1-丁基-3-甲基咪唑的30%乙醇水溶液,其他操作同2.1.1节,试验结果见图2。
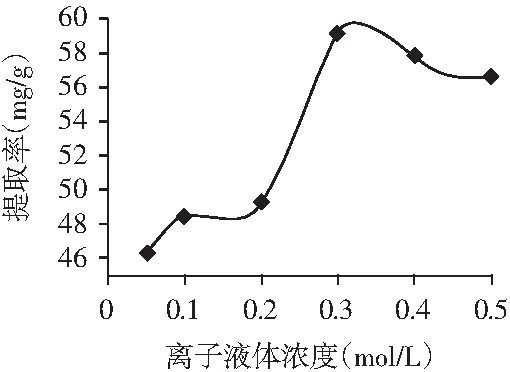
图2 离子液体浓度的影响Fig.2 The influence of ionic liquid concentration
由图2可知,当氯化-1-丁基-3-甲基咪唑的浓度在0.05~0.3 mol/L范围内时,离子液体的浓度越高,香叶总黄酮的提取率越大,在其浓度提高到0.3 mol/L时,香叶总黄酮的提取率达到了峰值。而其浓度高于0.3 mol/L时,随着离子液体浓度的增加,香叶总黄酮提取率略有降低的趋势。由于离子液体浓度为0.3 mol/L时,香叶总黄酮提取率最大,所以选择离子液体浓度为0.3 mol/L进行后续试验。
2.1.4料液比对总黄酮提取率的影响
取香叶粗粉7份,每份2 g,放入圆底烧瓶中,加入浓度为0.3 mol/L的氯化-1-丁基-3-甲基咪唑的30%乙醇水溶液,料液比分别为1∶5,1∶10,1∶20,1∶30,1∶40,1∶50,1∶60,然后按照2.1.1节中的方法进行相关操作,具体试验结果见图3。

图3 料液比的选择Fig.3 The choice of solid-liquid ratio
由图3可知,当料液比在1∶5~1∶20范围内时,随着料液比的升高,香叶总黄酮提取率显著增加,当料液比在1∶20~1∶50范围内时,随着料液比的升高,香叶总黄酮提取率缓慢增加,当料液比持续升高到1∶50时,总黄酮提取率达到69.11 mg/g,继续增加料液比,总黄酮提取率变化很小。分析原因可能是因为香叶的量固定,料液比太小,提取液粘度较大,不利于香叶总黄酮的溶出,难以保证香叶中总黄酮转移到提取液中,提取不完全,总黄酮提取率较低,在一定程度上增加料液比有利于黄酮类物质向提取液转移,从而使总黄酮提取率升高,但料液比过高其他非黄酮类物质的溶出也就越大,可能干扰总黄酮的含量测定,从而使香叶总黄酮的提取率表现出稍有降低的现象。所以采用1∶50的料液比进行后续的单因素试验。
2.1.5水浴温度对总黄酮提取率的影响
取香叶粗粉7份,每份2 g,放入圆底烧瓶中,加入浓度为0.3 mol/L的氯化-1-丁基-3-甲基咪唑的30%乙醇水溶液,料液比为1∶50,设定水浴提取温度分别控制在30,40,50,60,70,80 ℃,其他操作同2.1.1节,试验结果见图4。
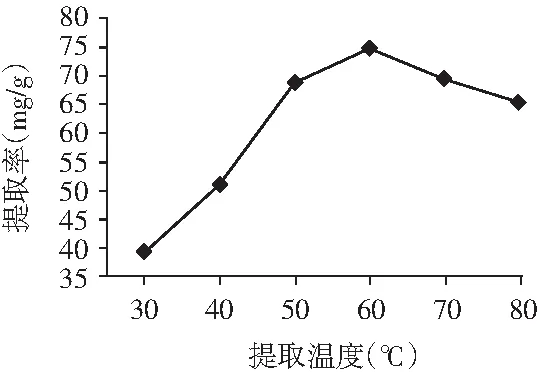
图4 提取温度的选择Fig.4 The choice of extraction temperature
由图4可知,随着水浴温度的升高,香叶总黄酮提取率逐渐提高,当水浴温度达到60 ℃时,香叶总黄酮的提取率也增加到了最大值74.87 mg/g,继续升高水浴温度,总黄酮的提取率却表现出不断降低的趋势。可能是因为随着水浴温度的不断上升,使提取溶剂的运动速度及频率不断增大,使之更容易渗透到香叶组织细胞中,加速黄酮类物质的溶出,从而增加总黄酮的提取率。但温度过高,可能会导致部分黄酮类化合物的结构被破坏,从而使提取率下降。所以选择水浴提取温度60 ℃进行后续试验。
2.1.6提取时间对总黄酮提取率的影响
取香叶粗粉8份,每份2 g,放入圆底烧瓶中,加入浓度为0.3 mol/L的氯化-1-丁基-3-甲基咪唑的30%乙醇水溶液,料液比为1∶50,水浴温度控制在60 ℃,然后按照2.1.1节中方法分别提取0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0 h,其他处理与2.1.1节中方法一致,试验结果见图5。
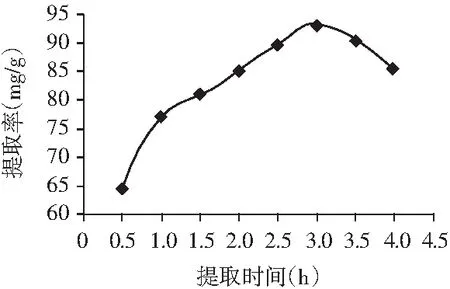
图5 提取时间的选择Fig.5 The choice of extraction time
由图5的试验数据可知,随着提取时间的不断延长,香叶总黄酮的提取率也随着时间延长而升高,提取时间3.0 h时可使香叶总黄酮的提取率升高到93.03 mg/g,再延长提取时间,香叶总黄酮的提取率开始逐渐降低。其原因为延长提取时间可以使香叶中的总黄酮的溶出增加,但如果提取时间过长会使黄酮类化合物的结构被破坏,从而使提取率下降。所以选择提取时间为3.0 h进行后续试验。
2.2 离子液体辅助提取香叶总黄酮的正交试验
2.2.1因素及水平的考察
在上述单因素试验中,料液比达到1∶50后对香叶总黄酮提取率影响很小,所以在正交试验中将料液比固定为1∶50,选择氯化-1-丁基-3-甲基咪唑离子液体的浓度、提取溶剂乙醇的体积分数及提取时间和提取温度作为因素进行考察,以香叶总黄酮提取率为考察指标,进行正交试验,进一步优化香叶总黄酮的提取工艺。按4因素3水平进行正交试验设计L9(34),见表2,在此条件下对香叶总黄酮进行提取,按1.3.2节方法测定提取液的吸光度,计算总黄酮提取率。

表2 正交试验因素水平表Table 2 Factors and levels of orthogonal experiment
2.2.2正交试验结果
取香叶粗粉9份,每份2 g,放入圆底烧瓶中,按正交试验表进行试验,每组试验的料液比为1∶50,结果见表3。
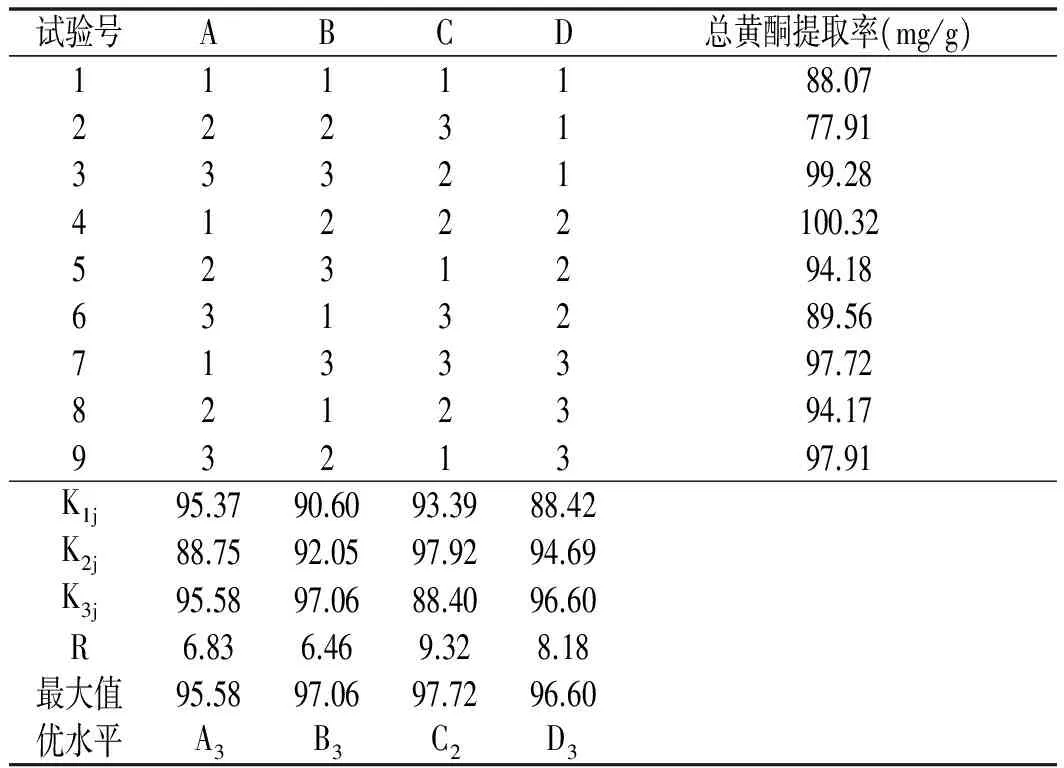
表3 正交试验设计及试验结果Table 3 Orthogonal array design arrangement and the experimental data
正交试验结果表明:离子液体超声辅助提取香叶总黄酮各因素的影响大小为:提取时间影响最大,其次是提取温度,然后为离子液体浓度,影响最小的是提取溶剂的乙醇体积分数,最佳离子液体超声辅助提取香叶总黄酮的最佳工艺条件为A3B3C2D3,即离子液体为氯化-1-丁基-3-甲基咪唑,离子液体浓度为0.35 mol/L,料液比为1∶50,提取溶剂为40%乙醇水溶液,提取时间为3 h,提取温度为65 ℃。
2.3 离子液体辅助提取香叶总黄酮的工艺稳定性验证试验
取香叶粗粉3份,每份4 g,放入圆底烧瓶中,加入200 mL浓度为0.35 mol/L的氯化-1-丁基-3-甲基咪唑的40%乙醇水溶液,水浴温度控制在65 ℃,提取时间为3.0 h,其他操作同2.1.1节。结果香叶总黄酮提取率分别为109.37,111.77,108.23 mg/g,平均为109.79 mg/g,结果表明优选的香叶总黄酮离子液体超声辅助提取工艺比较稳定。
2.4 香叶总黄酮提取的对比试验
2.4.1离子液体对总黄酮提取率的影响
取香叶粗粉3份,每份4 g,放入圆底烧瓶中,加入200 mL的40%乙醇水溶液,水浴温度控制在65 ℃,提取时间为3.0 h,其他操作同2.1.1节。结果香叶总黄酮提取率分别为80.61,81.54,80.17 mg/g,平均为80.77 mg/g。根据2.3节试验结果可知,离子液体的加入使香叶总黄酮提取率提高了35.93%。
2.4.2酶对总黄酮提取率的影响
取香叶粗粉3份,每份4 g,放入圆底烧瓶中,加入200 mL浓度为0.35 mol/L的氯化-1-丁基-3-甲基咪唑的40%乙醇水溶液,然后再加入纤维素酶0.02 g,水浴温度控制在65 ℃,提取时间为3.0 h,其他操作同2.1.1节,提取结束后在90 ℃水浴中30 s灭酶。结果香叶总黄酮提取率分别为116.52,117.63,118.31 mg/g,平均为117.49 mg/g。由试验结果可知,体系中加入了纤维素酶使香叶总黄酮提取率进一步提高,可能是因为纤维素酶破坏了香叶的细胞壁,从而使细胞内的香叶总黄酮溶出增加,从而提高了总黄酮提取率。
2.4.3脱脂对总黄酮提取率的影响
取干燥的香叶粉10 g,加入50 mL石油醚回流脱脂2次,每次1 h,过滤,滤渣于60 ℃以下干燥至干,取脱脂后的香叶粗粉3份,每份4 g,放入圆底烧瓶中,然后按2.3节方法进行试验。结果香叶总黄酮提取率分别为114.66,113.95,114.08 mg/g,平均为114.23 mg/g。由试验结果可知,脱脂后除去了香叶中的叶绿素、胡萝卜素等脂溶性物质,结果使香叶总黄酮提取率有所提高,但提高幅度低于纤维素酶。
2.5 体外抗氧化性研究
称取香叶干浸膏适量,用50%乙醇水溶液制备成不同质量浓度的一系列样品溶液。在10个10 mL比色管中分别加入2.0 mL上述一系列样品溶液,然后再加入浓度为0.2 mmol/L 的DPPH·溶液2.0 mL,混合均匀,在室温条件下暗处放置30 min,用50%的乙醇水溶液为空白对照,于517 nm波长处测定吸光度A样品。其他条件不变,用2.0 mL蒸馏水代替测定A样品中的香叶样品液,其他操作同上,在517 nm处测定吸光度A空白。在10个10 mL比色管中分别加入2.0 mL上述一系列样品溶液,然后再加入无水乙醇2.0 mL,混合均匀,其他操作同上,在517 nm处测定吸光度A对照。
称取维生素C适量,制备成一系列与样品溶液质量浓度相同的对照溶液,按照上述方法同样操作。通过下式分别计算香叶样品溶液、维生素C对照溶液对DPPH·的清除率[13]。
DPPH·清除率(%)=[(A空白-A样品+A对照)/A空白]×100。

图6 样品溶液和对照溶液对DPPH·的清除活性Fig.6 The scavenging activity of sample solution and reference solution to DPPH·
由图6可知,随着香叶提取物与维生素C溶液质量浓度的增加,其对DPPH·的清除率均逐渐升高,二者对DPPH·的清除能力均呈现一定的浓度依赖性,在质量浓度小于0.4 mg/mL时香叶提取物的清除能力低于维生素C;当质量浓度高于0.4 mg/mL时香叶提取物的清除能力与维生素C接近;当质量浓度为0.5 mg/mL时二者对DPPH·的清除率分别为98.92%,99.07%。香叶提取物对DPPH·的清除率与质量浓度的线性回归方程为Y=2.9413+199.4206X,R=0.9903,香叶提取物对DPPH·的清除率的IC50值为0.2360 mg/mL;而维生素C的质量浓度与对DPPH·的清除率的线性回归方程为Y=21.6433+166.5879X,R=0.9861,其IC50值为0.1702 mg/mL。结果表明香叶提取物对DPPH·的清除能力弱于阳性对照维生素C,但其清除率与质量浓度的线性回归性强于阳性对照维生素C。
3 结论
本试验对离子液体超声辅助提取香叶总黄酮的工艺条件进行了探索,并采用单因素及正交试验对其进行了优化。比较适宜的提取工艺条件为:提取溶剂为40%乙醇,料液比为1∶50,水浴温度控制在65 ℃,提取时间为3.0 h,最佳离子液体为氯化-1-丁基-3-甲基咪唑,离子液体浓度为0.35 mol/L,超声波频率设定为90 W,在此工艺条件下,香叶总黄酮提取率为109.79 mg/g。本文采用的离子液体超声辅助提取法,其提取率高,与传统超声辅助醇提工艺相比,总黄酮提取率提高了35.93%,说明离子液体超声辅助提取法是一种高效的提取方法。可能是因为将离子液体用作溶剂时,超声的空化效应能加速离子液体穿透香叶组织细胞,促进香叶组织内的黄酮类物质溶出,而且离子液体可能对香叶总黄酮具有一定的增溶作用,同时离子液体可能作为一种转运载体将黄酮类物质从香叶细胞内运出,增大了其溶出率,从而提高了香叶总黄酮提取率。本文进一步探索了在提取体系中加入纤维素酶对提取率的影响,试验结果表明由于纤维素酶破坏了香叶的细胞壁,从而使细胞内的黄酮类物质最大限度地溶出,因此可进一步地提高总黄酮提取率,与传统超声辅助醇提工艺相比,总黄酮提取率提高了45.46%。体外抗氧化活性的试验结果表明:香叶提取物对DPPH·具有显著的清除活性,而且随着其质量浓度的增加,清除活性明显增强,其IC50值为0.2360 mg/mL。上述试验结果为香叶在食品、饮料、制药等领域的应用提供了基础。
参考文献:
[1]萧正春,张卫明,张广伦,等.燃油植物香叶树的开发利用与栽培[J].中国野生植物源,2007,26(6):9-12.
[2]李源栋,李先毅,段焰青,等.GC/MS法结合保留指数分析香叶油香味成分[J].食品与机械,2016,32(8):25-28.
[3]党璇,张晓珍,姚默,等.香叶天竺葵药学研究概况[J].安徽农业科学,2011,39(31):19095-19096.
[4]王向国.香叶黄酮提取工艺研究[J].科技信息,2010(18):104-105.
[5]俞作仁,王文莉,吕娟涛.刺玫果化学成分及药理作用研究进展[J].中草药,2002,33(2):188-190.
[6]曹纬国,刘志勤,邵云,等.黄酮类化合物药理作用的研究进展[J].西北植物学报,2003,23(12):2241-2247.
[7]Xiao Yao,Zhang Han-qi.Homogeneous ionic liquid microextraction of the active constituents from fruits ofSchisandrachinensisandSchisandrasphenanthera[J].Analytica Chimica Acta,2012,712(27):78-84.
[8]Cao Xiao-ji,Ye Xue-min,Lu Yan-bin,et al.Ionic liquid-based ultrasonic-assisted extraction of piperine from white pepper [J].Anal Chim Acta,2009,640(1):47-51.
[9]史丽娟,彭胜,郑阳,等.离子液体超声波辅助法提取杜仲皮总木脂素的工艺研究[J].应用化工,2015,44(12):2250-2254.
[10]陈明明,赵思敏,王毅帆,等.离子液体辅助超声提取黄柏总生物碱[J].沈阳药科大学学报,2015,32(11):859-863.
[11]Xiao Yao,Wang Ying,Gao Shi-qian,et al.Determination of the active constituents inArnebiaeuchroma(Royle) Johnst.by ionic liquid-based ultrasonic-assisted extraction high-performance liquid chromatography[J].Journal of Chromatography B,2011,879(20):1833-1838.
[12]王晓林,钟方丽,于丽颖,等.微波协同酶法提取玉竹总黄酮工艺研究[J].中国调味品,2015,40(5):22-26.
[13]王晓林,王文姣,钟方丽,等.藿香、葫芦巴总黄酮的体外抗氧化活性研究[J].中国调味品,2016,41(9):29-35.

