超高效液相色谱-串联质谱法测定火锅食品中的罗丹明B和6G
吴正双,林显活,梁炽琼,石英
(1.佛山市质量计量监督检测中心,广东 佛山 528225;2.佛山市食品药品检验检测中心,广东 佛山 528000;3.天津工业大学 管理学院,天津 300387)
罗丹明B(又称玫瑰红B或碱性玫瑰精)和罗丹明6G(又称玫瑰红6G或罗丹明590)属于邻苯二酚类化合物,具有荧光染色的作用,在农业、橡胶、染料、医药、生物等领域具有广泛的应用[1-3]。研究表明:罗丹明B和6G可能会引起诱变或致畸,对人体造成急性和慢性中毒伤害[4-6]。2008年,我国卫生部发布的《食品中可能违法添加的非食用物质和易滥用的食品添加剂名单》(第一批),将罗丹明B列入非食用物质名单[7]。但由于其具有色泽鲜艳、着色稳定、价格低廉等特点,被大量非法用于食品的生产和加工,特别是被用于火锅食品和其他调味品的染色。
目前,食品中罗丹明B和罗丹明6G的相关检测方法标准有SN/T 2430-2010《进出口食品中罗丹明B的检测方法》和NY/T 2656-2014《饲料中罗丹明B和罗丹明6G的测定 高效液相色谱法》。前者包括高效液相色谱-荧光法和高效液相色谱-串联质谱法,两种方法的前处理过程均比较复杂繁琐,需要经凝胶渗透色谱净化系统净化,且检测限均为5 μg/kg;后者为高效液相色谱-荧光法,定量限为1 μg/kg,虽然前处理比较简单,但是该方法只能通过保留时间定性,容易产生假阳性结果。近年来火锅食品中罗丹明B和罗丹明6G的检测方法主要是高效液相色谱-荧光法和液相色谱-串联质谱法[8-11]。高效液相色谱-荧光法虽然应用广泛,但是由于荧光检测器只能靠保留时间定性,对于基质比较复杂的火锅食品难免不能保证准确性;液相色谱-串联质谱法灵敏度高,特异性强,适用于复杂基质中罗丹明B和罗丹明6G的测定,但是前处理净化方法各异,因此探索一种简单、省时、节省溶剂、净化效果好和回收率高的前处理方法尤为重要。本实验采用固相萃取柱净化样品,经LC-MS/MS多反应监测模式测定,建立了同时测定火锅食品中罗丹明B和罗丹明6G的方法,该方法操作简单快速、灵敏度和准确度高,适用于定性和定量测定。
1 材料与方法
1.1 材料与试剂
罗丹明B(Rhodamine B,98.6%)、罗丹明6G(Rhodamine 6G,98.5%):均购自德国Dr. Ehrenstorfer公司。
乙腈、甲醇、甲酸:均为色谱纯,德国Merck公司。
阳离子交换固相萃取柱(3 mL,60 mg),MCX混合型阳离子交换固相萃取小柱(3 mL,60 mg),使用前均依次用3 mL甲醇和3 mL水活化;C18固相萃取小柱(3 mL,200 mg),使用前依次用5 mL甲醇和5 mL水活化;QuEChERS净化小管(填料为无水硫酸镁、PSA和C18混合物),均购自上海安谱实验科技股份有限公司。
1.2 仪器与设备
Quattro Premier XE超高效液相色谱-三重四级杆串联质谱仪(UPLC-MS/MS)美国Waters公司;OA-SYS水浴氮吹仪美国Organomation公司;电子天平;漩涡式混合器;恒温振荡器;离心机。
1.3 实验方法
1.3.1标准溶液的配制
准确称取罗丹明B和罗丹明6G各5.0 mg,用乙腈溶解并定容至25 mL容量瓶中,均配制成200 μg/mL的单标储备液,置于-18 ℃冰箱中避光保存备用,根据需要用流动相逐级稀释成合适浓度的混合标准工作溶液备用。
1.3.2样品提取
少油型:称取试样1 ~2 g(精确至0.01 g)至50 mL离心管中,加入10 mL乙腈,涡旋1 min,超声提取20 min(超声过程中可不时振摇),涡旋混匀,8000 r/min离心5 min,过滤,滤液待净化。
多油型:称取试样1 g(精确至0.01 g)至50 mL离心管中,加入10 mL乙腈,涡旋1 min,超声提取20 min(超声过程中可不时振摇),涡旋混匀,8000 r/min离心5 min,上清液转移至另一个50 mL离心管中,加入10 mL正己烷,涡旋1 min,弃去上层液,过滤,滤液待净化。
1.3.3净化
将上述滤液上固相萃取小柱,待其自然流尽后,依次用2 mL水、2 mL 2%甲酸水溶液和2 mL甲醇洗涤小柱并压干,最后用6 mL 5%氨水甲醇溶液洗脱,收集洗脱液,流速控制在1 mL/min。洗脱液在50 ℃水浴下氮气吹干。准确加入1 mL 50%乙腈溶解残渣,经0.22 μm滤膜过滤作为测定液,用超高效液相色谱-串联质谱仪测定。
1.3.4液相色谱条件
色谱柱:Acquity UPLC BEH C18(1.7 μm,100 mm×2.1 mm);柱温:35 ℃;进样体积:5 μL;流动相:A为0.1%的甲酸水溶液,B为乙腈;流速:0.3 mL/min,梯度洗脱,洗脱程序见表1。
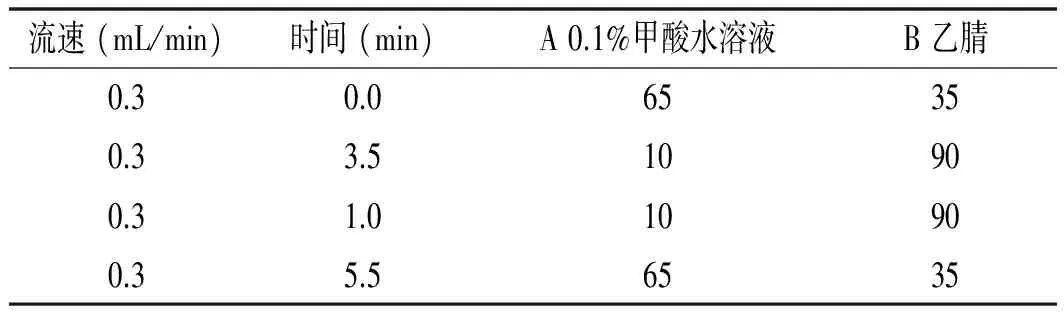
表1 UPLC梯度洗脱程序Table 1 UPLC gradient elution procedures
1.3.5质谱条件
电离方式:电喷雾正离子(ESI+)模式;扫描方式:多反应监测(MRM);毛细管电压:3.5 kV;离子源温度:120 ℃;脱溶剂温度:350 ℃;脱溶剂气流:N2,流速600 L/h;锥孔气流:N2,流速50 L/h;碰撞气:氩气,流速0.12 mL/min。
2 结果与分析
2.1 质谱条件的优化
分别取浓度为0.5 μg/mL的罗丹明B和罗丹明6G单标溶液,采用注射泵直接进样的方式,在正离子模式下分别得到其母离子和特征子离子(见图1),并对透镜电压和碰撞电压进行优化,得到最佳质谱参数,见表2。
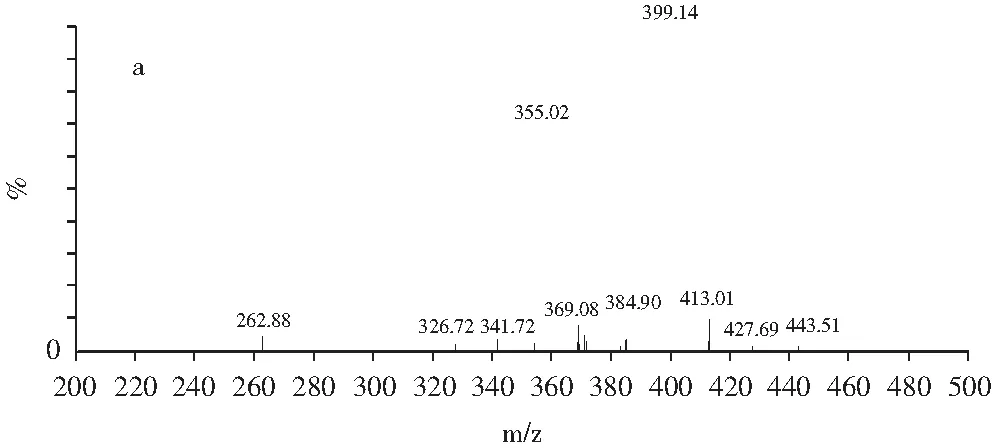
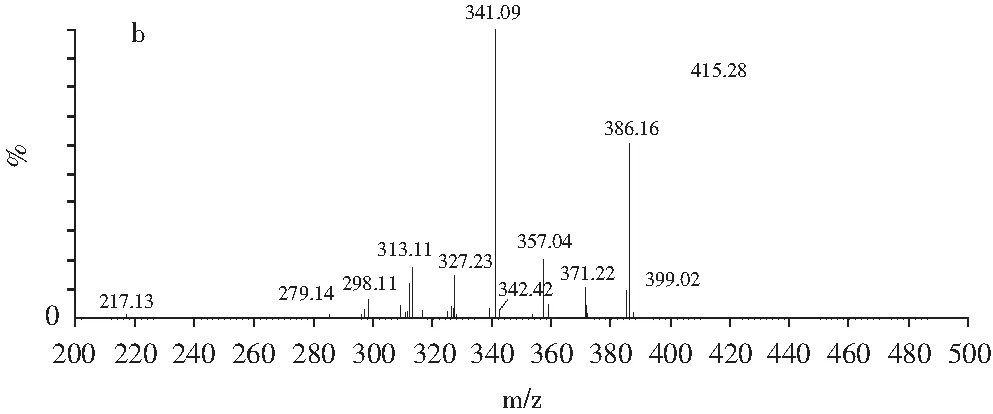
图1 罗丹明B(a)和罗丹明6G(b)二级质谱图Fig.1 MS/MS secondary mass spectrogram of Rhodamine B (a) and Rhodamine 6G (b)

表2 罗丹明B和罗丹明6G的多反应监测质谱参数Table 2 MS parameters of Rhodamine B and Rhodamine 6G in MRM mode
注:*表示定量离子。
2.2 色谱条件的优化
分别考察了甲醇-水、甲醇-0.1%甲酸水、乙腈-水、乙腈-0.1%甲酸水流动相体系对罗丹明B和罗丹明6G的分离效果和响应值的影响。结果表明:甲醇-水和乙腈-水分别为流动相时,两种目标物的响应都比较小,且峰形也不够对称。甲醇-0.1%甲酸水、乙腈-0.1%甲酸水分别为流动相时,峰形明显改善,且响应也增强,但由于罗丹明B和6G为同分异构体,极性相近,甲醇-0.1%甲酸水作流动相,二者保留时间重叠(见图2中a),而乙腈-0.1%甲酸水可将二者有效分离(见图2中b),虽然质谱检测不受保留时间的限制,但是乙腈的洗脱效果高于甲醇,不仅可以节省溶剂,而且本实验显示乙腈为流动相时,目标物的响应值也高。因此选用乙腈-0.1%甲酸水为流动相。
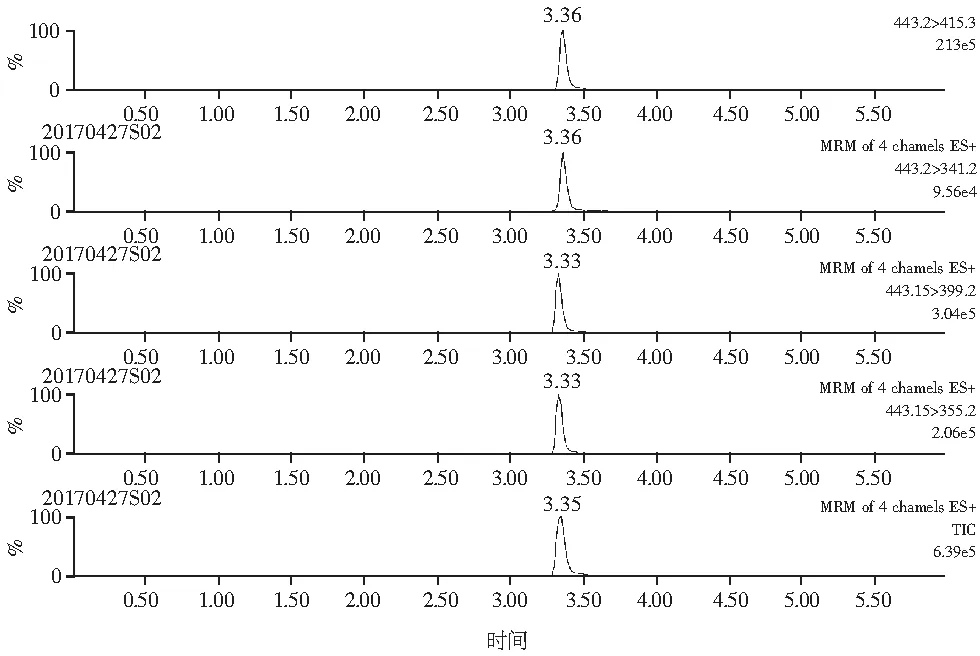
a. 甲醇-0.1%甲酸水为流动相

b.乙腈-0.1%甲酸水为流动相图2 罗丹明B和罗丹明6G的总离子流图和MRM图Fig.2 TIC and MRM chromatograms of Rhodamine B and Rhodamine 6G
2.3 提取溶剂的选择
虽然罗丹明B和6G的极性比较弱,脂溶性强,按照相似相溶的原理,应该用非极性溶剂提取,但同时二者又易溶于水、甲醇、乙腈、乙醇等常用溶剂。有标准和文献显示[12],罗丹明B用乙酸乙酯-环己烷或正己烷提取,经凝胶渗透色谱系统净化,实验浪费大量有机试剂,且检出限比较高,不能满足快速省时和高灵敏度的要求。本实验采用比较节省有机溶剂的甲醇和乙腈作为提取溶剂,并比较了两者的提取效果,发现甲醇在提取出目标物质的同时也提取出更多的极性杂质,不但影响净化效果也导致回收率下降;乙腈极性中等,采用乙腈提取,净化后的样液较为干净,且回收率也高。故实验室采用乙腈为提取溶剂。
2.4 净化条件的选择
因为火锅食品中一般含有大量的油脂和色素等大分子物质和杂质,这些杂质会随着目标物的提取一并提取出来,对色谱柱和质谱离子源损伤较大,因此很有必要对样品提取液进行净化。罗丹明B和6G均为邻苯二酚类化合物,属于弱阴离子型化合物,可以用强阳离子交换固相萃取柱净化,同时也是弱极性化合物,也可以用反相的C18固相萃取柱净化,因此本实验比较了阳离子交换固相萃取柱、C18固相萃取柱、混合型阳离子交换固相萃取柱、商品化的QuEChERS净化小管(填料为无水硫酸镁、PSA和C18混合物)4种方法的净化效果,以回收率评价其净化效果。
结果显示:强阳离子交换柱和C18固相萃取柱都有一定的净化效果,强阳离子交换柱对少油型的火锅食品的净化效果优于C18,但对多油型的火锅食品,C18的净化效果优于强阳离子交换柱。混合型阳离子交换柱是反相和强阳离子交换的复合模式,对少油型和多油型的样品净化效果均比较好。商品化的QuEChERS净化小管使用方便,但是回收率比较低,净化效果不太理想。故本实验选用混合型阳离子交换柱净化样品。
2.5 方法学验证
2.5.1线性范围和检出限
按照相应的仪器工作条件,将1.3.1方法中配制好的罗丹明B和罗丹明6G混合系列标准溶液经自动进样上机测定,以浓度(ng/mL)为横坐标,峰面积为纵坐标绘制标准曲线,线性方程见表3。

表3 罗丹明B和罗丹明6G的线性范围、线性方程、相关系数和检出限Table 3 Linear ranges, regression equations, correlation coefficients and LODs of Rhodamine B and Rhodamine 6G
根据国际纯粹与应用化学联合会(IUPAC)对检出限的定义,本实验以空白火锅食品添加低浓度标准物质,使罗丹明B和罗丹明6G的浓度水平均为0.5 μg/kg,按照1.3中的方法均平行测定8次,分别计算出8次测定结果的标准偏差,以标准偏差的3倍作检出限(置信水平P=95%)[13],得到这2种水平的检出限分别为0.064,0.087 μg/kg。然后,按照1.3中的方法验证,结果显示:罗丹明B和罗丹明6G添加浓度分别为0.064,0.087 μg/kg时,在UPLC-MS/MS仍然有响应,且信噪比S/N>3,考虑到取整数,故确定二者的检出限均为0.1 μg/kg。
2.5.2回收率和精密度
按照实验测定步骤,采用辣椒粉、火锅油底料空白样品,分别添加高、中、低3个浓度进行加标回收实验,每个浓度平行测定6次,考察方法精密度,结果见表4。
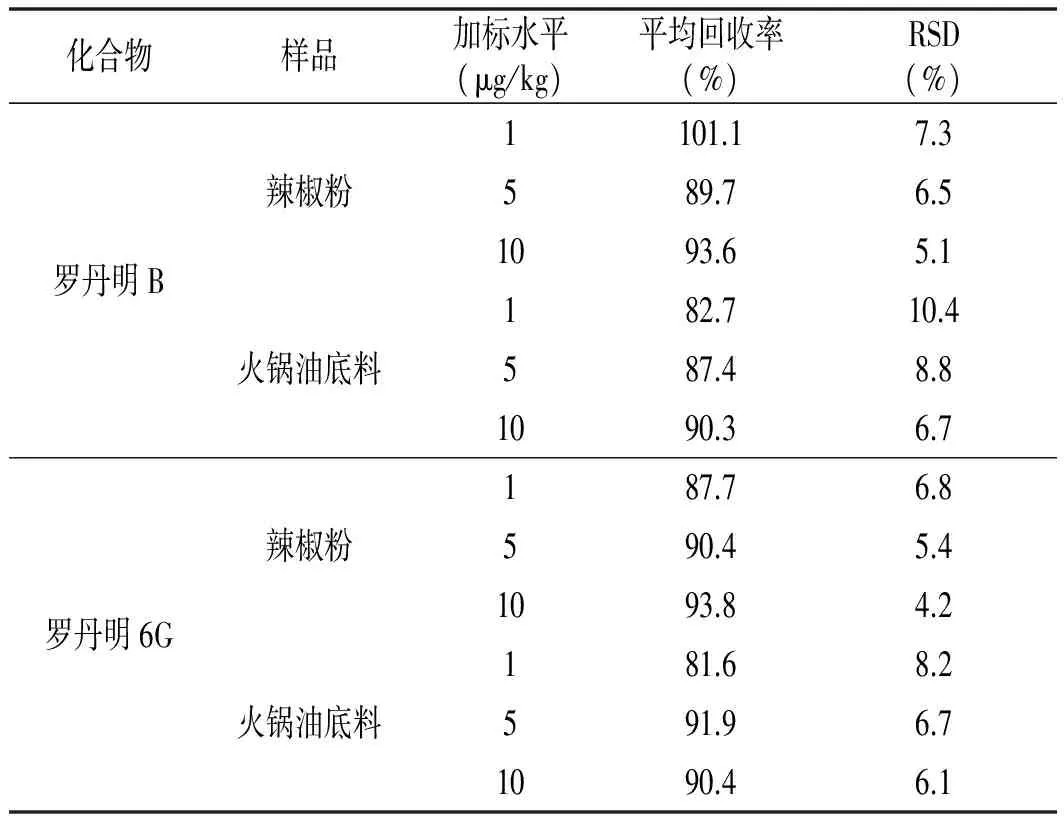
表4 罗丹明B和罗丹明6G加标回收率及相对标准偏差(n=6)Table 4 Recoveries and relative standard deviations (RSDs) of Rhodamine B and Rhodamine 6G (n=6)
由表4可知,在不同加标浓度条件下,不同的样品中,2种化合物的加标回收率为81.6%~101.1%,精密度范围(RSD)为4.2%~10.4%,能够满足日常检测工作的需要。
3 结论
本实验以火锅食品为研究对象,采用乙腈提取,MCX混合型阳离子交换固相萃取柱净化,超高效液相色谱-串联质谱法测定其中可能违法添加的罗丹明B和罗丹明6G。方法前处理过程简单、快捷、节省试剂;混合型阳离子交换固相萃取柱净化效果好,回收率高,为81.6%~101.1%,精密度(RSD)为4.2%~10.4%;检出限低,罗丹明B和罗丹明6G均为0.1 μg/kg。 该方法适用于少油型和多油型火锅食品的检测,可同时定性和定量测定其中的罗丹明B和罗丹明6G,能够满足日常检测工作的要求。
参考文献:
[1]Zou J,Hofer A M,Lurtz M M,et al.Developing sensors for real-time measurement of high Ca2+concentrations[J].Biochemistry,2007,46(43):12275-12288.
[2]黄晓峰,张远强,张英起.荧光探针技术[M].北京:人民军医出版社,2004:234-238.
[3]高勇,张敏,郭斌.罗丹明荧光探针在生化分析中的应用[J].化学通报,2009,72(1):15-19.
[4]European Commission.Review of the toxicology of a number of dyes illegally present in food in the EU[J].EFSA J,2005,263:1-71.
[5]Elliott G S,Mason R W,Edwada I R.Studies on the pharmacolinetics and mutagenic potential of rhodmine B[J].Toxieol Clin Toxicol,1990,28(1):45-59.
[6]Sweatman T W,Seshadri R,Israel M.Metabolism and elimination of rhodamine 123 in the rat [J].Cancer Chemotherapy and Pharmacology,1990,27(3):205-210.
[7]中华人民共和国卫生部.食品中可能违法添加的非食用物质和易滥用的食品添加剂名单(第1-5批汇总)[EB/OL].http://www.nhfpc.gov.cn/sps/s7891/201106/39bee4fe171b4ec4b82df40b61dcea6e.shtml,2011-04-22.
[8]胡侠,肖光,潘炜,等.高效液相色谱-串联质谱法同时测定辣椒粉及辣椒油中的7种罗丹明染料[J].色谱,2010,28(6):590-595.
[9]林子豪,戚平,周庆琼,等.液相色谱-串联质谱内标法同时测定调味品中11种工业染料[J].现代食品科技,2017,33(7):1-7.
[10]陈万勤,黄丽英,王瑾,等.高效液相色谱-荧光检测法测定辣椒制品中5种罗丹明染料[J].分析科学学报,2013,29(6):815-818.
[11]Muammer K,Elmas O O,Oznur K.A rapid and simple method for simultaneous determination of triphenylmethane dye residues in rainbow trouts by liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A,2014,1349:37-43.
[12]赵珊,张晶,丁晓静,等.凝胶净化/超高效液相色谱电喷雾质谱法检测调味油中11种禁用偶氮染料及罗丹明B[J].分析测试学报,2012,31(4):448-452.
[13]Inczedy J,Lengyel T,Ure A M.Compendium of analytical nomenclature (3rd edition) [M].IUPAC: Blackwell Scientific Publication,1998.

