霉菌发酵食品中桔霉素的免疫亲和柱结合高效液相荧光法检测
李楠,陈俊霖,顾双,王向阳,练志峰,付蕾,程周周
(浙江工商大学 食品与生物工程学院,杭州 310018)
桔霉素(citrinin),也称桔青霉素,是一种由青霉、曲霉及红曲霉产生的真菌毒素[1-4]。桔霉素主要作用的靶器官是肾脏,具有肾毒性[5],其常用于制作红曲色素及红色米酒等,目前已有大量报道明确指出红曲霉及其产品均能产生桔霉素[6-8]。米曲霉和黑曲霉常用于生产酱油,曲霉、红曲霉常用于生产黄酒,这些菌种及其产品均易产生桔霉素[9,10],另外米醋和腐乳也发现了桔霉素的存在[11,12]。受过潮的粮食容易出现发霉,这可能导致桔霉素的产生,土耳其50%小麦中含有桔霉素[13];从水果、果汁、谷物中分离得到的青霉菌85%会产生桔霉素[14]。以往我国主要针对少数出口产品检测桔霉素,市场上仅仅检测红曲产品,主要标准有 GB/T 5009.222-2008、SN/T 2426-2010和SN/T 2916-2011[15-17]。在2016年,我国推出了食品安全国家标准GB 5009.222-2016《食品中桔青霉素的测定》,说明我国对食品中桔霉素可能的危害有了进一步重视。该标准第一法采用桔青霉素免疫亲和柱预纯化,适用于大米、玉米、辣椒、红曲类产品中桔青霉素的测定;第二法采用C18柱预纯化,适用于大米、大麦、燕麦、小麦中桔青霉素的测定。但仅涉及容易长霉的谷类和辣椒以及添加红曲发酵的产品,而对于其他大量食品缺少检测标准,如酱油、黄酒等液体食品等。目前桔霉素的检测方法主要有高效液相色谱法[18-22],少数人使用色谱质谱法[23-25],另外还有免疫分析法[26-28]、毛细管电泳分析法[29],早期还有薄层层析法[30]。
1 材料与方法
1.1 试验材料
食品原料:2种酱油、3种黄酒、1种红曲粉,购于杭州市场。
1.2 主要试剂和设备
桔霉素标准品、桔青霉素免疫亲和柱:购于北京泰乐祺科技有限公司;其他试剂:购于杭州禾德化工有限公司。
高效液相色谱仪和FD-20A荧光检测器日本岛津公司;R-220旋转蒸发仪德国Buchi公司。
1.3 实验方法
1.3.1桔霉素的检测
参考SNT 2916-2011和GB 5009.222-2016。高效液相色谱仪,ODS柱(Hypersil ODS 2,5 μm, 250 mm×4.6 mm);流动相:乙腈(色谱纯)∶三氟乙酸水溶液(pH 2.5)为60∶40。流速1.0 mL/min,进样量10 μL,柱温:25 ℃,检测器:RF-20A 荧光检测器,检测波长为λex331 nm,λem500 nm。将桔霉素标准品用甲醇稀释成0.01,0.1,0.2,0.5,1 μg/mL,HPLC检测后制作标准曲线。
检测波长参考GB 5009.222-2016第二法和SN/T 2916-2011的激发波长331 nm,发射波长500 nm。不同于GB 5009.222-2016第一法的激发波长350 nm,发射波长500 nm。本检测的柱温为25 ℃,稍低于GB 5009.222-2016第一法的30 ℃和第二法的28 ℃。
本检测的流动相与SN/T 2916-2011的流动相相同,与GB 5009.222-2016流动相不同。GB 5009.222-2016第一法检测大米、玉米、辣椒的流动相 A 液:乙腈,流动相 B 液: 10 mmol/L 磷酸(pH 2.5);红曲类产品的流动相A液:乙腈,流动相B液: 0.1%磷酸。采用梯度洗脱;第二法流动相为乙腈-异丙醇-磷酸溶液(35∶10∶55)。
本检测的进样量为10 μL。GB 5009.222-2016的进样量为50 μL;SN/T 2916-2011标品的进样量为5 μL,样品的进样量为100 μL。
本检测桔霉素的出峰保留时间为6.1 min左右,标准曲线的回归方程:y=46455x+55766,R2=0.999,线性关系良好。测得仪器的桔霉素的检测限与定量限分别为5,20 μg/kg。
1.3.2桔霉素的分离提取
提取方法参考GB 5009.222-2016第一法和SN/T 2916-2011。粉末样品直接称取10.0 g,加入50 mL提取液甲醇∶水(70∶30,体积比)。液体样品量取50 mL,用旋转蒸发仪在(45±2) ℃下,浓缩至无液体滴出。加入50 mL上述提取液。超声提取20 min,经磁力搅拌器高速搅拌3 min后,玻璃纤维滤纸过滤,收集滤液。吸取1 mL滤液,加0.05% pH 7.5三氟乙酸水溶液(用2 mol/L NaOH调节pH),50 mL定容,再次过滤。
红曲粉提取与GB 5009.222-2016第一法和SN/T 2916-2011相同。GB 5009.222-2016第二法提取溶剂:乙腈-异丙醇-水(35∶10∶55),用磷酸调pH为1.5。与本提取差异较大。
本提取的定容溶液与SN/T 2916-2011相同。GB 5009.222-2016的定容溶液与本方法差异较大。其第一法的定容溶液为10 mmol/L pH 7.5磷酸溶液(大米、玉米、辣椒)和pH 7.0 PBS (磷酸缓冲液)溶液(红曲类);第二法的定容溶液为pH 1.5的磷酸水。
GB 5009. 222-2016和SN/T 2916-2011没有检测液体样品,因此酱油和黄酒按照自己方法提取。
1.3.3纯化方法
参照国标SN/T 2916-2011修改。样品液体1~2滴/s流速,流过桔青霉素免疫亲和柱子,加压至无液体滴出。用5 mL 的0.05% pH 7.5三氟乙酸水溶液洗去杂质,以1~2滴/s 的流速通过柱子,加压至无液体流出,弃去全部流出液。以体积比为70∶30的甲醇∶0.05% pH 2.5三氟乙酸水溶液作为洗脱剂,以1~2 滴/s流速进行洗脱。
洗脱液用量实验:取0.01 μg/mL的桔霉素标准品溶液5 mL按照上述方法实验。每隔1 mL,收集第1~10 mL洗脱液,过0.45 μm有机滤膜后,进HPLC-FLD检测。实验发现收集至3 mL后只有微量的桔霉素。因此,本实验选择洗脱液用量为5 mL。而SN/T 2916-2011洗脱液用量为1 mL。
GB 5009.222-2016第一法对大米、玉米和辣椒用5 mL的10 mmol/L磷酸(pH 7.5)洗柱子,对红曲类用10 mL的0.1%吐温20-PBS溶液洗柱子。而洗脱液前者用1 mL洗脱液I:70% 甲醇-10 mmol/L磷酸溶液(pH 2.5),后者用1 mL洗脱液Ⅱ:70%甲醇-0.1%磷酸溶液。而GB 5009.222-2016第二法采用C18固相萃取柱,用 5 mL水淋洗柱子,用10 mL甲醇洗脱,与本测定差异较大。
1.3.4食品检测的精密度、检测限和定量限实验
取样品红曲粉5份,每份10.0 g,取红曲粉提取液,经过桔青霉素免疫亲和柱纯化、HPLC-FLD检测,对所得的5次峰面积进行统计分析,了解测试精密度。
上述纯化后的液体,稀释不同浓度,HPLC-FLD检测。分别取信噪比3∶1,10∶1时的浓度作为其检测限和定量限。
1.3.5亲和免疫柱回收率实验
分别以50 mL酱油、黄酒及10 g红曲粉为实验对象,分别加入4,6,8 μg桔霉素标准品,预处理和检测方法如上,测定桔霉素回收率。
2 结果与分析
2.1 红曲粉中桔霉素检测精密度、检测限和定量限
红曲粉样品经免疫亲和柱净化处理后能够与其他杂质分开,见图1。

图1 红曲粉样品经免疫柱净化后的色谱图Fig.1 HPLC chromatography of Monascus powder after purified by immunoaffinity column
样品所得相对标准偏差(RSD)为0.823%,GB 5009.222-2016对精密度的要求是在重复条件下获得的2次独立测定结果的绝对差值不得超过算术平均值的 10%,显然该方法具有良好的平行性精密度,符合实验要求,见表1。红曲粉经过免疫亲和柱处理的检测限和定量限分别为16,54 μg/kg,不过柱处理的检测限为195,649 μg/kg。经过纯化后,桔霉素检测限和定量限下降10倍多,见表2。GB 5009.222-2016红曲及其制品的检出限和定量限分别为 25,80 μg/kg。显然检出限和定量限也符合要求。

表1 方法平行性精密度实验Table 1 Precision of parallelity of the method

表2 样品经免疫亲和柱处理后桔霉素检出限和定量限(n=3)Table 2 Citrinin detection limit and quantitation limit in samples treated with purification column(n=3)
国标中第一种检测方法采用桔青霉素免疫亲和柱预纯化方法的红曲及其制品的检出限25 μg/kg、定量限80 μg/kg,比大米、玉米、辣椒粉样品的检出限8 μg/kg、定量限25 μg/kg高。红曲及其制品中对桔霉素检测的干扰物质可能较多。而国标中第二种检测方法采用C18柱预纯化大米、大麦、燕麦、小麦,其检出限为3 μg/kg、定量限为10 μg/kg,与大米相比较,显然后者方法更好。可能与净化方法,或者检测激发波长不同有关。我们采用后者激发波长,采用前者预纯化方法,但是纯化的洗杂液和洗脱液与国标不同。
2.2 免疫亲和柱纯化的回收率
GB 5009.222-2016对桔霉素检测回收率没有要求。已经作废的行业标准SN/T 2916-2011对利用免疫亲和柱检测红曲粉、大米、玉米、辣椒粉的桔霉素的回收率要求在70.25%~88.65%。本方法红曲粉、黄酒、酱油经免疫亲和柱纯化处理后其平均回收率分别为84.72%,86.22%,80.34%。酱油杂质多,回收率相对较低,见表3。
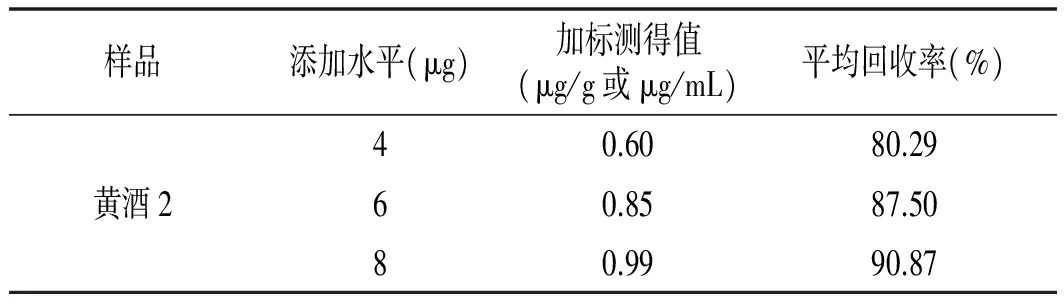
表3 免疫吸附法桔霉素回收率Table 3 Citrinin recoveries after immunoaffinity column

续 表
2.3 食品样品中桔霉素的含量
三类食品中桔霉素含量最高的是酱油,为2.45~2.52 μg/mL,其次是黄酒,为0.63~1.91 μg/mL,这与它们均是由曲霉发酵而来的有关。红曲粉的桔霉素为0.64 μg/g,这与红曲霉具有产生桔霉素基因有关,见表4。表4由于抽样比例较少,初步了解这些产品可能含有桔霉素,尚不能反映这些产品的桔霉素的整体情况。

表4 食品样品的桔霉素含量表 (n=3)Table 4 The content of citrinin in food (n=3)
3 结论
红曲采用70% 甲醇-水(V/V)提取,0.05% pH 7.5三氟乙酸水溶液定容。样品用桔青霉素免疫亲和柱子纯化,用5 mL 的0.05% pH 7.5三氟乙酸水溶液洗去杂质,再以55 mL体积比为70∶30的甲醇∶0.05% pH 2.5三氟乙酸水溶液作为洗脱剂洗脱。纯化后的样品采用高效液相色谱仪、ODS柱。流动相:乙腈∶三氟乙酸水溶液(pH 2.5)为60∶40。流速为1.0 mL/min,进样量为10 μL,柱温为25 ℃,荧光检测器的检测波长为λex331 nm,λem500 nm。红曲粉经过免疫亲和柱处理的检测限和定量限分别为16,54 μg/kg,样品所得相对标准偏差(RSD)为0.823%。红曲粉、黄酒、酱油的平均回收率分别为84.72%,86.22%,80.34%。利用该测定方法,测得市售酱油、黄酒、红曲粉的桔霉素的含量分别为2.45~2.52 μg/mL,0.63~1.91 μg/mL和0.64 μg/g。
参考文献:
[1]El-Banna A A,Pitt J I,Leistner L.Production of mycotoxins byPenicilliumspecies[J].Systematic and Applied Microbiology,1987(10):42-46.
[2]Kurata H.Mycotoxins and mycotoxicoses:Overview[M].Berlin:Springer,1990:249-259.
[3]Blanc P J,Loret M O,Goma G.Production of citrinin by various species ofMonascus[J].Biotechnology Letters,1995,17(3):291-294.
[4]Wong H C,Koehler P E.Production and isolation of an antibiotic fromMonascuspurpureusand its relationship to pigment production[J].Journal of Food Science,1981(46):589-592.
[5]郝常明,罗炜.红曲制品的桔霉素问题及应对措施[J].中国食品添加剂,2002(1):30-33.
[6]许赣荣,卢晨,穆晓青,等.部分红曲霉菌株产桔霉素的研究[J].无锡轻工大学学报,2000,19(1):58-61.
[7]李凤琴,许赣荣,李玉伟,等.国产红曲制品中桔青霉素污染水平研究[J].卫生研究,2005,34(4):451-454.
[8]文镜,贾继春.高效液相色谱法测定红曲醋中桔霉素含量[J].中国酿造,2008,196(19):76-79.
[9]顾双,陈俊霖,王向阳.传统霉菌发酵食品中的霉菌DNA扩增[J].食品科学,2017,38(4):83-86.
[10]王向阳,陈俊霖,王芳,等.食品中桔霉素含量的测定[J].中国调味品,2014,39(11):108-111.
[11]江一菲,徐渊金,王钱,等.高效液相法检测几种米醋中的桔霉素含量[J].中国调味品,2012,37(6):85-88.
[12]徐渊金,王向阳.腐乳中桔霉素提取条件优化及检测方法研究[J].食品与机械,2015,31(2):102-105.
[13]Zaied C,Zouaoui N,Bacha H,et al.Natural occurrence of citrinin in Tunisian wheat grains[J].Food Control,2012,28(1):106-109.
[14]Andersen B,Smedsgaard J,Frisvad J C.Penicilliumexpansum:consistent production of patulin,chaetoglobosins,and other secondary metabolites in culture and their natural occurrence in fruit products[J].Journal of Agricultural and Food Chemistry,2004(52):2421-2428.
[15]GB/T 5009.222-2008,红曲类产品中桔青霉素的测定[S].
[16]SN/T 2426-2010,进出口粮谷中桔霉素含量检测方法液相色谱法[S].
[17]SN/T 2916-2011,出口食品中桔霉素的测定方法免疫亲和柱净化-高效液相色谱法[S].
[18]GB 5009.222-2016,食品中桔青霉素的测定[S].
[19]黄志兵,李燕萍,王延华,等.HPLC法测定橙色红曲菌As3.4384及其诱变体发酵产物中的桔霉素[J].食品科学,2006,27(12):614-617.
[20]王彩霞,肖杰,孙爱东,等.高效液相色谱法检测红曲米中的桔霉素[J].中国粮油学报,2010,25(7):125-128.
[21]樊祥,褚庆华,伊雄海,等.免疫亲和层析净化-高效液相色谱法测定大米中桔霉素[J].理化检验(化学分册),2010,46(8):871-875.
[22]Li X M,Shen X H,Xue L,et al.A validated RP-HPLC method for the determination of citrinin in Xuezhikang capsule and otherMonascusfermented products[J].E-Journal of Chemistry,2012,9(1):260-266.
[23]潘振球,冯家力,王一红,等.液相色谱-串联质谱法检测食品中的桔霉素[J].中国卫生检验杂志.2008,18(11):2192-2215.
[24]李燕,仇峰,杨美华,等.高效液相色谱-串联质谱法测定中药中桔青霉素[J].药物分析杂志,2011,31(9):1726-1730.
[25]Mornar A,Sertic M,Nigovic B.Development of a rapid LC/DAD/FLD/MS(n) method for the simultaneous determination of monacolins and citrinin in red fermented rice products[J].Journal of Agricultural and Food Chemistry,2013(61):1072-1080.
[26]Abramson D,Usleber E,Martlbauer E.An indirect enzyme immunoassay for the myeotoxin citrinin[J].Applied and Environmental Microbiology,1995,61(5):2007-2009.
[27]李泳宁,汪媛媛,郑允权,等.高特异性抗桔霉素单克隆抗体的制备及鉴定[J].生物化学与生物物理进展,2010,37(11):1248-1253.
[28]Arevalo F J,Granero A M,Fernandez H,et al.Citrinin(CIT) determination in rice samples using a micro fluidic electrochemical immunosensor[J].Talanta,2011,83(3):966-973.
[29]陈军,李章万,祁伟,等.高效毛细管电泳分析法检测中药红曲的桔霉素含量[J].中国中药杂志,2007,32(14):1412-1415.
[30]胡晓清,陈福生,邢淑婕,等.红曲中桔霉素的薄层层析分析[J].食品科学,2003,24(5):126-129.

