成都地区鸭源沙门氏菌的分离鉴定及其耐药特征、毒力基因分析
, ,, ,, ,3,,,,3
沙门氏菌(Salmonellaspp.)属肠杆菌科,革兰氏阴性直杆菌,是常见的食源性人兽共患病原菌,以家畜、家禽和野生动物带菌量较多。目前已有2 610个沙门血清型被报道[1],其中部分血清型能引起人体伤寒、副伤寒、胃肠炎、腹泻和败血症等疾病。
国内外学者的报道[2-3]表明,动物性食品在生产中极易受到沙门氏菌的污染。据不完全统计,我国70%~80%的细菌性食物中毒事件是由沙门氏菌引起,其中90%以上是通过动物性食品感染所致[4],严重影响了公众健康;在全球范围,每年大约有9 400万人感染沙门氏菌,约155 000人死于急性感染,其中85%是由动物性食品感染引起[5]。而近年来,由于抗菌药物在养殖业和医疗行业的大量使用,导致沙门氏菌的耐药性逐渐增强,这无疑会加大沙门氏菌感染的防治难度,从而使感染和致死人数增加。就目前相关研究[6]来看,沙门氏菌主要是通过粘附、定植、入侵和释放毒力因子等机制来感染宿主并导致疾病,多种毒力基因参与表达,主要分布在毒力岛(SPI)、鞭毛(Fimbrial)和质粒(Plasmid)上,毒力基因携带率越高,表明沙门氏菌的潜在致病性越强。
我国是鸭养殖和鸭制品生产大国,2005年鸭存栏量就超过了7.25亿只,占世界存栏量的72%左右,一旦沙门氏菌在肉鸭生产链中暴发,并由此传播到人群,将会给食品安全、公众卫生和经济生产带来严重后果。因此,对鸭源沙门氏菌进行深入研究具有重要的卫生学意义,但目前国内外的相关研究主要集中在猪肉源、牛肉源和鸡肉源上,而鲜有关于鸭源沙门氏菌的系统性报道。
本研究旨在调查肉鸭屠宰链中沙门氏菌的污染分布和耐药状况,并从分子层面对其毒力基因的携带情况进行调查,为研究沙门氏菌在肉鸭屠宰加工过程中的流行、传播及其风险评估提供基础数据,并对相关生产提出建议。
1 材料与方法
1.1材料
1.1.1样品来源及采样方法样品采集于四川省成都市某肉鸭屠宰加工公司,屠宰对象为6周龄樱桃谷肉鸭,分别来源于大邑、崇州、新津、邛崃、金堂等地的5家养殖场。根据沙门氏菌的生物学特性与污染途径,确定采样对象为粪样、胴体表面、水样及肉样,采集方式如下:用无菌剪刀剪取净膛后的完整盲肠,置于保鲜袋中,其内容物代表屠宰前粪样;沿屠宰和宰后各环节,随机无菌采集棉拭子样(胴体颈部、背部)、水样(冲淋水、浸池水、车间用水)和肉样(鸭脚、鸭翅)。采集完毕后将所有样品编号并放入有冰袋的隔热泡沫箱中,4 h内低温运回实验室进行下一步处理。
1.1.2菌株肠炎沙门氏菌(Salmonellaenteritidis)CICC21482,大肠杆菌(Escherichiacoli)ATCC25922,均由四川农业大学食品微生物实验室保存。
1.1.3试剂缓冲蛋白胨水(BPW),四硫磺酸钠煌绿(TTB)增菌液,亚硒酸盐胱氨酸(SC)增菌液,木糖赖氨酸脱氧胆盐(XLD)琼脂,法国科马嘉沙门氏菌显色培养基,水解酪蛋白(MH)琼脂等均购于杭州微生物试剂有限公司;三糖铁(TSI)琼脂,靛基质试剂,尿素琼脂,赖氨酸脱羧酶试验培养基等购自北京奥博星生物技术有限责任公司;DL-2000 DNA Marker、GoldviewTM核酸染料、Premix Taq Version 2.0、琼脂糖购自宝生物工程(大连)有限公司;沙门氏菌属诊断血清(60种)试剂盒购自宁波天润生物药业有限公司。
1.1.4主要仪器BSC—1300ⅡA2 型生物安全柜(苏州安泰空气技术有限公司);电热恒温培养箱(上海一恒科学仪器有限公司);Bio-Rad C1000梯度PCR扩增仪、Bio-Rad GelDoc XR凝胶成像系统、水平电泳槽(美国Bio-Rad公司)。
1.1.5抗菌药物青霉素类:氨苄西林(AMP,10 μg/片)、阿莫西林/克拉维酸(AMC,20/10 μg/片);头孢类:头孢曲松(CRO,30 μg/片);氨基糖苷类:庆大霉素(GEN,10 μg/片)、卡那霉素(KAN,30 μg/片);四环素类:四环素(TET,30 μg/片)、米诺环素(MH,30 μg/片);磺胺类:甲氧苄啶/磺胺甲噁唑(SXT,1.25/23.75 μg/片);喹诺酮类:萘啶酸(NAL,30 μg/片)、环丙沙星(CIP,5 μg/片)。均购于杭州微生物试剂有限公司。
1.2方法
1.2.1菌株分离纯化参照GB 4789.4-2010[7]的方法对样品进行处理和增菌。用无菌接种环取增菌液划线接种于XLD琼脂平板,在培养箱中37 ℃条件培养18~24 h。根据GB 4789.4-2010[7]中的判断方法,判定并挑取可疑菌落划线接种于科马嘉沙门氏菌显色培养基,于37 ℃条件下培养18~24 h,根据菌落形态挑取紫色、蓝紫色或浅紫色圆形光滑菌落进行分离纯化。
1.2.2生化鉴定按照GB 4789.4-2010[7]的方法,对分离株进行革兰氏镜检、三糖铁琼脂培养和赖氨酸脱羧酶试验,并按标准判定沙门氏菌疑似菌株。
1.2.3双重PCR鉴定参照邵碧英等[8]的方法进行。针对沙门氏菌invA基因和hut基因设计两对特异性引物,由宝生物工程(大连)有限公司合成。PCR反应体系为:2×PCR Mix 12.5 μL,invA基因和hut基因上下游引物0.2 μL、0.6 μL,DNA模板 2 μL,补灭菌超纯水使最终反应体系为25 μL。将PCR产物于1.5%琼脂糖(0.5×TBE)凝胶电泳30 min后,凝胶成像系统分析结果,能同时扩增出invA基因和hut基因特异性片段的菌株判定为沙门氏菌阳性菌株。
1.2.4血清型分型按照GB 4789.4-2010[7]的方法,用沙门氏菌属诊断血清(60种)试剂盒对PCR阳性菌株进行血清分型。
1.2.5药敏试验按照CLSI推荐的纸片扩散法[9],对阳性菌株进行10种常用抗菌药物敏感性试验,以大肠杆菌ATCC25922为质控菌株。记录各类药物对阳性菌株产生的抑菌圈直径,并根据CLSI标准[8]对试验结果进行判定。
1.2.6毒力基因检测根据文献设计沙门氏菌毒力岛(avrA[10]、ssaQ[11]、mgtC[11]、siiD[11]、sopB[11])、鞭毛(bcfC[12])、质粒(spvR[13]、spvB[13]、spvC[14])三大类毒力基因引物,由宝生物工程(大连)有限公司合成。PCR反应体系为:2×PCR premix 12.5 μL、DNA模板2 μL、上下游引物各1 μL,补灭菌超纯水使最终反应体系为25 μL。PCR产物于1.5%琼脂糖(1.0×TAE)凝胶电泳30 min后,凝胶成像系统分析结果。
2 结 果
2.1沙门氏菌分离情况结合镜检观察和生化试验,从343份样品中总共分离纯化得到99株沙门氏菌疑似菌株(表1),宰前样品沙门疑似菌株检出率(45.71%)最高。沿着脱毛环节向下,疑似沙门氏菌检出率总体有所升高,其中车间用水中有沙门疑似菌株检出。双重PCR鉴定结果显示,99株疑似沙门氏菌均能同时扩增出284 bp(invA)和495 bp(hut)两条特异性条带(图1),阳性率为100%。
表1肉鸭屠宰链沙门氏菌分离情况
Tab.1Prevalence of Salmonella spp.from the duck slaughter chain

SourceSampleNSalmonellaspp.(%)BeforeslaughteringCecumcontent3516(45.71)DepilationstageSurfaceswab&rinsewater9722(22.68)EviscerationstageSurfaceswab&rinsewater8922(24.72)DuckmeatDuckfeet&duckwing6023(38.33)AfterslaughteringSurfaceswab&products&soakingwater&plantwater6216(25.81)Total34399(28.86)
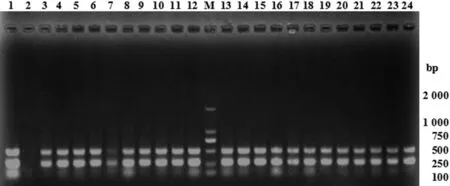
M: DL 2000 DNA Marker; 1: S.enteritidis CICC21482; 2: negative control; 3-12,13-24: part of samples图1 部分沙门氏菌双重PCR电泳图Fig.1 Electrophoresis of duplex PCR amplified products from part of the isolated Salmonella spp.
2.2沙门氏菌分离菌株血清分型99株沙门氏菌阳性分离株有91株可以定型,5株只能定群,剩余3株产生了自凝现象不能分型。已定型的菌株共产生了7种血清型(表2),以印第安纳沙门氏菌(S.Indiana)、纽兰沙门氏菌(S.Newlands)和鸭沙门氏菌(S.Anatum)为优势血清型,优势血清群为B群和E1群。其中车间用水分离株产生了纽兰和鸭沙门氏菌两种血清型。在屠宰链生产链中,印第安纳沙门氏菌检出量沿屠宰链逐渐减少,而纽兰沙门氏菌则呈上升趋势;鸭沙门氏菌在分割肉样中检出较多,伤寒沙门氏菌(S.Typhi)只在宰前和屠宰环节有检出,阿贡纳沙门氏菌(S.Agona)只在屠宰环节有检出,鼠伤寒沙门氏菌(S.Typhimurium)只在分割肉样中有检出。
表2肉鸭屠宰链沙门氏菌分离株血清分型结果
Tab.2Serotyping of Salmonella spp.from the duck slaughter chain
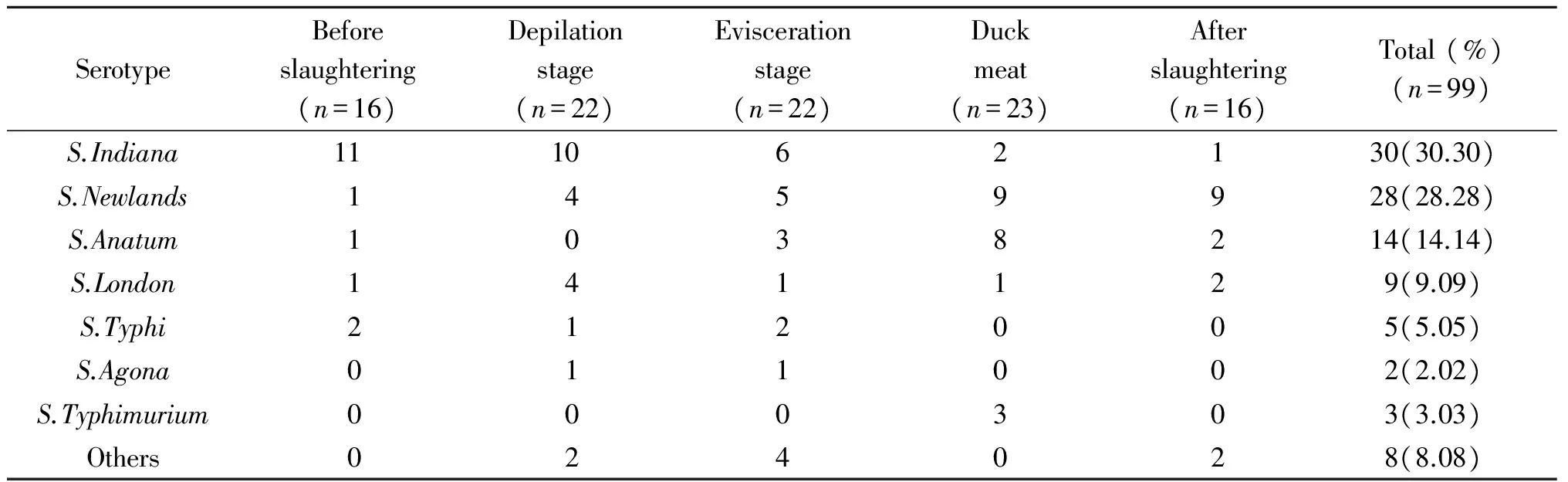
SerotypeBeforeslaughtering(n=16)Depilationstage(n=22)Eviscerationstage(n=22)Duckmeat(n=23)Afterslaughtering(n=16)Total(%)(n=99)S.Indiana111062130(30.30)S.Newlands1459928(28.28)S.Anatum1038214(14.14)S.London141129(9.09)S.Typhi212005(5.05)S.Agona011002(2.02)S.Typhimurium000303(3.03)Others024028(8.08)
2.3沙门氏菌分离株药敏试验
2.3.1沙门氏菌分离株耐药率99株沙门氏菌对10种常见抗菌药的耐药率统计如表3所示,96.97%的菌株具有耐药性。分离株对NAL的耐药率最高,达到了91.92%。不同血清型产生了不同的耐药特征,其中伤寒和鼠伤寒沙门氏菌对AMP、TET、NAL的耐药率均达到了100%,印第安纳沙门氏菌对8种抗菌药的耐药率都在50%以上,耐药性较为突出;纽兰和鸭沙门氏菌对NAL的耐药率较高,对其他抗菌药的耐药率则处于较低水平。
表3鸭源沙门氏菌对不同抗菌药物的耐药率(%)
Tab.3Resistance rates of duck originated Salmonella spp.against 10 antimicrobial agents

AntimicrobialagentsS.Indiana(n=30)S.Newlands(n=28)S.Anatum(n=14)S.London(n=9)S.Typhi(n=5)S.Agona(n=2)S.Typhimurium(n=3)Others(n=8)Salmonellaspp.(n=99)AMP66.677.1414.2944.44100.0050.00100.0062.5042.42AMC3.330.000.000.000.000.00100.0025.006.06CRO60.000.007.1422.2260.000.00100.000.0027.27GEN50.000.000.0033.3340.000.00100.0012.5024.24KAN50.003.570.0011.11100.0050.000.000.0023.23TET86.673.577.1433.33100.0050.00100.0037.5043.43MH16.677.140.000.0040.000.000.000.009.09SXT66.673.577.1433.3360.0050.00100.0025.0034.34NAL93.3392.8692.86100100.0050.00100.0075.0091.92CIP56.670.000.0033.3380.0050.00100.0012.529.29
2.3.2沙门氏菌分离株多重耐药率及耐药谱沙门氏菌分离株中多重耐药菌株(耐3种及以上抗菌药物)占47.47%(图2),其中耐4种(10.10%)、7种(11.11%)及8种(9.09%)抗生素的菌株较多,未出现同时耐10种抗菌药物的菌株。伤寒沙门氏菌(S.Typhi)和鼠伤寒沙门氏菌(S.Typhimurium)的多重耐药率达到了100%(表5),其中伤寒沙门氏菌集中在7耐(80.00%),鼠伤寒沙门氏菌集中在8耐(100.00%);印第安纳沙门氏菌(S.Indiana)多重耐药率高达93.33%,其中4耐(20.00%)和8耐(20.00%)菌株较多,并有9耐(6.67%)菌株出现;伦敦沙门氏菌(S.London)多重耐药率为44.44%,相对较低,主要集中在7耐(33.33%);纽兰沙门氏菌(S.Newlands)和鸭沙门氏菌(S.Anatum)的多重耐药率最低,分别为3.57%和7.14%,多数菌株只耐NAL一种药物。
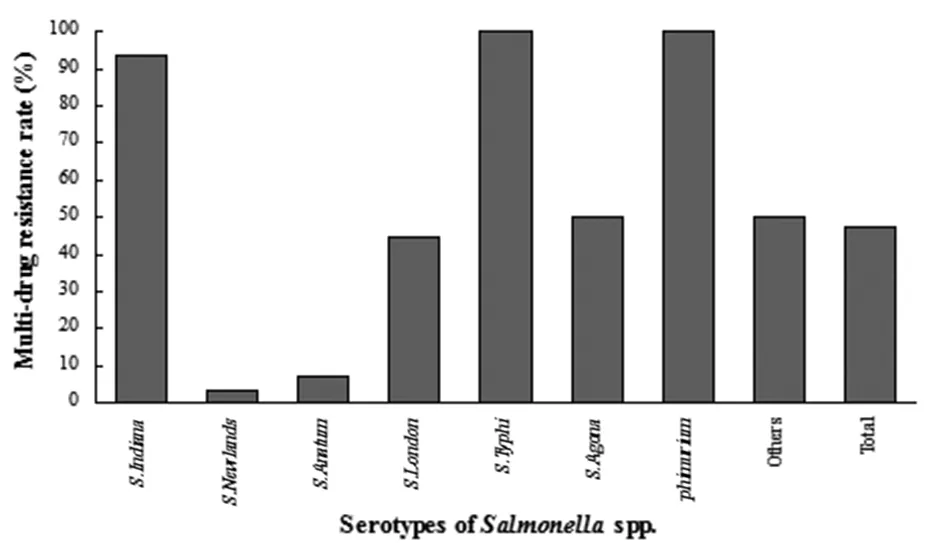
图2 鸭源沙门氏菌多重耐药分布情况Fig.2 Multi-drug resistance distribution of duck originated Salmonella spp.
99株沙门氏菌对10种抗菌药物产生了34种耐药谱,其中优势谱型为NAL,占到了40.40%。印第安纳沙门氏菌产生了19种耐药谱,优势谱型为AMP-CRO-GEN-KAN-TET-SXT-NAL-CIP(16.67%);纽兰沙门氏菌产生了5种耐药谱,优势谱型为NAL(82.14%);鸭沙门氏菌产生了3种耐药谱,优势谱型为NAL(85.71%);伦敦沙门氏菌产生了4种耐药谱,优势谱型为NAL(55.56%);伤寒沙门氏菌产生了4种耐药谱,优势谱型为AMP-CRO-GEN-KAN-TET-NAL-CIP(40.00%);鼠伤寒沙门氏菌只产生了AMO-AMC-CRO-GEN-TET-SXT-NAL-CIP一种耐药谱。
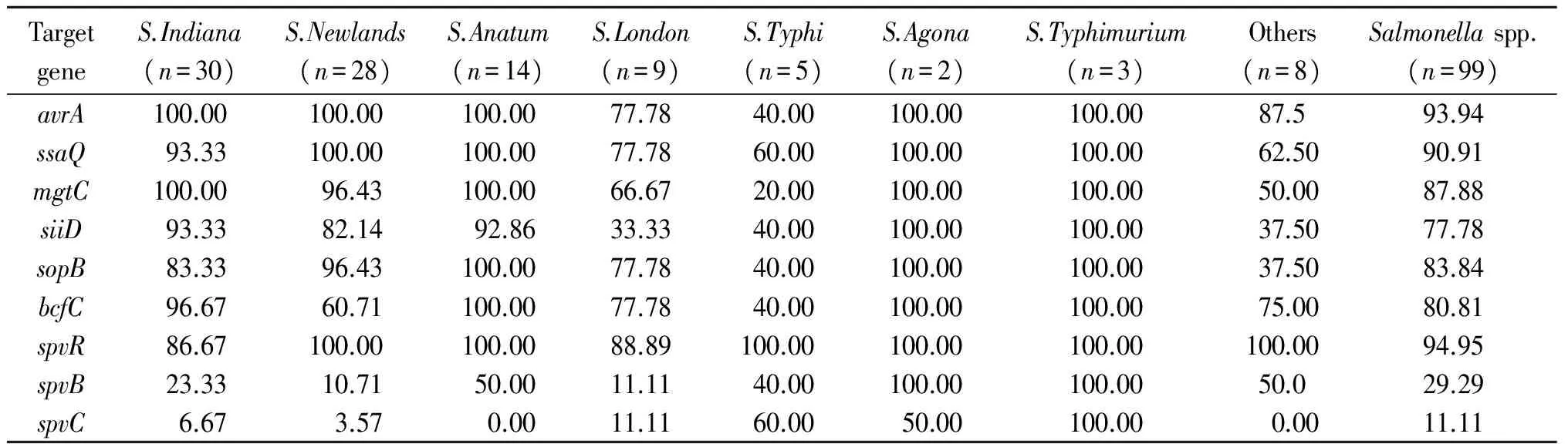
2.4沙门氏菌分离株毒力基因检测99株沙门氏菌均有毒力基因检出(表4),其中avrA、ssaQ、spvR的检出率最高,分别为93.94%、90.91%、94.95%;mgtC、siiD、sopB、bcfC的检出率较高,分别为87.88%、77.78%、83.84%、80.81%;spvB和spvC的检出率最低,分别为29.29%和11.11%。鼠伤寒沙门氏菌对9种毒力基因的检出率均达到了100.00%(图3);伤寒沙门氏菌的检测结果表现出了一定差异,对avrA、ssaQ、mgtC、siiD、sopB和bcfC的检出率分别为40.00%、60.00%、20.00%、40.00%、40.00%和40.00%,明显低于其他血清型。
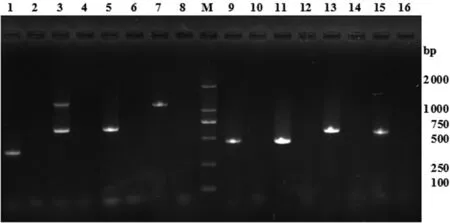
M: DL 2000 DNA Marker; 1,3,5,7,9,11,13,15: PCR products of avrA,ssaQ and siiD,mgtC,sopB,bcfC,spvR,spvB,spvC gene; 2,4,6,8,10,12,14,16: negative control of avrA,ssaQ and siiD,mgtC,sopB,bcfC,spvR,spvB,spvC gene图3 鼠伤寒沙门氏菌毒力基因PCR检测电泳图Fig.3 Electrophoresis of virulence genes PCR amplified products from S.Typhimurium
表4鸭源沙门氏菌毒力基因检测结果(%)
Tab.4Detection results of virulence genes carried by Salmonella spp.in duck slaughterhouse
TargetgeneS.Indiana(n=30)S.Newlands(n=28)S.Anatum(n=14)S.London(n=9)S.Typhi(n=5)S.Agona(n=2)S.Typhimurium(n=3)Others(n=8)Salmonellaspp.(n=99)avrA100.00100.00100.0077.7840.00100.00100.0087.593.94ssaQ93.33100.00100.0077.7860.00100.00100.0062.5090.91mgtC100.0096.43100.0066.6720.00100.00100.0050.0087.88siiD93.3382.1492.8633.3340.00100.00100.0037.5077.78sopB83.3396.43100.0077.7840.00100.00100.0037.5083.84bcfC96.6760.71100.0077.7840.00100.00100.0075.0080.81spvR86.67100.00100.0088.89100.00100.00100.00100.0094.95spvB23.3310.7150.0011.1140.00100.00100.0050.029.29spvC6.673.570.0011.1160.0050.00100.000.0011.11
3 讨 论
本研究沙门氏菌总体分离率为28.86%,与Li等[15](26.9%)的报道较为一致,低于Cha等[16](43.4%)的报道,而高于Dong等[17](6.5%)的报道,出现该结果的原因可能是不同地区沙门氏菌的流行情况不同,也可能与采样方式、采样季节、分菌方法等有关。沿屠宰链观察,宰前样品沙门氏菌检出率最高;沿脱毛环节向下,沙门氏菌检出率有所上升,与Wang等[2]的研究结果不同,结合各环节沙门氏菌分离株的血清型和耐药表型分析,推测受沙门氏菌污染的车间用水通过冲淋、浸泡等方式对脱毛后的样品造成了污染。此外,宰后样品的沙门氏菌检出率达到了25.81%,一定程度上影响了鸭制食品的食用安全。
已定型的沙门氏菌所产生的7种血清型均为国内沙门氏菌常见血清型,优势血清群为B群和E1群,与李郁等[4]研究一致。本次研究无常见的肠炎沙门氏菌(S.Enteritidis)及德尔卑沙门氏菌(S.Derby)检出,而印第安纳沙门氏菌和纽兰沙门氏菌的检出率较高,与Imen等[18]、Yang等[19]学者的研究有所差异。沿屠宰链观察,印第安纳沙门氏菌检出量呈下降趋势,这与样品的热烫和冲淋有关;纽兰和鸭沙门氏菌检出量呈上升趋势,经推测是样品被车间用水污染所造成;其他劣势血清型在屠宰链的分布无规则性,其中伤寒、阿贡纳和鼠伤寒沙门氏菌只在个别环节有检出,可能是工作人员和屠宰环境对屠宰对象形成了交叉污染。所检出的7种血清型中,伦敦沙门氏菌、阿贡纳沙门氏菌和鼠伤寒沙门氏菌在我国均有人群感染致病事件出现,说明鸭源沙门氏菌对公众健康具有潜在的威胁。
药敏试验结果显示分离株对萘啶酸的耐药率最高,对阿莫西林/克拉维酸的耐药率最低,与Cha等[16]的报道较为一致。而分离株对其他抗菌药的耐药率普遍低于国内外学者的报道[20-21],差异性明显,这与不同国家和地区在养殖业中常用的抗菌药物种类不同有关,也与耐药性在沙门氏菌中的水平传播机制有一定联系。本研究中鸭源沙门氏菌的多重耐药率为47.47%,高于Vo AT等[22](29%)的报道,而低于Pan等[20](81.5%)的报道,除去地域和时间因素外,抗菌药物的选择和水体污染(车间用水分离出的纽兰和鸭沙门氏菌只耐NAL)也会对该结果有一定影响。不同沙门氏菌血清型表现出了不同的耐药特征,共产生了34种耐药谱,其中以印第安纳沙门氏菌、伤寒沙门氏菌和鼠伤寒沙门氏菌的耐药性最为突出,与Yang等[19]的研究结果比较一致。一旦具有多重耐药性的沙门氏菌通过鸭肉传播到人群,无疑会给沙门氏菌感染的防治带来严重的挑战,因而必须加强抗菌药物的管控和合理使用。
毒力基因检测结果显示沙门氏菌分离株对spvR、avrA、ssaQ、mgtC、siiD、sopB、bcfC的携带率较高,说明鸭源沙门氏菌具有较强的潜在致病性。但毒力基因的总体携带率与Graciela等[3]、Li等[23]的研究相比存在一定差异,这可能与菌株来源或血清型的不同有关。此外本研究还发现鼠伤寒沙门氏菌对9种毒力基因的携带率均达到了100.00%,与该血清型的强致病性对应明显。
本次研究选择将肉鸭作为研究对象,明确了肉鸭屠宰生产链中沙门氏菌的污染分布、耐药状况及毒力基因分布情况,结果显示肉鸭屠宰生产链容易受到不同血清型、不同耐药表型,且毒力基因携带率高的沙门氏菌污染,一旦失控将会对食品安全和公众健康造成严重的后果。对此,相关食品公司应当改善加工环境,加强水源保护,合理使用抗菌药物并随时关注工作人员的健康状况,同时相关部门也应当加强卫生监督,合力保障食品安全和公众健康。
参考文献:
[1] Mezal EH,Sabol A,Khan MA,et al.Isolation and molecular characterization ofSalmonellaentericaserovar Enteritidis from poultry house and clinical samples during 2010[J].Food Microbiol,2014,38: 67-74.DOI: 10.1016/j.fm.2013.08.003
[2] Wang H,Ye K,Wei X,et al.Occurrence,antimicrobial resistance and biofilm formation ofSalmonellaisolates from a chicken slaughter plant in China[J].Food Ctrl,2013,33(2):378-384.DOI: 10.1016/j.foodcont.2013.03.030
[3] Graciela L,Geovana M,Marisa C,et al.Antimicrobial resistance and class 1 integron-associated gene cassettes inSalmonellaentericaserovar Typhimurium isolated from pigs at slaughter and abattoir environment[J].Vet Microbiol,2016,194: 84-92.DOI:10.1016/j.vetmic.2016.04.020
[4] Li Y,Jiao XA,Wei JZ,et al.Analysis on the serotypes and drug-susceptibility ofSalmonellaisolates from pig carcass[J].Chin J Zoonoses,2008,24(1): 67-70.(in Chinese)
李郁,焦新安,魏建忠,等.屠宰生猪沙门氏菌分离株的血清型和药物感受性分析[J].中国人兽共患病学报,2008,24(1):67-70.DOI: 10.3969/j.issn.1002-2694.2008.01.017
[5] Yang XJ,Huang JH,Wu QP,et al.Prevalence,antimicrobial resistance and genetic diversity ofSalmonellaisolated from retail ready-to-eat foods in China[J].Food Ctrl,2016,60(2): 50-56.DOI: 10.1016/j.foodcont.2015.07.019
[6] Cao TX,Jiang WC,He WC,et al.Research progress on virulence factors ofSalmonella[J].Chin J Prevent Vet Med,2014,36(4): 331-334.(in Chinese)
曹恬雪,蒋文灿,何文成,等.沙门氏菌毒力因子的研究进展[J].中国预防兽医学报,2014,36(4): 331-334.DOI: 10.3969/j.issn.1008-0589.2014.04.19
[7] National Health and Family Planning Commission of the People’s Republic of China.GB 4789.4-2010.National standards for food safety,food microbiology testing,Salmonellaspp [S].Beijing: China Standard Press,2010.(in Chinese)
中华人民共和国国家卫生和计划生育委员会.GB 4789.4-2010.食品安全国家标准,食品微生物学检验,沙门氏菌检验[S].北京: 中国标准出版社,2010.
[8] Shao BY,Chen B,Tang MY,et al.Development of multiplex PCR detection method forSalmonella[J].Food Sci,2007,28(10): 489-492.(in Chinese)
邵碧英,陈彬,汤敏英,等.沙门氏菌多重PCR检测方法的建立[J].食品科学,2007,28(10): 489-492.DOI: 10.3321/j.issn:1002-6630.2007.10.124
[9] CLSI.M100-S19 Performance standards for antimicrobial susceptibility testing[S].Wayne: Clinical and Laboratory Standards Institute,2016.
[10] Rita P,Susanne M,Erhard T,et al.Prevalence and polymorphism of genes encoding translocated effector proteins among clinical isolates ofSalmonellaenterica[J].Int J Med Microbiol,2000,290: 605-617.DOI: 10.1016/S1438-4221(00)80009-0
[11] Sara MS,Irene R,Rodicio MR,et al.Detection of virulence determinants in clinical strains ofSalmonellaentericaserovar Enteritidis and mapping on macrorestriction profiles[J].Int J Med Microbiol,2006,55: 365-373.DOI: 10.1099/jmm.0.46257-0
[12] Stephan H,Roberto M,Muna A,et al.Virulotyping and antimicrobial resistance typing ofSalmonellaentericaserovars relevant to human health in Europe[J].Foodborne Pathog Dis,2010,7: 523-535.DOI: 10.1089/fpd.2009.0447
[13] Cheng Q,Pang RL,Wang RC,et al.Comparative study on pathogenicity ofSalmonellaisolates from different sources of laboratory mice and the detection of their virulence genes[J].Chin J Zoonoses,2013,29(5): 460-465.(in Chinese)
程琼,庞瑞亮,王若晨,等.不同源沙门氏菌对小鼠致病力的比较与毒力基因检测[J].中国人兽共患病学报,2013,29(5): 460-465.DOI: 10.3969/cjz.j.issn.1002-2694.2013.05.008
[14] Fatemeh F,Mohammad D,Masoumeh D,et al.Genetic diversity and virulence genes ofSalmonellaentericasubspeciesentericaserotype Enteritidis isolated from meats and eggs[J].Microbial Pathogenesis,2017,107: 451-456.DOI: 10.1016/j.micpath.2017.04.026
[15] Li R,Lai J,Wang Y,et al.Prevalence and characterization ofSalmonellaspecies isolated from pigs,ducks and chickens in Sichuan Province,China[J].Intl J Food Microbiol,2013,163(1): 14-18.DOI: 10.1016/j.ijfoodmicro.2013.01.020
[16] Cha SY,Kang M,Yoon RH,et al.Prevalence and antimicrobial susceptibility ofSalmonellaisolates in Pekin ducks from South Korea[J].Comparat Immunol Microbiol Infect Dis,2013,36(5): 473-479.DOI: 10.1016/j.cimid.2013.03.004
[17] Dong P,Zhu L,Mao Y,et al.Prevalence and profile ofSalmonellafrom samples along the production line in Chinese beef processing plants[J].Food Ctrl,2014,38(4): 54-60.DOI: 10.1016/j.foodcont.2013.09.066
[18] Imen F,Amal BH,Noel G,et al.Genetic diversity of food-isolatedSalmonellastrains through Pulsed Field Gel Electrophoresis (PFGE) and Enterobacterial Repetitive Intergenic Consensus (ERIC-PCR)[J].PLoS One,2013,8(12): E81315.DOI: 10.1371/journal.pone.0081315
[19] Yang B,Qu D,Zhang X,et al.Prevalence and characterization ofSalmonellaserovars in retail meats of marketplace in Shaanxi,China[J].Intl J Food Microbiol,2010,141(1): 63-72.DOI: 10.1016/j.ijfoodmicro.2010.04.015
[20] Pan Z,Wang X,Zhang X,et al.Changes in antimicrobial resistance amongSalmonellaentericasubspecies enterica serovar Pullorum isolates in China from 1962 to 2007[J].Vet Microbiol,2009,136(3): 387-392.DOI: 10.1016/j.vetmic.2008.11.015
[21] Oueslati W,Rjeibi MR,Mhadhbi M,et al.Prevalence,virulence and antibiotic susceptibility ofSalmonellaspp.strains,isolated from beef in Greater Tunis (Tunisia)[J].Meat Sci,2016,119: 154-159.DOI: 10.1016/j.meatsci.2016.04.037
[22] Vo AT,Van DE,Fluit AC,et al.Antibiotic resistance,integrons andSalmonellagenomic island 1 among non-typhoidalSalmonellaserovars in the Netherlands[J].Intl J Antimicrob Agents,2006,28(3): 172-179.DOI: 10.1016/j.ijantimicag.2006.05.027
[23] Li K,Ye S,Walid QA,et al.Antimicrobial susceptibility,virulence gene and pulsed-field gel electrophoresis profiles ofSalmonellaentericaserovar Typhimurium recovered from retail raw chickens,China[J].Food Ctrl,2017,72: 36-42.DOI: 10.1016/j.foodcont.2016.07.032

