马属动物隐孢子虫和隐孢子虫病研究进展
,
隐孢子虫(Cryptosporidium)是重要的食源性和水源性人兽共患原虫之一,属内种类和基因型较多,多数具有宿主适应性,对宿主的致病性存在差异,同时其基因型分布存在地理特征[1-2]。隐孢子虫病被认为是人类最常见的6种腹泻疾病之一,免疫功能正常者呈自限性感染,而对儿童、HIV感染者及免疫缺陷疾病患者则引起急性、迁延性和慢性腹泻,甚至导致死亡[2]。
马属动物主要包括家马、家驴、野马、野驴和斑马,其中家马和家驴在人类历史上作出过巨大贡献。在农牧业生产、交通运输、军事战斗、贸易交往、通讯及竞技体育等方面发挥重要作用。寄生于马属动物的隐孢子虫不仅可导致幼龄动物严重腹泻甚至死亡,而且可引起人体感染,具有重要的公共卫生意义[3-6]。1978年,Snyder 等[3]首次在免疫缺陷的阿拉伯马马驹体内发现隐孢子虫。此后,世界范围内陆续有马隐孢子虫病的研究报道。本文就近年来寄生于马属动物的隐孢子虫种类和基因型、人兽共患风险、致病性和地理隔离特征等研究作一综述。
1 种类和基因型
早期通过显微镜观察,寄生于马的隐孢子虫感染种类未能准确鉴定。近年来基于分子生物学检测,马感染的隐孢子虫种类/基因型呈现多样性,以微小隐孢子虫(C.parvum)和隐孢子虫马基因型(C.horse genotype)为主要感染种类/基因型,全世界均有分布,而其他种类或基因型则多呈散发,见表1。其中人兽共患的有C.parvum、人隐孢子虫(C.hominis)、刺猬隐孢子虫(C.erinacei)、鼠隐孢子虫(C.muris)、猫隐孢子虫(C.felis)、泛在隐孢子虫(C.ubiquitum)、C.horse genotype和隐孢子虫猪基因型(C.pig genotype)。有关驴感染的隐孢子虫种类/基因型的报道较少,目前发现的有C.parvum、C.hominis、C.muris和Cryptosporidiumhorsegenotype,见表1。
表1马属动物的隐孢子虫种类/基因型
Tab.1The species/genotype of Cryptosporidium in equine
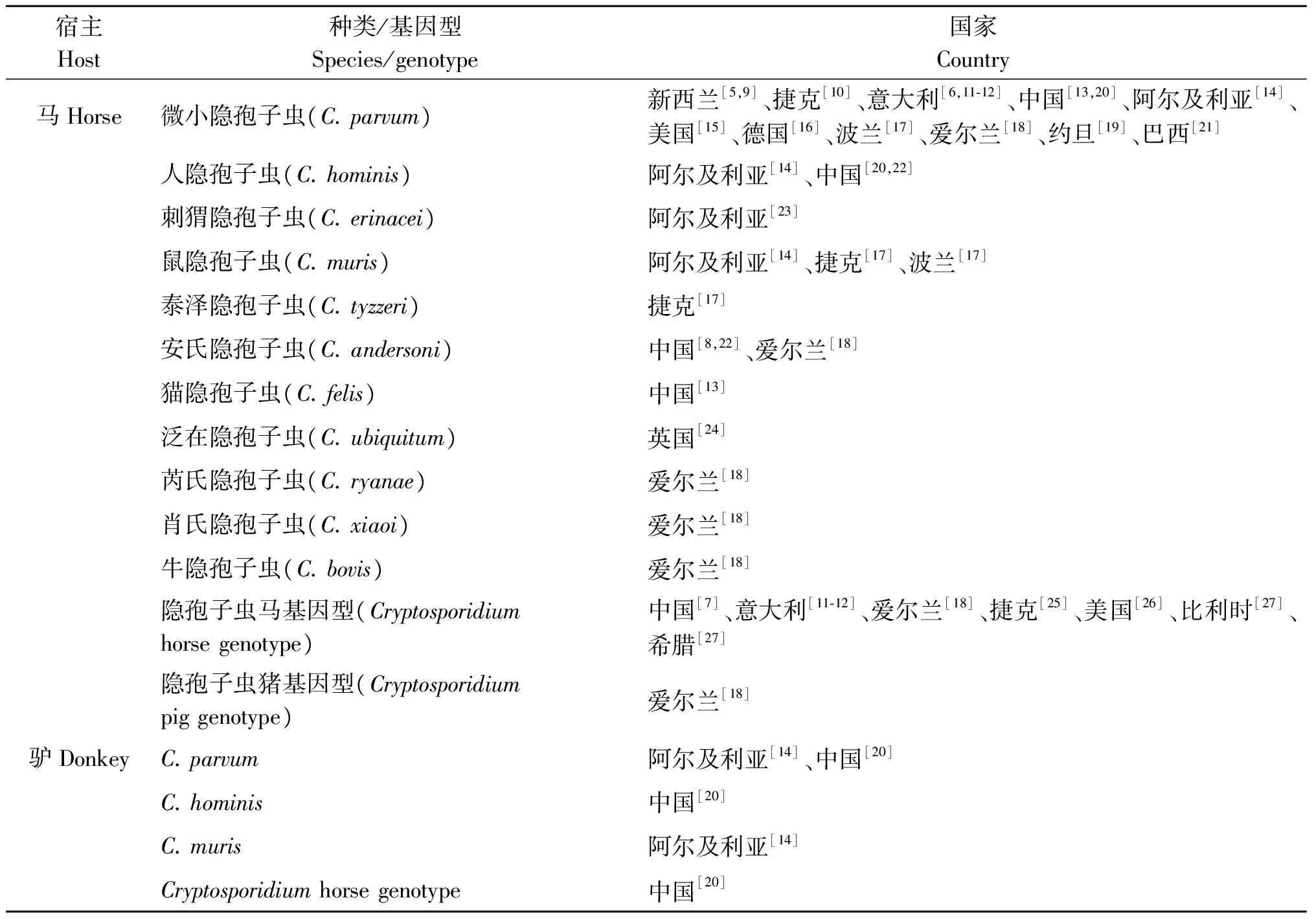
宿主Host种类/基因型Species/genotype国家Country马Horse微小隐孢子虫(C.parvum)新西兰[5,9]、捷克[10]、意大利[6,11⁃12]、中国[13,20]、阿尔及利亚[14]、美国[15]、德国[16]、波兰[17]、爱尔兰[18]、约旦[19]、巴西[21]人隐孢子虫(C.hominis)阿尔及利亚[14]、中国[20,22]刺猬隐孢子虫(C.erinacei)阿尔及利亚[23]鼠隐孢子虫(C.muris)阿尔及利亚[14]、捷克[17]、波兰[17]泰泽隐孢子虫(C.tyzzeri)捷克[17]安氏隐孢子虫(C.andersoni)中国[8,22]、爱尔兰[18]猫隐孢子虫(C.felis)中国[13]泛在隐孢子虫(C.ubiquitum)英国[24]芮氏隐孢子虫(C.ryanae)爱尔兰[18]肖氏隐孢子虫(C.xiaoi)爱尔兰[18]牛隐孢子虫(C.bovis)爱尔兰[18]隐孢子虫马基因型(Cryptosporidiumhorsegenotype)中国[7]、意大利[11⁃12]、爱尔兰[18]、捷克[25]、美国[26]、比利时[27]、希腊[27]隐孢子虫猪基因型(Cryptosporidiumpiggenotype)爱尔兰[18]驴DonkeyC.parvum阿尔及利亚[14]、中国[20]C.hominis中国[20]C.muris阿尔及利亚[14]Cryptosporidiumhorsegenotype中国[20]
2 人兽共患风险
2003年,Ryan等[23]基于隐孢子虫的小亚基核糖体RNA (18S rRNA)基因位点,对捷克的普氏野马隐孢子虫分离株进行扩增和测序,构建系统进化树发现该分离株位于一个独立的分支上,将其命名为C.parvumhorse genotype,现为Cryptosporidiumhorse genotype。随后在美国、意大利、德国、希腊、中国和爱尔兰等国家马粪便样品中发现该基因型,见表1。近年在爱尔兰犊牛,日本宠物刺猬,英国和美国腹泻患者粪便样品中发现该基因型,表明该基因型并非具有严格的宿主特异性,存在人兽共患风险[28-30]。在英国的来自农村的30岁免疫功能正常女性,曾有过国外旅行史和公共场所游泳,但未和动物有过直接接触,推测可能是饮用或接触动物粪便污染的水源导致感染[28];美国的患者为18岁免疫功能正常女性,在宠物店内从事照顾腹泻的犬、猫、兔和刺猬等宠物的工作,未接触过马、牛等家畜,当时调查认为宠物并不能传播Cryptosporidiumhorse genotype,而新近的调查发现,宠物刺猬可以感染该基因型,据此推断患者可能因接触腹泻的刺猬而导致感染[29-30]。
C.parvum是最为重要的人兽共患种类,可感染100多种哺乳动物,含有卵囊的动物粪便粪污染水源和食物是导致人体隐孢子虫病暴发的主要因素[2]。现有的调查资料显示,世界范围内,C.parvum是马最常见感染的隐孢子虫种类(见表1)。新近意大利的一项调查发现,在一个马场马驹因感染C.parvum导致严重腹泻,6名学生同时感染C.parvum,表现为腹痛和腹泻,其亚基因型一致,证实马是人类感染隐孢子虫病的主要传染源之一[4]。2015年,在阿拉尔及利亚发现驴感染C.parvum,随后在我国河南和山东家畜交易市场的驴均发现了C.parvum,鉴定的亚基因型均为人兽共患,提示驴也存在隐孢子虫人兽共患风险[14,20]。
C.hominis具有严格的宿主特异性,除试验动物感染外,自然宿主几乎仅感染人。2015年,Laatamna等[14]对阿尔及利亚的马进行调查发现马可感染C.hominis,随后在中国和巴西的马粪便中也发现C.hominis[20,22-23]。在我国的调查发现,C.hominis为驴感染隐孢子虫的优势种类,且较马更易感染[20]。马属动物源C.hominis生物学特性有待于进行深入研究,以阐明其人兽共患传播。
C.muris主要感染啮齿类,现发现其自然宿主越来越多,包括人、鸟类、爬行动物等,在波兰和捷克的马、阿尔及利亚的马和驴粪便中均发现该种,研究结果不能确定为马属动物自然感染还是隐孢子虫卵囊机械传播,需进一步调查研究[16,19,21]。
C.erinacei最初发现于刺猬,近年在人和马粪便样品中均发现该种感染,而宠物刺猬体内发现感染Cryptosporidiumhorse genotype,表明两者或可存在协同进化[23,29]。C.felis是常见的人兽共患隐孢子虫之一,在我国台湾马粪便中发现C.felis和C.parvum,均具有重要的人兽共患风险[13]。
在我国黑龙江的成年马粪便中发现反刍动物特异性的C.andersoni,根据种系发育分析证实其在牛和马之间具有共患性[8]。新近在我国四川马粪便样本中同样发现了C.andersoni和C.hominis[22]。在爱尔兰利菲河流域马粪便中也发现了C.andersoni,同时还发现了具有牛和羊宿主特异性的C.ryanae、C.bovis和C.xiaoi,以及C.pig genotype,推测与该区域马、牛和羊在同一草场放牧有直接相关关系[18]。
3 致病性
世界范围内,根据不同的检测方法,马隐孢子虫感染率为0%~37%,早期调查多采用显微镜检测,可能因假阳性而感染率较高,采用分子生物学方法检测,感染率相对较低。隐孢子虫寄生于马的小肠,常引起马驹腹泻,而成年马则不表现明显临床症状[5-6,9,13]。前期调查发现,在马的粪便中发现大量隐孢子虫卵囊,但未见马表现出腹泻症状,随着分子生物技术的应用,研究结果显示C.parvum常引起马驹严重腹泻,粪便呈褐黄色,恶臭,并发烧,而Cryptosporidiumhorse genotype感染则常呈无症状感染[4,12,16]。然而,在英国和美国的两例人体感染Cryptosporidiumhorse genotype的病例报道中,均引起了严重的腹泻[28,30]。隐孢子虫在不同宿主存在不同致病性,可能与宿主免疫力存在一定关系,研究发现细胞免疫对宿主保护力相对较强,在寄生虫入侵过程中能够抵抗甚至清除虫体,使宿主临床表现较轻或无临床表现[31]。当宿主免疫功能健全时,不感染隐孢子虫或呈一过性感染,但AIDS患者易感,其体内人干扰素诱导蛋白10(IP-10)水平明显高于健康者和未感染隐孢子虫的AIDS患者。IP-10主要由肠上皮细胞分泌,可刺激辅助性T17细胞(T helper 17 cells,Th17)分化,虽然感染隐孢子虫的AIDS患者体内IP-10分泌未受到影响,但影响Th17细胞分化,导致细胞免疫保护作用受到影响[32]。
种母马被认为是隐孢子虫携带者,马驹因共用草场而造成隐孢子虫感染,圈饲较放牧条件下更易导致该病流行,夏秋季节较冬春季节感染率高[6,33]。国内在黑龙江腹泻的成年马粪便中发现C.andersoni,该种主要寄生于反刍动物皱胃,引起生长迟缓和产奶量下降,其在马体内的寄生部位尚不清楚[8]。目前,马感染的其它隐孢子虫种类/基因型均未发现可引起腹泻等临床症状,有关驴感染的隐孢子虫种类/基因型也尚未见相关致病性的报道。
4 地理隔离特征
目前,主要采用基因亚型分型方法研究隐孢子虫的地理隔离遗传特征。基于60 kDa糖蛋白(60 kDa glycoprotein,gp60)基因,Cryptosporidiumhorse genotype分为两个亚型家族(VIa和VIb),存在宿主适应性和地理隔离现象,在捷克和美国马驹粪便中发现的亚型分别为VIaA11G3和VIaA14G2[25-26],在意大利和我国新疆的马为VIaA15G4[7,11],我国河南和山东驴的为VIaA11G3和VIaA15G4,而在犊牛的为VIaA14G4[2],在人体和宠物刺猬的为VIb13[28-30]。
C.parvum包括IIa-i、IIk-p亚型家族,其中以IIa和IId为人兽共患家族,在宿主协同进化方面扮演着重要角色[2],不同国家的马源和驴源C.parvum基因亚型存在区域性差异。意大利的马源C.parvum基因亚型为IIaA23R1、IIdA21G1、IIdA22G1和IIdA23G1[4,11],新西兰的为IIa A18G3R1[9],美国为IIaA13G2R1、IIaA15G2R1和IIaA17G2R1[15],爱尔兰的为IIjA15G4[18],阿尔及利亚的为IIaA16G1R1[23],巴西的为IIaA18G3R1和IIaA15G2R1[21];而我国四川、内蒙古的马的均为IIdA19G1[20]。阿拉尔及利亚驴源C.parvum基因亚型IIaA16G1R1[14],我国河南和山东的均为IIdA19G1[20]。以上基因亚型均属人兽共患基因亚型家族,且常见于各自国家或地区人或其它动物感染,表明马属动物源C.parvum具有区域性宿主协同进化。
C.hominis的Ik亚型家族至今仅发现于马属动物,在阿尔及利亚,马源C.hominis的基因亚型为IkA15G1[14],巴西的为IkA20G1[21],我国甘肃的为IkA16G1[20],而在四川的为IdA15[22];我国河南和山东驴源C.hominis的基因亚型IkA16G1和IkA16[20]。因相关报道研究较少,马属动物源C.hominis是否存在地理隔离特征有待于深入研究。
5 结 语
家马和家驴作为重要的交通工具和战争武器在人类历史上至少延续了三千年,其携带的隐孢子虫具有多样性分布特征。经人工长期驯化选育,家马和家驴形成了较多具有地域特色的品种,其感染的隐孢子虫是否经种系选育、交通运输、贸易交往和战争等,形成宿主协同进化和地理隔离遗传进化有待于研究。此外,现代马业如旅游和马术俱乐部的兴起,驴肉、驴奶和驴皮等驴产业的复苏,人类与马和驴接触密切,大大增加了隐孢子虫人兽共患的传播风险,应加强对马属动物隐孢子虫病的监测。
参考文献:
[1] Fayer R.Taxonomy and species delimitation inCryptosporidium[J].Exp Parasitol,2010,124(1):90-97.DOI: 10.1016/j.exppara.2009.03.005
[2] Ryan U,Fayer R,Xiao L.Cryptosporidiumspecies in humans and animals: current understanding and research needs[J].Parasitology,2014,141(13):1667-1685.DOI:10.1017/S0031182014001085
[3] Snyder SP,England JJ,McChesney AE.Cryptosporidiosisin immunodeficient Arabian foals[J].Vet Pathol,1978,15(1):12-17.
[4] Galuppi R,Piva S,Castagnetti C,et al.Cryptosporidiumparvum: From foal to veterinary students[J].Vet Parasitol,2016,219:53-56.DOI:10.1016/j.vetpar.2016.02.001
[5] Grinberg A,Oliver L,Learmonth JJ,et al.Identification ofCryptosporidiumparvum‘cattle’ genotype from a severe outbreak of neonatal foal diarrhoea[J].Vet Rec,2003,153(20):628-631.
[6] Perrucci S,Buggiani C,Sgorbini M,et al.Cryptosporidiumparvuminfection in a mare and her foal with foal heat diarrhoea[J].Vet Parasitol,2011,182(2-4): 333-336.DOI:10.1016/j.vetpar.2011.05.051
[7] Qi M,Zhou H,Wang H,et al.Molecular indentification ofCryptosporidiumspp.andGiardiaduodenalisin grazing horses from Xinjiang,China[J].Vet Parasitol,2015,209(3/4):169-172.DOI:10.1016/j.vetpar.2015.02.030
[8] Liu A,Zhang J,Zhao J,et al.The first report ofCryptosporidiumandersoniin horses with diarrhea and multilocus subtype analysis[J].Parasit Vectors,2015,8:483.DOI:10.1186/s13071-015-1102-0
[9] Grinberg A,Pomroy WE,Carslake HB,et al.A study of neonatal cryptosporidiosis of foals in New Zealand[J].N Z Vet J,2009,57(5):284-289.DOI:10.1080/00480169.2009.58622
[10] Hajdusek O,Ditrich O,Slapeta J.Molecular identification ofCryptosporidiumspp.in animal and human hosts from the Czech Republic[J].Vet Parasitol,2004,122(3):183-192.
[11] Galuppi R,Piva S,Castagnetti C,et al.Epidemiological survey onCryptosporidiumin an Equine Perinatology Unit[J].Vet Parasito,2015,15(1/2): 131-134.DOI:10.1016/j.vetpar.2015.03.021
[12] Veronesi F,Passamonti F,Cacciò S,et al.Epidemiological survey on equinecryptosporidiumandgiardiainfections in Italy and molecular characterization of isolates[J].Zoonoses Public Health,2010,57(7/8): 510-517.DOI:10.1111/j.1863-2378.2009.01261.x
[13] Guo PF,Chen TT,Tsaihong JC,et al.Prevalence and species identification ofCryptosporidiumfrom fecal samples of horses in Taiwan[J].Southeast Asian J Trop Med Public Health,2014,45(1):6-12.
[14] Laatamna AE,Wagnerová P,Sak B,et al.Microsporidia andCryptosporidiumin horses and donkeys in Algeria: Detection of a novelCryptosporidiumhominissubtype family (Ik) in a horse[J].Vet Parasitol,2015,208(3/4):135-142.DOI:10.1016/j.vetpar.2015.01.007
[15] Wagnerová P,Sak B,McEvoy J,et al.CryptosporidiumparvumandEnterocytozoonbieneusiin American Mustangs and Chincoteague ponies[J].Exp Parasitol,2016,162:24-27.DOI: 10.1016/j.exppara.2015.12.004
[16] Imhasly A,Frey CF,Mathis A,et al.Cryptosporidiose (C.parvum) in a foal with diarrhea[J].Schweiz Arch Tierheilkd,2009,151(1):21-26.DOI:10.1024/0036-7281.151.1.21 (in German)
[17] Wagnerová P,Sak B,McEvoy J,et al.Genetic diversity ofCryptosporidiumspp.including novel identification of theCryptosporidiummurisandCryptosporidiumtyzzeriin horses in the Czech Republic and Poland[J].Parasitol Res,2015,114(4):1619-1624.DOI:10.1007/s00436-015-4353-y
[18] Mirhashemi ME,Zintl A,Grant T,et al.Molecular epidemiology ofCryptosporidiumspecies in livestock in Ireland[J].Vet Parasitol,2016,216: 18-22.DOI:10.1016/j.vetpar.2015.12.002
[19] Hijjawi N,Mukbel R,Yang R,et al.Genetic characterization ofCryptosporidiumin animal and human isolates from Jordan[J].Vet Parasitol,2016,228:116-120.DOI:10.1016/j.vetpar.2016.08.015
[20] Jian F,Liu A,Wang R,et al.Common occurrence ofCryptosporidiumhominisin horses and donkeys[J].Infect Genet Evol,2016,43:261-266.DOI:10.1016/j.meegid.2016.06.004
[21] Inácio SV,Widmer G,de Brito RL,et al.First description ofCryptosporidiumhominisGP60 genotype IkA20G1 andCryptosporidiumparvumGP60 genotypes IIaA18G3R1 and IIaA15G2R1 in foals in Brazil[J].Vet Parasitol,2017,233:48-51.DOI:10.1016/j.vetpar.2016.11.021
[22] Deng L,Li W,Zhong Z,et al.Occurrence and genetic characteristics ofCryptosporidiumhominisandCryptosporidiumandersoniin horses from southwestern China[J].J Eukaryot Microbiol,2017.DOI: 10.1111/jeu.12399
[23] Laatamna AE,Wagnerová P,Sak B,et al.Equine cryptosporidial infection associated withCryptosporidiumhedgehog genotype in Algeria[J].Vet Parasitol,2013,197(1/2):350-353.DOI: 10.1016/j.vetpar.2013.04.041
[24] Li N,Xiao L,Alderisio K,et al.SubtypingCryptosporidiumubiquitum,a zoonotic pathogen emerging in humans[J].Emerg Infect Dis,2014,20(2):217-224.DOI:10.3201/eid2002.121797
[25] Ryan U,Xiao L,Read C,et al.Identification of novelCryptosporidiumgenotypes from the Czech Republic[J].Appl Environ Microbiol,2003,69(7):4302-4307.
[26] Burton AJ,Nydam DV,Dearen TK,et al.The prevalence ofCryptosporidium,and identification of theCryptosporidiumhorse genotype in foals in New York State[J].Vet Parasitol,2010,174 (1/2):139-144.DOI: 10.1016/j.vetpar.2010.08.019
[27] Kostopoulou D,Casaert S,Tzanidakis N,et al.The occurrence and genetic characterization ofCryptosporidiumandGiardiaspecies in foals in Belgium,The Netherlands,Germany and Greece[J].Vet Parasitol,2015,211(3/4):170-174.DOI:10.1016/j.vetpar.2015.04.018
[28] Robinson G,Elwin K,Chalmers RM.UnusualCryptosporidiumgenotypes in human cases of diarrhea[J].Emerg Infect Dis,2008,14(11):1800-1802.DOI:10.3201/eid1411.080239
[29] Abe N,Matsubara K.Molecular identification ofCryptosporidiumisolates from exotic pet animals in Japan[J].Vet Parasitol,2015,209(3/4):254-257.DOI:10.1016/j.vetpar.2015.02.035
[30] Xiao L,Hlavsa MC,Yoder J,et al.Subtype analysis ofCryptosporidiumspecimens from sporadic cases in Colorado,Idaho,New Mexico,and Iowa in 2007: widespread occurrence of oneCryptosporidiumhominissubtype and case history of an infection with theCryptosporidiumhorse genotype[J].J Clin Microbiol,2009,47(9):3017-3020.DOI: 10.1128/JCM.00226-09
[31] Yang YY,Yang JQ.Immunomodulatory effects of Treg and Th17 cells in parasitic infections and hygiene hypothesis[J].Chin J Schisto Control,2017,29(1):116-120.DOI:10.16250/j.32.1374.2016139 (in Chinese)
杨莹莹,杨俊齐.Treg和Th17细胞在寄生虫感染和卫生假说中的免疫调节[J].中国血吸虫病防治杂志,2017,29(1):116-120.
[32] Wang HC,Dann SM,Okhuysen PC,et al.High levels of CXCL10 are produced by intestinal epithelial cells in AIDS patients with active cryptosporidiosis but not after reconstitution of immunity[J].Infect Immun,2007,75(1):481-487.
[33] Piva S,Caffara M,Pasquali F,et al.Detection and quantification ofCryptosporidiumoocysts in environmental surfaces of an Equine Perinatology Unit[J].Prev Vet Med,2016,131:67-74.DOI: 10.1016/j.prevetmed.2016.04.012

