流产衣原体荧光定量PCR方法的建立及小鼠感染菌体载量测定
,,,
流产衣原体(Chlamydophila.abortus)是专性细胞内寄生的革兰氏阴性菌,主要造成山羊、绵羊等小型反刍动物的流产性疾病[1-2]。C.abortus还可以感染牛、猪及造成怀孕妇女的流产,是一种非常重要的人兽共患传染病[3]。
我国对于流产衣原体的预防主要采用中国农业科学院兰州兽医研究所研发的流产衣原体卵黄囊甲醛灭活油佐剂疫苗,此疫苗多年前在青海、甘肃、新疆等省份推广使用[4]。可以为动物提供很好的免疫保护效果,达到预防流产的目的。然而,在疫苗制备过程中,小鼠作为理想的模式动物已经被用于流产衣原体灭活疫苗的效价检测[5]。效检方法主要是对免疫组小鼠和对照组小鼠的脏器进行姬姆萨染色涂片,通过普通光学显微镜检查衣原体原生小体(EB)为主[5],其结果判定往往受主观因素的影响,无法从科学的角度来说明衣原体灭活疫苗的质量保证[6]。因此,本研究拟建立针对C.abortus的富含半胱氨酸的胞质蛋白(envB)基因实时定量PCR方法,以期通过检测小鼠脏器C.abortus菌体载量,为流产衣原体灭活疫苗的效检提供科学可靠的方法。
1 材料与方法
1.1菌株及DNA流产衣原体、布鲁氏菌DNA、均来自本实验室,弓形虫DNA由周东辉博士提供。
1.2主要试剂及仪器pMD19-T simple vector、2×Premix ExTaqTM 、DL 2000 DNA Marker、Trans2KPlus II DNA Marker、MiniBEST Universal Genomic DNA Extraction Kit、MiniBEST Agarose Gel DNA extraction kit、MiniBEST Plasmid purification kit、SYBR Premix EX TaqTMⅡ及感受态细胞DH5α均购自 TaKaRa 公司。
1.3引物的设计与合成envB基因引物设计参考GenBank的C.abortusenvB基因序列(登录号NC_004552.2),利用Premier 5.0 软件设计envB基因引物CloneF/CloneR和envB基因real-time PCR引物(表1)。两对引物均由上海生工有限责任公司合成。
表1引物的序列
Tab.1Nucleotide sequences of primers and probe
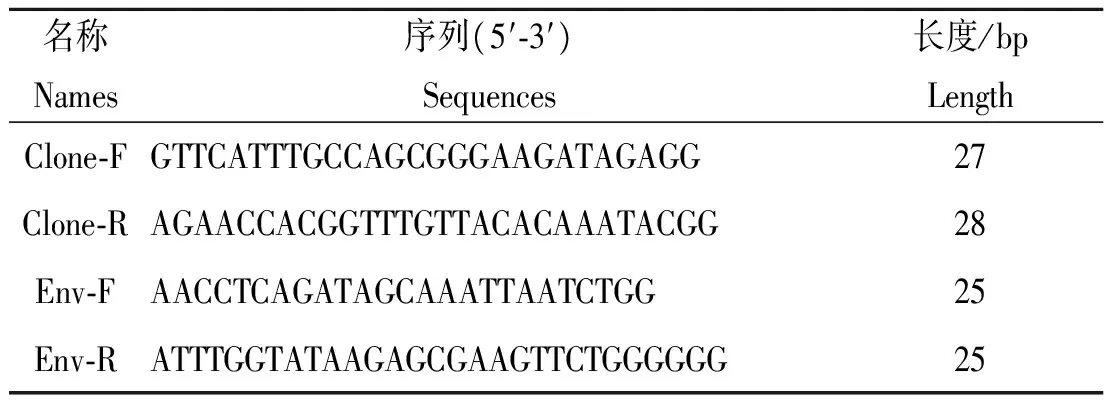
名称Names序列(5′⁃3′)Sequences长度/bpLengthClone⁃FGTTCATTTGCCAGCGGGAAGATAGAGG27Clone⁃RAGAACCACGGTTTGTTACACAAATACGG28Env⁃FAACCTCAGATAGCAAATTAATCTGG25Env⁃RATTTGGTATAAGAGCGAAGTTCTGGGGGG25
1.4重组质粒标准品的构建按照MiniBEST Universal Genomic DNA Extraction Kit说明书提取流产衣原体(SX5)标准株的核酸作为模板,进行PCR扩增目的基因。按照MiniBEST Agarose Gel DNA extraction kit说明书步骤,回收纯化PCR产物后克隆至pMD19-T载体中构建重组质粒标准品。利用分光光度计测定重组质粒的OD260nm/OD280nm浓度,根据公式:阳性质粒copies(copies/μL)=(质粒浓度×10-9×稀释倍数×6.02×1023)/(660 道尔顿/碱基×碱基数),计算标准品的copies。
1.5荧光定量PCR反应条件的优化以构建的EnvB-PMD19T阳性质粒为模板,Env-F/Env-R为引物,建立25 μL的反应体系,优化荧光定量PCR反应条件。分别对退火温度(58 ℃、 60 ℃、 62 ℃、64 ℃)进行优化,确定最佳退火温度。
1.6标准曲线的建立将构建的EnvB-PMD19T阳性质粒标准品进行10倍倍比稀释,选取1×102copies/μL~1×106copies/μL 5个梯度的阳性重组质粒作为模板,同时实验设计阴性对照,每个稀释度分别做3次重复,按照已经优化的反应条件进行荧光定量PCR反应。
1.7灵敏度实验10倍倍比稀释(1×101copies/μL ~1×105copies/μL)的重组质粒为模板,同时实验设计阴性对照,进行荧光定量PCR反应,确定该方法的最低检测限度。
1.8特异性实验采用优化过的荧光定量PCR体系和条件对流产衣原体、弓形虫、布鲁氏菌DNA进行特异性试验检测。同样设立阴性对照。来验证荧光定量PCR引物的特异性。
1.9重复性实验检测以10倍倍比稀释的重组质粒(1×103copies /μL~1×106copies /μL)为模板,进行组内重复性试验,每个浓度进行3次重复,分析各浓度组内Ct值的变异系数和标准差;实验操作重复3次,分析各浓度组间Ct值的变异系数和标准差。
1.10菌体载量检测将实验室保存的流产衣原体菌株分别以腹腔注射、消化道的方法注入Balb/c小鼠体内,每只接种200 μL稀释菌液(IFU=1.6×106)[7],对照组注射无菌的PBS 200 μL。在感染后7、14、21、28 d采集小鼠的子宫、脾脏、肝脏、十二指肠,利用优化后的荧光定量PCR体系和条件检测流产衣原体的载量。
2 结 果
2.1envB基因的PCR 扩增及重组质粒标准品的制备 以提取的流产衣原体基因组为模板进行PCR扩增,经琼脂糖凝胶电泳检测,显示目的片段约为1 358 bp(图1)。将其克隆至pMD19-T载体中,构建重组质粒标准品大小(图2)。利用分光光度计测定OD260nm/OD280nm的浓度42.5 ng/μL,经计算copies数约为1×1010copies /μL。
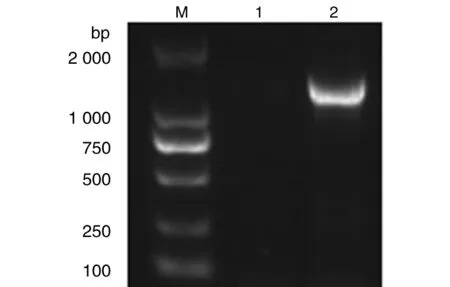
M: DL 2000 DNA Marker; 1: Negative control; 2: The product of C.abortus图1 envB基因PCR扩增片段Fig.1 PCR amplification of target fragment of the C.abortus genome
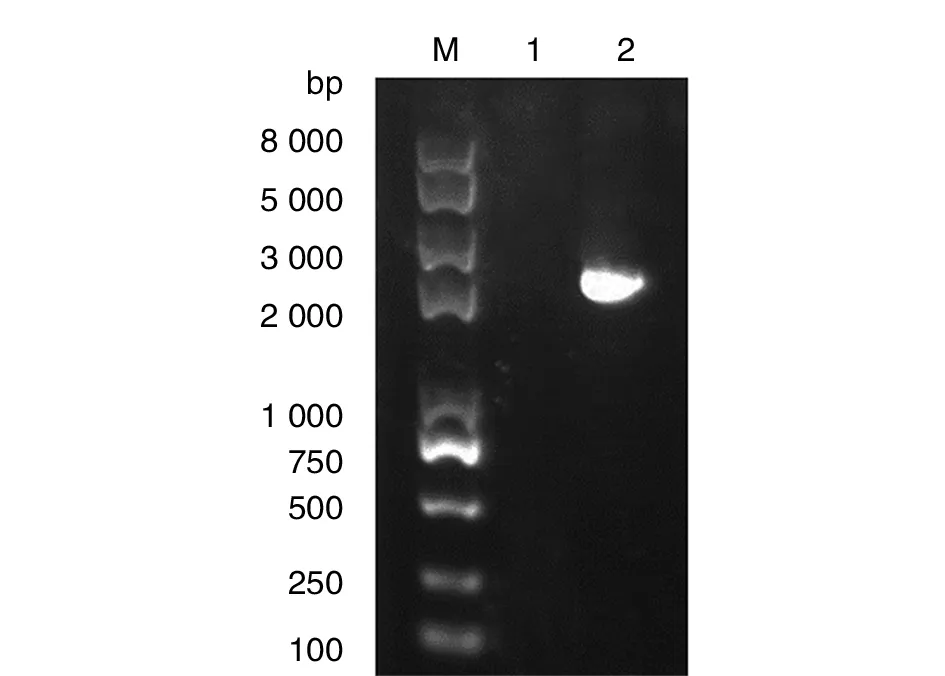
M: Plus II DNA Marker ; 1: Negative control; 2: EnvB-PMD19T图2 EnvB-PMD19T质粒PCR扩增片段Fig.2 The plasmid of EnvB-PMD19T
2.2荧光定量PCR反应条件的优化以构建的EnvB-PMD19T阳性质粒为模板,Env-F/Env-R为引物,建立了25 μL的反应体系,经过反复试验,最佳的反应体系:12.5 μL SYBR Premix EX TaqTMⅡ,引物Env-F和Env-R各1 μL (10 μmol/L)、2 μL DNA模板,8.5 μL的DEPC水。二步法最佳反应温度梯度:95 ℃/30 s;40个循环95 ℃/5 s;60 ℃/30 s。PCR 反应后的溶解曲线温度梯度:95 ℃/15 s;60 ℃/60 s;95 ℃/15 s。
2.3标准曲线的建立以倍比稀释的重组质粒标准品为模板,进行荧光定量PCR扩增。流产衣原体的标准曲线以荧光强度的对数值为横坐标,循环数为纵坐标作图。结果显示,流产衣原体扩增方程为:Y=-3.405 Log(x)+39.71,相关系数R2=0.99,扩增效率达到97%(图3)。表明该检测方法具有高扩增效率,并且重组质粒标准品的Ct值与其各自的稀释倍数之间具有良好的相关性。
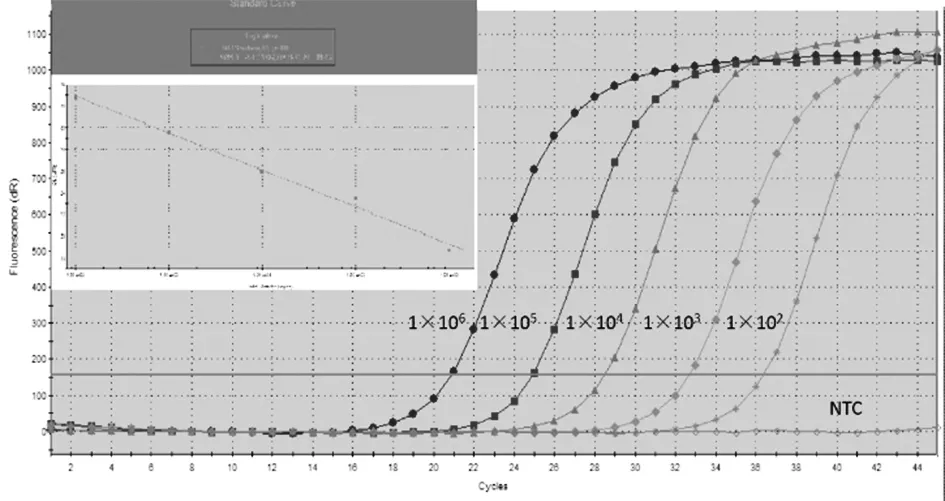
1×106 copies/μL~1×102 copies/μL图3 流产衣原体荧光定量PCR扩增曲线和标准曲线Fig.3 Amplification curves,standard curves of the real-time PCR assay
2.4灵敏度试验将6个不同稀释梯度的重组质粒(1×101copies/μL~1×105copies/μL)作为模板,进行荧光定量PCR扩增。结果显示,该方法的最低检出限为10 copies/μL(图4),表明该方法具有较高的灵敏度。
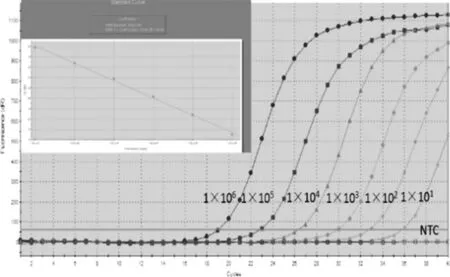
1×106 copies/μL~1×101 copies/μL图4 流产衣原体荧光定量PCR灵敏度Fig.4 Sensitivity of the real-time PCR assay

图5 流产衣原体荧光定量PCR特异性扩增曲线Fig.5 Specific amplification curve of the real-time PCR assay
2.5特异性试验采用优化过的荧光定量PCR体系和条件对流产衣原体、弓形虫、布鲁氏菌进行特异性试验检测,显示流产衣原体具有扩增曲线,呈现阳性结果;弓形虫、布鲁氏菌则无扩增曲线,呈阴性结果(图5)。重复性试验结果显示组内和组间重复试验变异系数为1.1174%~1.5510%,均小于2%,表明该方法具有良好的稳定性和重复性(表1)。
2.6重复性试验分别以不同浓度(1×103copies/μL~1×106copies /μL)的重组质粒标准品为模板。
表2荧光定量PCR组内和组间重复性实验结果
Tab.2Reproducibility test of intra- and inter-assay of the real-time PC
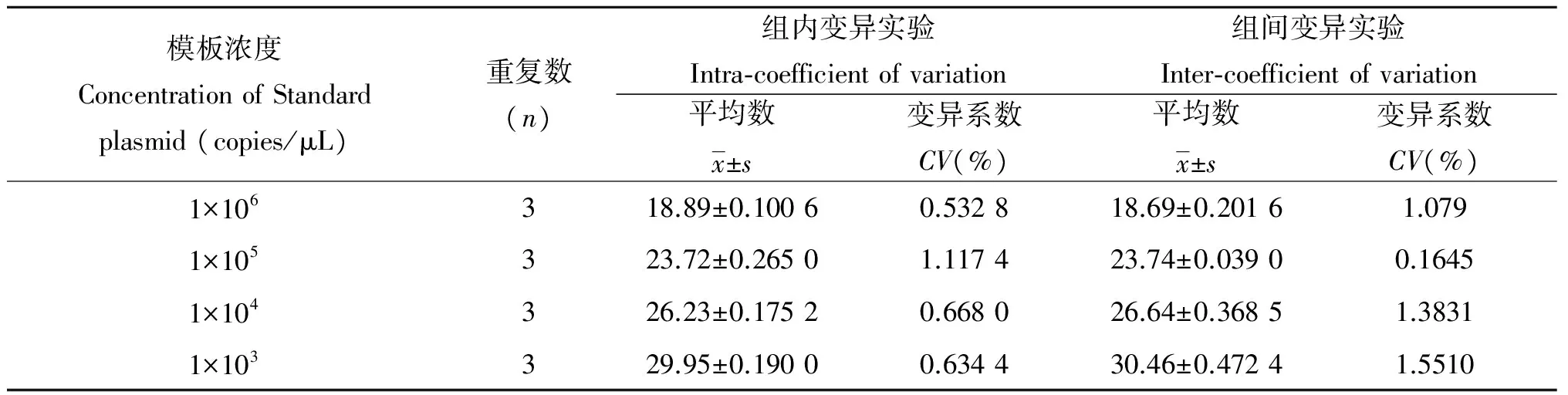
模板浓度ConcentrationofStandardplasmid(copies/μL)重复数(n)组内变异实验Intra⁃coefficientofvariation组间变异实验Inter⁃coefficientofvariation平均数x±s变异系数CV(%)平均数x±s变异系数CV(%)1×106318.89±0.10060.532818.69±0.20161.0791×105323.72±0.26501.117423.74±0.03900.16451×104326.23±0.17520.668026.64±0.36851.38311×103329.95±0.19000.634430.46±0.47241.5510
2.7菌体载量检测将实验室保存流产衣原体菌株分别以腹腔注射、消化道的方式注入Balb/c小鼠体内(IFU=1.6×106)。在感染后7、14、21、28 d采集小鼠的子宫、肝脏;7、14、28 d采集脾脏、十二指肠、利用优化后的荧光定量PCR体系和条件检测流产衣原体的载量。不同途经感染小鼠的相同器官在同一时间内的IFU以消化道感染小鼠最高(图6)。无论是腹腔感染还是消化道感染,各脏器在感染14 d时的IFU均高于其他的脏器采集点(图6)。小鼠消化道感和腹腔感染染14 d时,十二指肠、肝脏、脾脏、子宫的IFU分别是:1.77×105IFU、0.615×105IFU、0.465×105IFU、0.531×105;2.58×105IFU、3.21×105IFU、1.64×105IFU、0.67×105IFU。14 d过后IFU呈下降趋势。两种途经感染小鼠的不同器官在各时间内的IFU普遍存在一个规律:十二指肠和肝脏的IFU要高于子宫和脾脏。
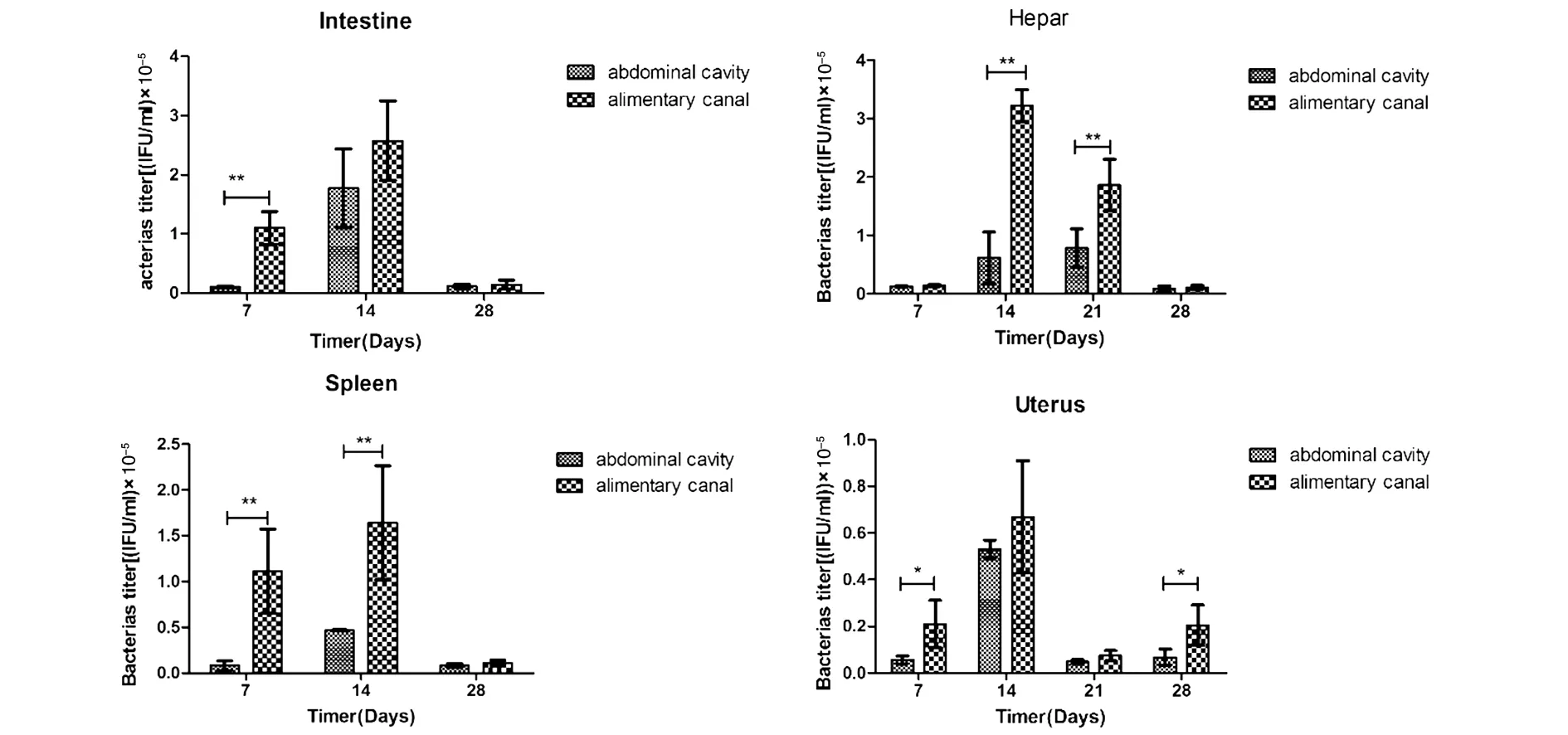
用优化后的荧光定量PCR检测流产衣原体组织菌体载量,数据显示平均菌体载量水平的比率(±SEM),**P<0.01;*P<0.005。The C.abortus strain was injected into Balb/c mice by abdominal cavity and alimentary canal.The bacterial load was detected by optimized fluorescent quantitative PCR.The bacterial load of uterus was average cell load level (±SEM),**P<0.01; *P<0.05.图6 Balb/c小鼠感染流产衣原体的组织菌体载量图Fig.6 Tissue bacterial load
3 讨 论
对于动物感染C.abortus的诊断方法有涂片染色、病原分离、血清学检测、DNA检测[8]。由于其具有传染性,病原菌的直接分离,纯化的衣原体原生小体(EB)或衣原体感染细胞的血清学检测都是具有危害性[9]。并且这些实验都需要专门的实验室以及专业知识人员。因此,C.abortus的微生物学检测只能在设备良好的实验室进行。各种DNA 扩增的方法已被开发用于检测流产衣原体[9]。但上述的这些方法只能对衣原体进行定性而不能定量。然而,实时定量PCR 不仅可作为C.abortus有效的检测方法,还可以对C.abortus进行精确的定量,甚至菌体载量的变化。
已有文献报道小鼠可用作流产衣原体疫苗效检的模型动物[5,10]。但需要借助病理组织切片或免疫荧光染色切片、姬姆萨染色切片,普通光学显微镜检查衣原体原生小体(EB)[11-12]。病理组织切片或免疫荧光染色切片、姬姆萨染色切片都需要专业的知识人员操作和判定,这在某种程度上限制了技术的广泛应用。同时,这种判定不仅会有主观因素的存在,而且对衣原体的判定只是定性的,而不是定量的。如果以此来评价流产衣原体疫苗的效检结果显然有不足之处。
对本研究建立的实时荧光定量PCR方法进行优化反应条件,建立标准曲线,结果显示标准曲线在1×102copies/μL~1×106copies/μL 内呈现良好的线性关系,扩增效率为97%,可以针对流产衣原体进行快速的大规模临床筛查。灵敏度试验表明,该检测方法的最低检出限低至10 copies/μL。组内、组间重复性试验的变异系数均小于2%,具有良好的重复性和稳定性。利用NCBI基因序列比对的生物信息学技术预测,设计的envB基因引物还可以检测C.felis、C.caviae,与其他物种没有交叉反应。小鼠试验结果显示4种脏器在各时间点消化道感染的菌体载量均高于腹腔感染的载量。近几年有研究报道衣原体可以通过生殖道感染快速且长期定殖于小鼠的胃肠等消化道粘膜[13-15],更有报道称将鼠衣原体感染小鼠的粘膜后,衣原体可以快速定殖与肠道[16]。本实验的消化道感染属于粘膜感染。消化道感染也是对自然状态下衣原体感染途径的一种模仿[17]。无论是腹腔感染还是消化道感染,脾脏、子宫、肝脏、十二指肠在感染14 d时的流产衣原体菌体载量均高于其他的脏器采集点。两种途经感染小鼠的各个器官,同一时间内的IFU基因组拷贝数存在一定差异,但C.abortus在相同组织器官中的定植和繁殖规律完全相同,表明C.abortus对各组织器官的噬性有明显的规律。这为衣原体在小鼠脏器中的组织嗜性提供了科学的依据。这些结果表明,本试验建立的荧光定量PCR能够为流产衣原体灭活疫苗的效检提供可靠检测方法。利用本研究建立的实时荧光定量PCR对导致家畜流产的布鲁氏菌、弓形虫也进行了扩增,结果表明无任何条带出现,表明建立的荧光定量PCR特异性很好。本研究建立的实时荧光定量PCR对衣原体进行特异性的扩增,且能检测感染小鼠的组织器官中衣原体的载量和变化,为对衣原体灭活疫苗小鼠模型的建立奠定了科学的基础。
参考文献:
[1] Guo W,Li J,Kaltenboeck B,et al.Chlamydiagallinacea,notC.psittaci,is the endemic chlamydial species in chicken (Gallus gallus)[J].Sci Rep,2016,6: 19638.DOI: 10.1038/srep19638
[2] Sachse K,Bavoil PM,Kaltenboeck B,et al.Emendation of the familyChlamydiaceae: proposal of a single genus,Chlamydia,to include all currently recognized species[J].Syst Appl Microbiol,2015,38(2): 99.DOI:10.1016/j.syapm.2014.12.004.
[3] Vlahovic K,Dovc A,Lasta P,et al.Zoonotic aspects of animal chlamydioses-A review[J].Vet Arhiv,2006,76:259-274.
[4] Qiu CQ.Animal chlamydia vaccine[J].Vet Sci China,1997,12:15-17.(in Chinese)
邱昌庆.动物衣原体疫苗[J].中国兽医科学,1997,12: 15-17.
[5] Qiu CQ,Zhou JZ,Cheng SM,et al.Establishment of mouse model for potency determination of the inactivated vaccine againstChlamydiosisin cow[J].Vet Sci China,2008,38(2): 120-122.(in Chinese)
邱昌庆,周继章,程淑敏,等.乳牛衣原体病灭活疫苗效检小鼠模型的建立[J].中国兽医科学,2008,38(2): 120-122.
[6] Yang XL,Huang MQ,Ge WN,et al.Study on chlamydia induced abortion in sheep——Observation ofChlamydiaby electron microscope[J].Vet Sci China,1982,(3):2-4.(in Chinese)
杨学礼,黄美群,葛文楠,等.羊衣原体性流产的研究——衣原体的电子显微镜观察[J].中国兽医科学,1982,(3):2-4.
[7] Roberto MDO,Antonio JB,Laura DR,et al.Polymorphonuclear neutrophils are necessary for the recruitment of CD8+T cells in the liver in a pregnant mouse model ofChlamydophilaabortus(Chlamydiapsittaciserotype 1) infection[J].Infect Immun,2000,68(3): 1746-51.DOI: 10.1128/IAI.68.3.1746-1751.2000
[8] Wu ZL,Peng LN,Liu ZL,et al.Detection ofChlamydiapneumoniaeby three methods of cell culture[J].Chin J Clin Lab Sci,1999,(5): 278-279.(in Chinese)
吴中明,彭理年,刘祖林,等.细胞培养3种染色法检测沙眼衣原体[J].临床检验杂志,1999,(5): 278-279.
[9] Okuda H,Ohya K,Shiota Y,et al.Detection ofChlamydophilapsittaciby using SYBR green real-time PCR [J].J Vet Med Sci,2011,73(2): 249.DOI:10.1292./jvms.10-0222.
[10] Caro MR,Buendia AJ,Del RL,et al.Chlamydophilaabortusinfection in the mouse: a useful model of the ovine disease[J].Vet Microbiol,2009,135(1/2): 103.DOI:10.1016/j.vetmic.2008.09.029.
[11] Tang GF,Chen LL,Liu LF,et al.Isolation ofChlamydophilapsittacifrom avian samples and establishment of a respiratory infection murine model[J].Acta Microbiologica Sinica.2010,50(12): 1657-1663.(in Chinese)
唐国芳,陈丽丽,刘良专,等.鹦鹉热嗜衣原体禽鸟株的分离鉴定及小鼠呼吸道感染模型的建立[J].微生物学报,2010,50(12): 1657-1663.
[12] Munday PE,Johnson AP,Thomas BJ,et al.A comparison of the sensitivity of immunofluorescence and Giemsa for stainingChlamydiatrachomatis inclusions in cycloheximide-treated McCoy cells [J].J Clin Pathol,1980,33(2): 177-179.DOI: 10.1136/jcp.33.2.177.
[13] Zhang Q,Huang Y,Gong S,et al.InVivoand ex vivo imaging reveals a long-lastingchlamydialinfection in the mouse gastrointestinal tract following genital tract inoculation[J].Infect immun,2015,83(9):3568-3577.DOI: 10.1128/IAI.00673-15
[14] Yeruva L,Melnyk S,Spencer N,et al.Differential susceptibilities to azithromycin treat-ment ofChlamydialinfection in the gastrointestinal tract and cervix[J].Antimicrob Agents 2013,57(12):6290-4.DOI: 10.1128/AAC.01405-13
[15] Yeruva L,Spencer N,Bowlin AK,et al.Chlamydialinfection of the gastrointestinal tract: areservoir for persistent infection[J].Pathog Dis,2013,68(3):88-95.DOI: 10.1111/2049-632X.12052
[16] Perry LL,Hughes S.Chlamydialcolonization of multiple mucosae following infection by any mucosal route[J].Infect Immun,1999,67(7):3686-3689.
[17] Del RL,Barberácremades M,Navarro JA,et al.IFN-γ expression in placenta is associated to resistance toChlamydiaabortusafter intragastric infection[J].Microb Pathog,2013,56:1-7.DOI: 10.1016/j.micpath.2012.12.003

