固相支撑液液萃取-气相色谱质谱法测定血液中5种镇静安眠类药物
李文海,李秀云,蔺大伟,孙红雷,邵 凯
(山东省泰安市公安局刑警支队,山东 泰安 271000)
血液中镇静安眠类药物的筛选分析一般采用液液萃取、固相萃取、快速溶剂萃取等方法. 但这些方法存在溶剂消耗多、萃取时间长、仪器购置率低等缺点,具有一定的局限性[1-4]. 固相支撑液液萃取(SLE)以比表面积高、化学惰性好的多孔硅藻土为液液分配载体,充分发挥硅藻土多孔性、大比表面、低表面活性等特点,实现微观液液萃取,适合由生物体液内萃取非极性和中等极性目标物,可极大去除内源性干扰物质,并可实现高通量样品操作,是分析实验室的一种高效样品前处理工具. SLE使用相应的萃取柱,仅需上样和洗脱两步,即可从水相中萃取目标化合物[5-7]. 本试验采用固相支撑液液萃取柱对血液样品中阿米替林、舒乐安定、咪达唑仑、异丙嗪和氯丙嗪5种镇静安眠类药物进行萃取,用公安行业基层实验室配备较多的气相色谱-质谱联用仪进行测定,具有操作简单、快速等优点,为基层实验室开展该类药物的测定提供了新的检验思路.
1 试验部分
1.1 仪器与试剂
Thermo Fisher TSQ8 EVO气相色谱-质谱联用仪(美国Thermo Fisher Scientific);Biotage固相支撑液液萃取柱(瑞典Biotage);电子天平(瑞士梅特勒).
试剂:甲醇、氨水、环己烷、乙酸乙酯、二氯甲烷均为分析纯;阿米替林、舒乐安定、咪达唑仑、异丙嗪、氯丙嗪均购自公安部物证鉴定中心.
1.2 标准样品制备
用电子天平准确称取上述5种药物各10 mg, 用色谱纯甲醇定容至10 mL,配制成1.0 mg/mL混合标准储备液,冰箱保存,使用时根据需要配置不同浓度的混合标准工作溶液. 空白血样来源于不含上述混合样的健康人血.
1.3 血液样品处理
取血样2.0 mL于离心管中,分别加入100 μL质量浓度为0.1 mg/mL的标准溶液后混匀. 取400 μL混匀后的血样于离心管中,再加入400 μL氨水缓冲溶液,将混匀后的溶液加入固相支撑液液萃取柱进行上样,样品在填料的表面扩散并被吸收,直至整个样品被填料吸收,并且没有液体流出. 5 min后,根据试验条件选取洗脱剂,以1 mL/min的流速洗脱药物,收集洗脱液于试管中,氮吹仪浓缩至干,加200 μL甲醇溶解,待测.
1.4 仪器分析条件
气相色谱:VF-5 MS 色谱柱( 30 m×0.25 mm×0.25 μm);载气为高纯氦气(纯度 99.999%),流量为1.0 mL/min,汽化室温度为260 ℃;分流比为10∶1;进样量为1.0 μL. 程序升温:初始柱温 80 ℃,保持1 min,以10 ℃/min升至180 ℃,再以40 ℃/min速率升至280 ℃,保持12 min.
质谱:传输线温度为280 ℃;离子源温度为200 ℃;电子轰击离子源;电离能量为70 eV;溶剂延迟时间为3 min.
2 结果与讨论
2.1 萃取条件优化
2.1.1 缓冲溶液pH的选择
加入氨水缓冲溶液的目的是降低样品粘度,获得平顺的流速. 对于在水溶液中可离解的分析物,可应用pH 控制缓冲液抑制其离解,增强提取效率. 分别取pH为8、10、12的氨水缓冲溶液加入3份已加入药物的混合血样中,按照1.3方法在同一条件下进行萃取,比较不同pH缓冲溶液下萃取回收率,试验结果如表1所列. 由表1可见,pH为10时的萃取效果最佳.
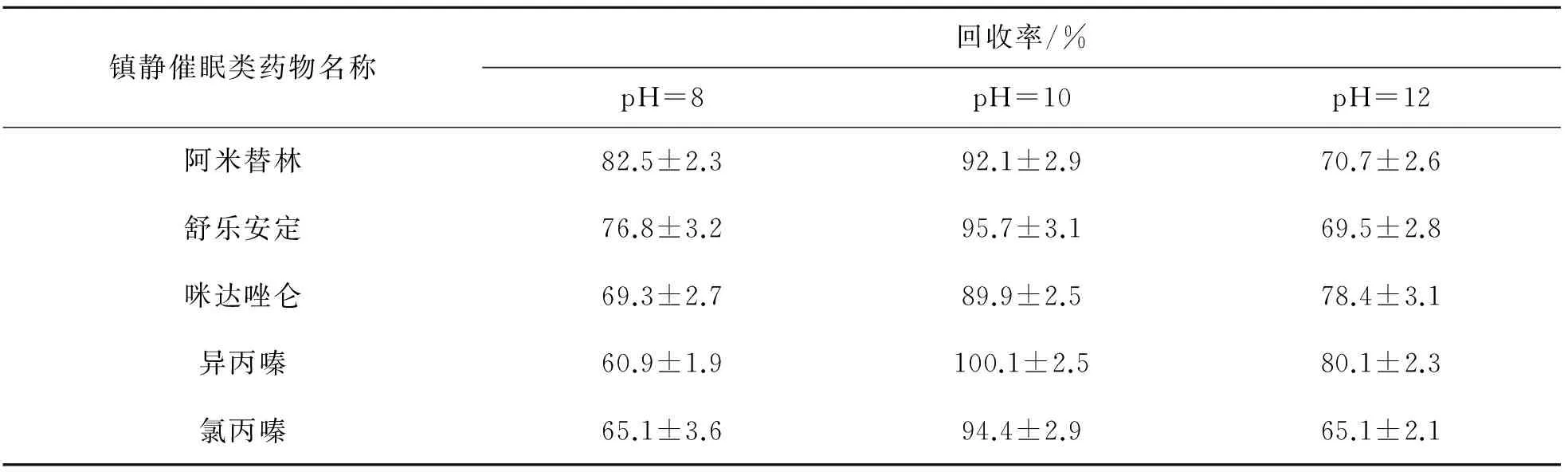
表1 不同pH氨水缓冲溶液对血液中镇静催眠药物提取回收率的比较Table 1 Recovery rates of sedative hypnotic drugs by different pH ammonia buffer solutions
2.1.2 萃取溶剂的选择
取3份加入药物的血样,按照1.3方法进行处理,选择乙酸乙酯、环己烷和二氯甲烷3种有机溶剂进行洗脱,测定回收率,试验结果如表2所列. 由表2可见,洗脱剂为乙酸乙酯时血样中安眠镇静类药物的回收率最高,其次是环己烷、二氯甲烷. 故选用乙酸乙酯作为洗脱溶剂.

表2 不同洗脱剂对血液中镇静催眠药物提取回收率的比较Table 2 Recovery rates of sedative hypnotic drugs by different eluents
2.1.3 洗脱剂用量的选择
洗脱剂的用量对萃取效果的影响较大,分别使用2.0、5.0、7.0 mL乙酸乙酯作为洗脱溶剂,取3份已加入药物的混合血样按照1.3方法操作步骤进行试验,结果如表3所列. 由表3可见,2.0 mL乙酸乙酯能够把样品组分洗脱出来,5.0 mL时效果最好,故选用5.0 mL乙酸乙酯作为洗脱溶剂.

表3 不同洗脱剂用量对血液中镇静催眠药物提取回收率的比较Table 3 Recovery rates of sedative hypnotic sedative drugs by different dosages of eluent
2.2 回收率试验
采用空白血样加标的方式进行回收率试验,分别添加3个水平,每个水平单独测定5次,其总离子流图如图1所示,回收率和精密度结果如表4所列. 由表4可见,5种安眠镇静类药物在血液中的添加回收率在70.1%~90.8%之间,变异系数均小于5.3%,可知该方法的准确度较高,精密度较好,能够满足实际办案工作中安眠药检验的需要.
2.2 工作曲线和检出限
取1.0 mg/mL 混合标准储备溶液配制 0.5、2. 0、5.0、10.0、20.0 μg /mL 的混合标准工作溶液,按本文方法进行 GC/MS 检测,以峰面积为纵坐标,进样浓度为横坐标绘制标准曲线,并按信噪比(S/N = 3)计算检出限,得到5种药物的标准曲线、相关系数(r)和检出限,如表5所列. 结果表明,5 种镇静安眠类药物浓度在0.5~20 μg /mL范围内线性关系良好.
3 实际样品检测
2017年8月,我市某刑侦大队送检了张某涉嫌故意伤害案的受害人李某某的血液检材. 取1 mL检材,通过上述方法用固相支撑液液萃取前处理后,进GC/MS分析,检出咪达唑仑,其质量浓度为12.8 μg/mL,为该案件定性提供依据.
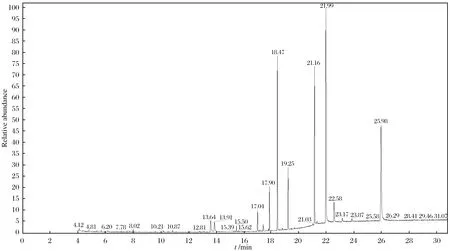
图1 优化条件下血液中镇静安眠类药物的总离子流图(TIC)Fig.1 TIC of sedative hypnotic drugs in blood under optimized conditions注:从左至右依次为阿米替林(18.47 min)、异丙嗪(19.25 min)、氯丙嗪(21.16 min)、咪哒唑仑(21.99 min)、舒乐安定(25.98 min)
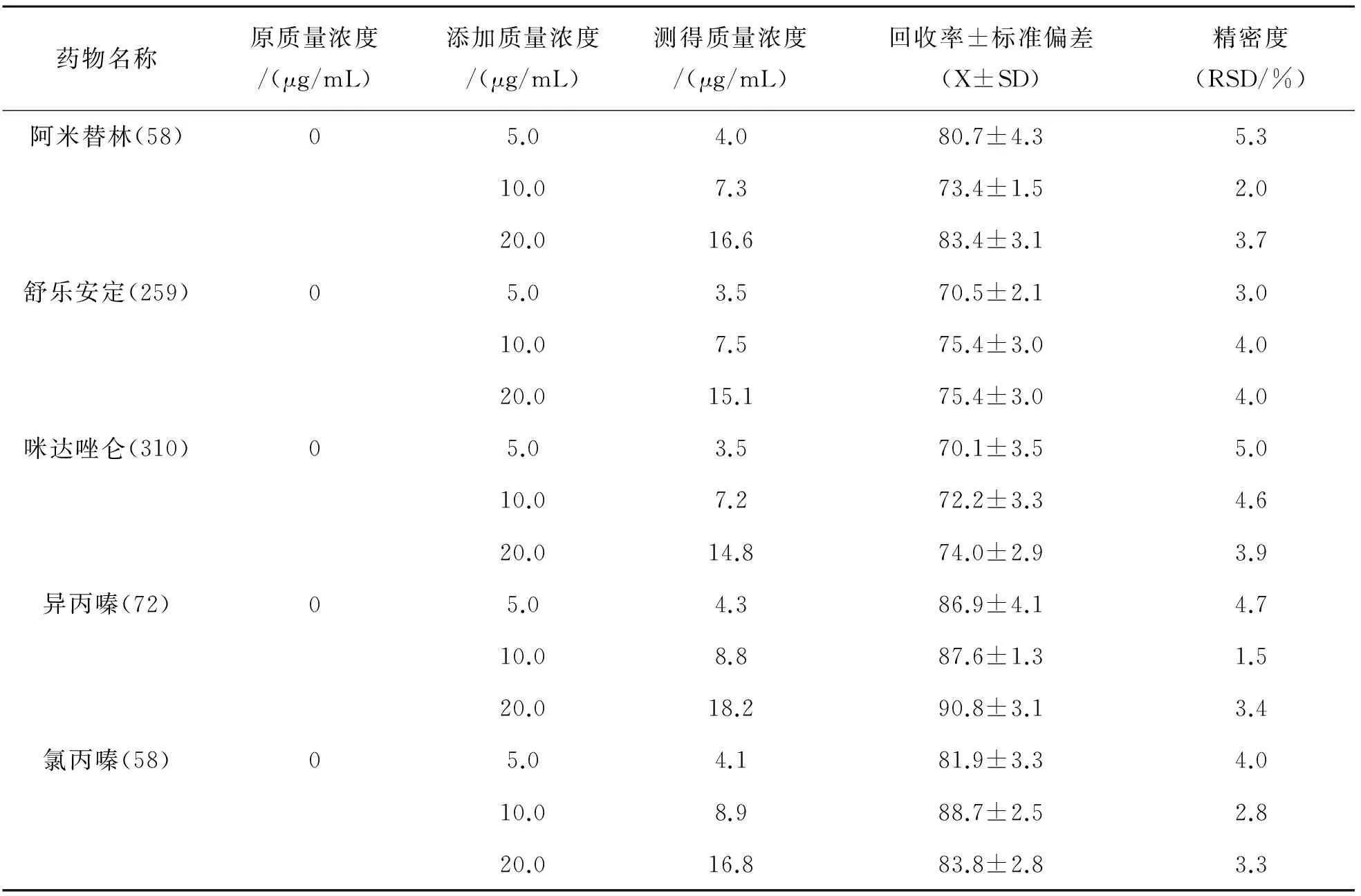
药物名称原质量浓度/(μg/mL)添加质量浓度/(μg/mL)测得质量浓度/(μg/mL)回收率±标准偏差(X±SD)精密度(RSD/%)阿米替林(58)05.04.080.7±4.35.310.07.373.4±1.52.020.016.683.4±3.13.7舒乐安定(259)05.03.570.5±2.13.010.07.575.4±3.04.020.015.175.4±3.04.0咪达唑仑(310)05.03.570.1±3.55.010.07.272.2±3.34.620.014.874.0±2.93.9异丙嗪(72)05.04.386.9±4.14.710.08.887.6±1.31.520.018.290.8±3.13.4氯丙嗪(58)05.04.181.9±3.34.010.08.988.7±2.52.820.016.883.8±2.83.3
注:药物名称后括号内数字为该药物定量离子.

表5 5种安眠镇静类药物的线性方程和相关系数Table 5 Linear equations and correlation coefficients of five sedatives
4 结论
应用样品的前处理新技术固相支撑液液萃取,结合气相色谱-质谱联用仪,建立了5种镇静安眠类药物同时提取测定的分析方法. 通过对实际样品的检测,表明该方法具有检材用量少、前处理简单、回收率好、灵敏度高等优点,可用于实际案例血液中镇静安眠类药物的提取检验鉴定.
参考文献:
[1] 王姗姗,李刚,高丽娜,等.液液萃取分离-气相色谱-串联质谱法同时测定水中12种有机氯农药[J].理化检验-化学分册,2016,52(4):384-385.[WANG Shan-shan, LI Gang, GAO Li-na, et al. Simultaneous determination of 12 organ chlorine pesticides in water by liquid-liquid extraction and GCMS[J].Physical Testing and Chemical Analysis: Chemical Analysis, 2016,52(4):384-385. ]
[2] 邢若葵,温锦峰. 自动固相萃取法提取常见安眠镇静药[J]. 刑事技术,2003,3:12-15.[XING Ruo-kui, WEN Jin-feng. Automatic solid phase extraction used to extract common sedatives[J]. Criminal Technology, 2003, 3:12-15.]
[3] 李宏亮,詹铭,蒋志华,等.固相萃取-气相色谱法测定饮用水中12种农药[J].理化检验-化学分册,2014,50(12):1513-1516.[LI Hong-liang, ZHAN Ming, JIANG Zhi-hua, et al. Determination of 12 pesticides in water by solid phase extraction gas chromatography[J]. Physical Testing and Chemical Analysis: Chemical Analysis, 2014,50(12):1513-1516.]
[4] 林埔,梁一池,胡娟.固相萃取/高效液相色谱荧光法测定草珊瑚中苯并[α]芘残留[J].分析测试学报,2015,34(6):711-714.[LIN Pu, LIANG Yi-chi, Hu Juan. The determination of benzo[α]pyrene in grass coral by SPE-HPLC[J]. Journal of Instrumental Analysis, 2015, 34(6):711-714.]
[5] 李晓飞,唐磊,徐琛. 固相支撑液液萃取-气相色谱串联质谱法测定血液中的沙蚕毒素[J].河南教育学院学报( 自然科学版)2014,23(3):24-26. [LI Xiao-fei, TANG Lei, XU Chen. The determination of toxin in blood using isolate SLE-supported liquid extraction and GC-MS/MS[J]. Criminal Technology, 2014,23(3):24-26.]
[6] 祝伟霞,袁萍,杨冀州,等.固相支撑液液萃取-平行蒸发前处理技术测定动物源性食品中4种硝基呋喃类代谢物[J]. 食品科技,2011,36(2):300-303.[ZHU Wei-xia, YUAN Ping, YANG Ji-zhou, et al. Determination of four nitro furans metabolites in animal source food by SLE-parallel evaporation[J]. Food Science and Technology, 2011,36(2):300-303.]
[7] 李晓飞,唐磊,罗永此,等 .固相支撑液液萃取-气相色谱串联质谱法测定血液中8种苯二氮卓类药物[J]. 刑事技术,2014,2:27-29. [LI Xiao-fei, TANG Lei, LUO Yong-ci, et al. Determination of benzodiazepines drugs in blood using isolate SLE-supported liquid extraction and GC-MS/MS[J]. Criminal Technology, 2014,2:27-29.]

