加速溶剂萃取-固相萃取净化-气质联用法测定稻谷中18种农药残留
张晓婷,潘建君,钟 芸,庄逸飞,冯青青,叶树娟
(1.湖州出入境检验检疫局,浙江 湖州 313000;2. 湖州师范学院,浙江 湖州 313000)
我国是世界上栽培水稻历史最悠久、水稻遗传资源最丰富的国家之一,同时也是水稻产量最大的国家,全国约有60%的人口以大米为主食. 因此,稻谷的质量关乎全国一半以上人口的生命安全. 然而,在水稻的种植过程中,盲目追求产量而过量、频繁、不合理地使用农药的问题,成为了影响稻谷质量安全的一个重要影响因素,严重影响人民群众生命健康. 因此,建立高效、可靠的稻谷中农药残留检测技术,对提高稻谷安全质量、保证人类健康、保护环境资源都有重要的意义[1-3].
目前,农药残留检测技术主要集中有:毛细管电泳法、液相色谱法、液相色谱串联质谱法、气相色谱法和气相色谱串联质谱法等. 其中气相色谱串联质谱法是应用最广泛的一种分析方法,几乎70%以上的农药残留都可以采用该方法进行测试[4-5].
稻谷中农药的提取方法主要有:超声波辅助提取[6]、索氏提取[7]以及加速溶剂萃取[7-8]等. 其中索氏提取回收率较高,但工作量大、耗时长、且有机溶剂的消耗量大;超声波辅助提取方法简单、快速,但是相对萃取效率不高,回收率偏低[9-10];加速溶剂萃取是一项新的提取技术,兼具速度快、效率高、有机溶剂使用量少、自动化程度高等特点,已被广泛应用于农药残留检测等领域[10-13].
本文以乙腈为提取溶剂,使用加速溶剂萃取仪对稻谷样品中残留的农药进行提取,再通过自制复合填充物(无水硫酸钠+弗罗里硅土活性炭)[9,14]净化,最后利用气相色谱-质谱联用仪测试分析. 试验结果表明,该方法萃取速度快、灵敏度好、回收率高,可用于稻谷中18种农药残留的测试.
1 试验部分
1.1 仪器与试剂
气相色谱-质谱联用仪(7890A-5975C),美国安捷伦公司;加速溶剂萃取仪(ASE350),戴安(中国)有限公司;旋转蒸发仪(R210),瑞士BUCHI公司;旋涡混合器(XW-80A),上海医大仪器厂.
自制复合柱(FHZ):200 mm×15 mm(内径)玻璃柱,底部垫约5 mm 脱脂棉和约20 mm 无水硫酸钠,中间层为5 g弗罗里硅土和0.2 g活性炭混合物,顶端加约20 mm 无水硫酸钠,使用前用20 mL 正己烷淋洗.
固相萃取小柱:cleanert S C18,博纳艾杰尔(Agela)公司.
18种农药标准物质包括:禾草敌、甲拌磷、异稻瘟净、甲基毒死蜱、甲基嘧啶磷、毒死蜱、嘧啶磷、稻瘟灵、三唑磷、生物苄呋菊酯、联苯菊酯、氯氟氰菊酯、氯菊酯、氟氯氰菊酯、氟氰戊菊酯、氰戊菊酯、苯醚甲环唑、溴氰菊酯(100 μg/mL,农业部环境保护科研监测所);乙腈、正己烷、丙酮(均为色谱纯,德国CNW公司); 纯水:艾利浦AWL-1001-P型超纯水机制备,电导率小于0.10 μS/cm;无水硫酸钠:分析纯,浙江中星化工试剂有限公司;弗罗里硅土:色谱纯,150~250 μm ,ASTM,德国CNW公司;活性炭:G-60,德国CNW公司.
实际样品及阴性稻谷样品:采购于湖州市粮油市场,实际样品编号为2017LY001-2017LY002;阴性样品编号为2017LY003.
1.2 样品前处理
1.2.1 试样制备
将稻谷试样经粉碎机粉碎后,样品全部过380 μm的标准网筛,混匀,制备好的试样均匀分成两份,装入洁净的盛样容器内,密封并做好标记.
1.2.2 提取
称取10 g左右试样(精确至0.01 g)与10 g硅藻土混合均匀,一并移入加速溶剂萃取仪的萃取池(池体积为34 mL)中,在压力为10.34 MPa、温度为80 ℃条件下,加热5 min,再用乙腈静态萃取3 min,循环2次,然后用池体积60%的乙腈(20.4 mL)冲洗萃取池,并用氮气吹扫100 s. 萃取完毕后,将萃取液混匀,取萃取液体积的十分之一(相当于1 g试样量),待净化.
1.2.2 净化
用10 mL乙腈预洗cleanert S C18柱,然后将其放入固定架上,下端接鸡心瓶,移入上述萃取液,并用15 mL乙腈洗涤cleanert S C18柱,收集萃取液及洗涤液,在旋转蒸发仪上将收集的液体浓缩至近干,备用.
将上述样品浓缩液用9 mL正己烷-丙酮(体积比为3∶1)分三次溶解洗涤后转移至自制复合柱(FHZ)中,收集流出液,再用75 mL正己烷-丙酮(体积比为3∶1)混合溶剂洗脱. 流速约为3 mL/min,收集全部洗脱液,在40 ℃以下水浴减压浓缩至约1 mL,用5 mL正己烷交换两次,转移入离心管中,用吹氮浓缩仪吹干,加入1.0 mL 正己烷溶解,供气相色谱-质谱仪测定.
1.3 检测
1.3.1 气相色谱条件
色谱柱为HP-5ms(30 m×0.25 mm×0.25 μm);不分流进样;进样量为1 μL;纯度不低于99.999%的氦气作为载气,流速为1.0 mL/min;进样口温度:270 ℃;GC-MS接口温度:280 ℃;色谱柱升温程序:70 ℃保持1 min,然后以20 ℃/min程序升温至240 ℃,再以2 ℃/min升温至270 ℃保持2 min,再以10 ℃/ min 升温至300 ℃,保持5 min.
1.3.2 质谱条件
电离方式为EI模式,电离能量为70 eV;离子源温度为230 ℃;四级杆温度为150 ℃;选择离子监测模式(SIM).
上述气相色谱/质谱条件下,18种农药的保留时间以及选择离子参数如表1所列,标准溶液的色谱图如图1所示.
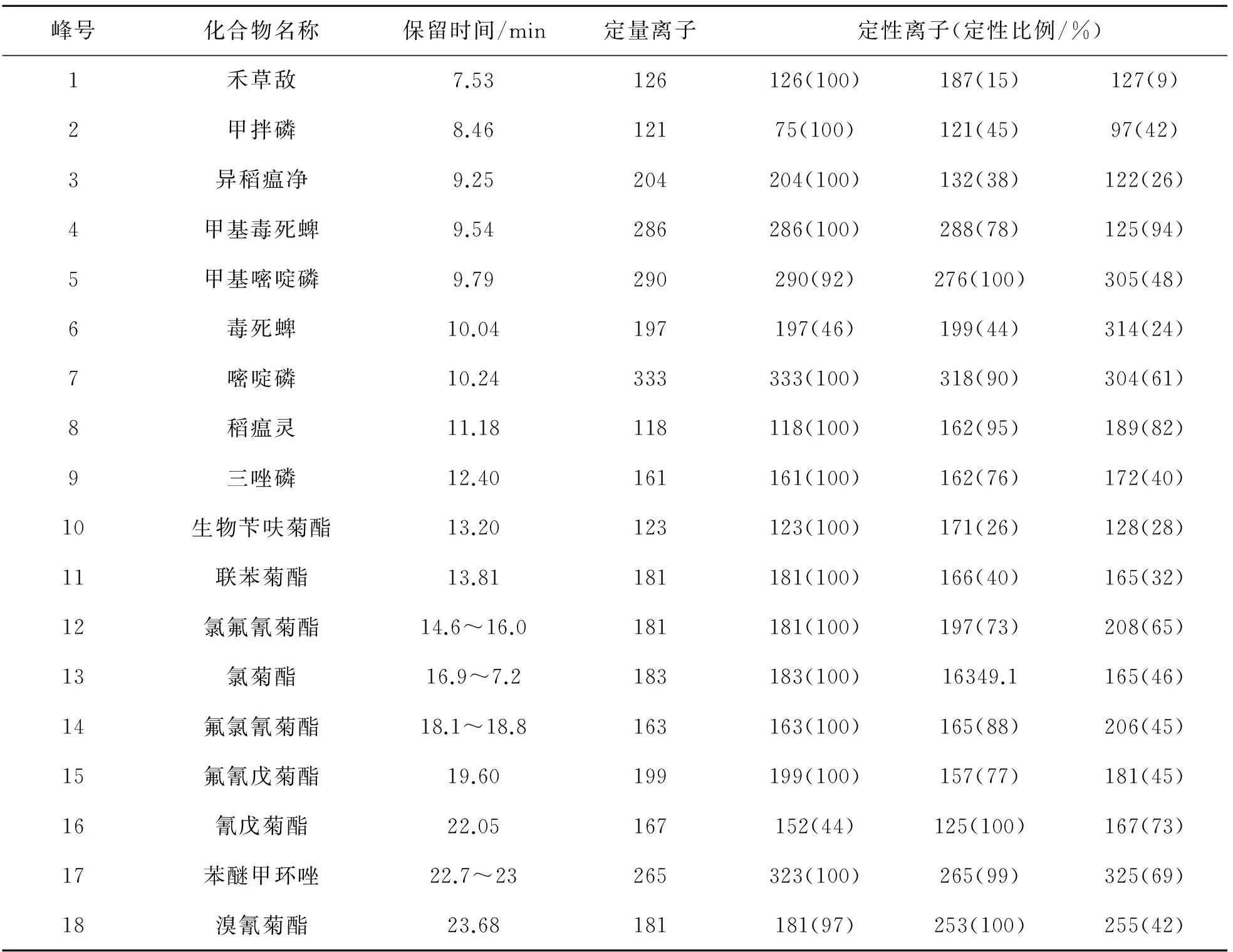
表1 GC-MS分析的18种农药名称、保留时间及定性、定量离子参数Table 1 Pesticide, retention time, qualitative and quantitative selected ions parameters for GC-MS analysis
2 结果与讨论
2.1 提取条件的优化
2.1.1 提取方法的选择
残留农药的提取方法主要有索氏提取、超声提取以及加速溶剂萃取等. 其中,索式提取法耗时长,对农药的热稳定性有要求,对环境有较高控制要求. 超声提取法虽操作简单,但一般适用于含水量较高的新鲜样品. 如应用于干燥的粮谷类样品时,还需要加入水同时提取,然后经液液萃取提取化合物. 由于粮谷类样品中碳水化合物含量较高,一般离心操作达不到分离沉淀杂质的要求,因此增加了提取净化难度. 加速溶剂萃取是一种自动萃取技术,具有时间短、溶剂用量少和提取效率高等特点,也是美国环保署选定的标准方法(EPA3545),所以本文选择该方法进行稻谷样品中农药的提取.

图1 18种农药标准溶液色谱图(0.5 μg/mL)Fig.1 Total ion chromatogram of 18 pesticides in standard solution(0.5 μg/mL)(1)禾草敌,(2)甲拌磷,(3)异稻瘟净,(4)甲基毒死蜱,(5)甲基嘧啶磷,(6)毒死蜱,(7)嘧啶磷,(8)稻瘟灵,(9)三唑磷,(10)生物苄呋菊酯,(11)联苯菊酯,(12)氯氟氰菊酯,(13)氯菊酯,(14)氟氯氰菊酯,(15)氟氰戊菊酯,(16)氰戊菊酯,(17)苯醚甲环唑,(18)溴氰菊酯
2.1.2 提取溶剂的选择
残留农药的提取效率与农药自身性质以及提取溶剂的性质都有直接关系. 本文分析的稻谷样品属于低脂肪干性样品,比较适合采用丙酮或者乙腈作为提取溶剂. 经试验比较发现,采用丙酮作为提取溶剂时,去除样品中的色素效果不明显,而且测试色谱图中含有多种长直链烃及类脂物杂峰,影响对18种农药目标物的分析. 而采用乙腈为提取溶剂时,则没有上述问题,能够满足分析要求,所以本文选取乙腈为提取溶剂.
2.2 净化方法的优化
一般稻谷的成分组成:水分14%、蛋白质8%~12%、脂肪2%、碳水化合物75%左右以及部分色素等. 根据这一试样特性,本文选择了两种净化方式进行比较分析.
2.2.1 A法
萃取液先过cleanert S C18柱,并用乙腈洗涤,收集萃取液及洗涤液,浓缩至近干,再用正己烷-丙酮(体积比为3∶1)溶解洗涤后过自制复合柱(FHZ)中,并用正己烷-丙酮(体积比为3∶1)混合溶剂洗脱. 收集全部洗脱液,经浓缩定容后上机.
2.2.2 B法
萃取液先过cleanert S C18柱,并用乙腈洗涤,收集萃取液及洗涤液,浓缩至近干,再用乙腈-甲苯(体积比为3∶1)溶解洗涤后,连续过Envi-Carb柱和 Sep-PakNH2柱,并用乙腈-甲苯(体积比为3∶1)混合溶剂洗脱. 收集全部洗脱液,经浓缩定容后上机.
试验结果表明,B法连续过Envi-Carb柱和 Sep-PakNH2柱,增加了操作步骤和目标物损耗,使得大部分目标物的回收率低于A法,特别是三唑磷和生物苄呋菊酯,回收率明显下降,不能满足检测需求. 而且从色谱图来看,B法净化后的残留杂峰仍然多于A法,在9.8、12 min左右,有油酸、亚油酸和棕榈酸等长链杂质,去除杂质效果不如A法. 因此,本文确定选择A法为净化方法.
2.3 标准曲线及线性关系
按确定的色谱条件,分别对0.05、0.1、0.25、0.5、1.0 μg/mL的18种农药混合标准溶液进行测定,以各农药化合物定量离子的峰面积为纵坐标,以浓度为横坐标,做标准曲线. 结果表明,各农药化合物在0.05~1.0 μg/mL质量浓度范围内均具有较好的线性关系,其18种农药化合物的线性回归方程及相关系数如表2所列.

表2 18种农药化合物的线性回归方程及相关系数Table 2 Linear regression equation and correlation coefficient(R2)of 18 pesticides
2.4 方法的检出限及定量限
依据美国EPA524.2方法[9],在较低质量浓度(0.1 mg/L)下重复测定8次得出标准偏差(STD Dev),以3倍的标准偏差确定为方法的检出限(MDL)=3(STD Dev),以8倍的标准偏差确定为方法的定量限(MDQ)=8(STD Dev). 结果表明,18种农药的检出限在0.104~0.647 mg/kg之间,定量限在0.276~1.724 mg/kg之间. 具体结果如表3所列.
2.5 方法的回收率和精密度
在阴性样品中加入已知浓度的18种农药混标溶液,做6次平行测试,得到各农药的平均回收率及精密度(相对标准偏差)情况,结果如表4所列.
2.6 实际样品检测
应用该方法对湖州市粮油市场采购的10个水稻样品进行上述18种农药的检测,其中检出一份联苯菊酯含量为0.53 mg/kg,其他农药未检出. 与均质提取或超声萃取农残相比节约检测前处理时间和试剂消耗,加速溶剂萃取所得提取液杂质教少,农药提取率较高,检测结果略高于上诉两种传统方法.
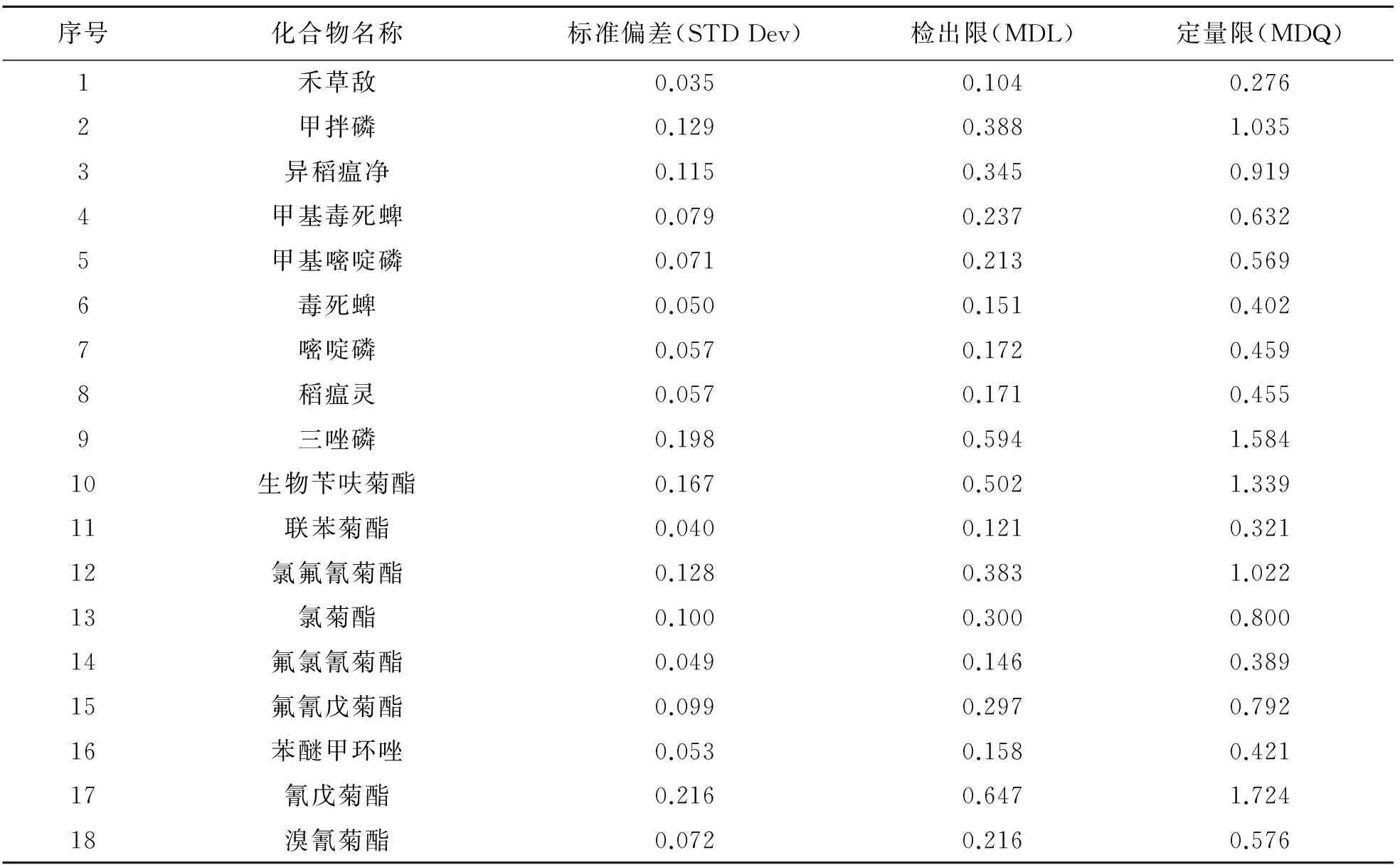
表3 18种农药化合物的检出限及定量限Table 3 Detection limit and quantitative limit of 18 pesticides /(mg/kg)

表4 18种农药的回收率及精密度试验结果(n=6)Table 4 Recovery and precision test results of 18 pesticides in paddy(n=6)
3 结论
本文建立的加速溶剂萃取-固相萃取净化-气质联用法(ASE/SPE/GC-MS)测定稻谷中18种农药残留方法,线性相关系数好,检出限和定量限低,回收率以及相对标准偏差等指标均能满足测试要求,操作简便,结果准确,适用于稻谷中禾草敌等18种农药残留的检测.
参考文献:
[1] 陈京都,吴红军,王龙跟,等. QuEChERs-LC-MS/MS快速分析稻谷中12种农药残留方法初探[J].中国稻米. 2016,22(2):54-56.[CHEN Jing-du, WU Hong-jun, WANG Long-gen, et al. Preliminary study on QuEChERS-LC-MS/ MS method for rapid detection of 12 Kinds of pesticide residues in rice[J]. China Rice, 2016, 22(2):54-56.]
[2] 赵祥梅,董英,王和胜,等. QuEChERs-气-质联用法检测大米中12种农药残留物[J].中国食品学报,2016,10(2):214-219.[ZHAO Xiang-mei, DONG Ying, WANG He-sheng, et al. Determination of multi- residues for 12 pesticides in rice by QuEChERS and GC-MS-SIM[J]. Journal of Chinese Institute of Food Science and Technology, 2016,10(2):214-219.]
[3] 程旺大,张国平,姚海跟,等. 我国优质安全稻米生产的现状及发展对策[J] .上海交通大学学报:自然科学版,2003,21(2):144-150.[CHENG Wang-da, ZHANG Guo-ping, YAO Hai-gen, et al. Situation and strategies for production of high quality and safe rice in China[J].Journal of Shanghai Jiaotong University (Agricultural Science),2003,21(2):144-150.]
[4] Muralidharn S, Dhananjayan V, Jayanthi P. Organochlorine pesticides in commercial marine fishes of Coimbatore, India and their suitability for human consumption[J]. Enveion Res, 2009,109:15.
[5] 孟晓萌,郑晓冬,潘少香.果蔬农残检测方法的研究[J].中国果菜,2013,12:29-33.[MENG Xiao-meng, ZHENG Xiao-dong, PAN Shao-xiang. Study on the detection methods of pesticide residues in fruits and vegetables[J]. China Fruit and Vegetable,2013,12:29-33.]
[6] 时磊,陈海英,蔡小虎,等.超声提取-气相色谱法同时测定稻谷中18种有机氯农药和7种多氯联苯[J].理化检验-化学分册,2016,52:1090-1094.[SHI Lei, CHEN Hai-ying , CAI Xiao-hu, et al. GC determination of 18 organochlorine pesticides and 7 polychloro biphenyls in rough rice with ultrasonic extraction of samples[J]. Physical Testing and Chemical Analysis Part B:Chemical Analgsis, 2016,52:1090-1094.]
[7] 陈敏,宋君.食品中有机磷农药残留检测的前处理方法[J]. 山西农业科学, 2016,44(9): 1412-1415.[CHEN Min, SONG Jun. Pretreatment methods for the determination of organophos-phorus pesticides residues in food[J]. Journal of Shanxi Agricultural Sciences, 2016,44(9): 1412-1415.]
[8] 宋文斌, 姜俊,佟克兴,等.测定人参中有机氯农药残留量的样品萃取方法研究[J]. 现代科学仪器, 2007,6:100-104. [SONG Wen-bin, JIANG Jun, TONG Ke-xing, et al. The study on sample extraction method for organochlorine pesticide multi- residues in ginseng[J]. Modern Scientific Instruments, 2007,6:100-104.]
[9] 李胜杰,张慧.结球甘蓝中菊酯类农残检测前处理条件优化[J]. 浙江树人大学学报:自然科学版, 2015,3: 29-33.[LI Sheng-jie, ZHANG Hui. Optimization of preprocessing conditions for detection of pyrethroid pesticide residues in cabbage[J]. Journal of Zhejiang Shuren University(Acta Scientiarum Naturalium), 2015,3: 29-33.]
[10] 杨佳佳,佟玲,吴淑奇,等.加速溶剂萃取-气相色谱法测定谷物中有机氯农药和多氯联苯[J]. 岩矿测试,2013,32(3):487-494.[YANG Jia-jia,TONG Ling, WU Shu-qi,et al. Determination of organochlorine pesticides and polychlorinated biphenyls in grains using gas chromatography with accelerated solvent extraction[J]. Rock and Mineral Analysis, 2013,32(3):487-494.]
[11] 杜晓婷,周敏,张剑,等.蔬菜中甲胺磷等5种有机氯农药残留量的分散液-液微萃取/气质联用技术检测[J] .分析测试学报,2010,29(7):751-754.[DU Xiao-ting, ZHOU Min, ZHANG Jian,et al. Determination of five organophosphorus pesticide residues in vegetables based on dispersive liquid-liquid microextraction coupled with gas chromatography mass spectrometry[J]. Journal of Instrumental Analysis,2010,29(7): 751- 754.]
[12] GB 23200.9-2016 食品安全国家标准 粮谷中475种农药及相关化学品残留量测定 气相色谱-质谱法[S]. 北京:中国标准出版社.2016.[GB 23200.9-2016 National food safety standards-determination of 475 pesticides and related chemicals residues in grains gas chromatography-mass spectrometry[S] .BeiJing: China Standard Press,2016.]
[13] 梅文泉,陈兴连,汪禄祥,等. 固相萃取-气相色谱-质谱联用法测定葱姜蒜中12种农药残留量[J]. 西南农业学报,2016,9:2138-2143.[MEI Wen-quan,CHEN Xing-lian,WANG Lu-xiang,et al. Determination of 12 pesticide residues in ginger and garlic in allium allium by solid phase extraction and gas chromatography mass spectrometry[J]. Southwest China Journal of Agricultural Sciences, 2016,9:2138-2143.]
[14] 吴丽华.固相萃取-气相色谱法测定植物油中多种拟除虫菊酯类农药残留的方法探讨[J].粮食与食品工业,2013,20(2): 62-67. [WU Li-hua. Study on the methods for determination of various pyrethroid residue in vegetable oil by solid phase extraction-gas chromatography[J]. Cereal and Food Industry, 2013,20(2): 62-67.]

