1-乙烯基-3-甲基咪唑离子液体/分子印迹材料用于牛血红蛋白的识别
陈毅挺
(闽江学院 海洋学院化工与材料系,福建 福州 350108)
分子印迹技术(molecular imprinting technology, MIT)是一种分离纯化技术[1],将特定分子和功能单体在交联剂的作用下共同在溶液中进行聚合[2],从而获得聚合物,然后通过适宜的方法除去特定的分子,这样聚合物中就保留下与特定分子空间结构相同的三维孔穴[3]. 它对特定分子形成结构记忆,从而实现对特定分子的识别[4]. 因其构效可预定性与选择性识别性能,分子印迹技术已发展成为一种相对热门的技术,展现了良好的应用前景[5-7].
离子液体是完全由特定离子组成的一类特殊的有机盐,具有难挥发、低熔点和电导性好等特点[8-9],从而在分子印迹中具有多重用途,可充当各种角色对分子聚合反应产生影响[10-13]. 将分子印迹技术与离子液体相结合应用于蛋白质分子的分离纯化领域,有利于提高分子印迹材料的性能,并扩宽其应用范围.
本文以牛血红蛋白(bovine hemoglobin,BHb)为模板分子,丙烯酰胺(acrylamide,AAM)和碘化1-乙烯基-3-甲基咪唑离子液体在交联剂N,N’-亚甲基双丙烯酰胺(N,N’-methylenebisacrylamide,MBA)、引发剂过硫酸钾(potassium persulfate,KPS)和加速剂四甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED)的作用下进行聚合,制备含有碘化1-乙烯基-3-甲基咪唑离子液体(结构式如图1所示)的分子印迹聚合物. 试验结果显示,该分子印迹材料对模板蛋白具备特异性识别功能.
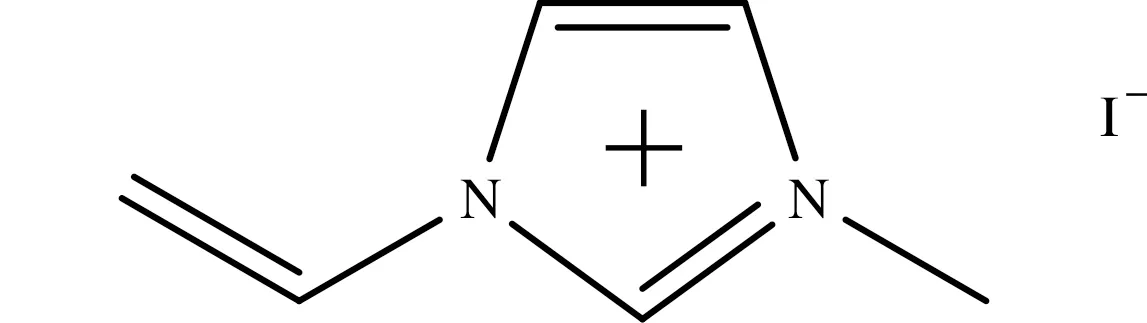
图1 碘化1-乙烯基-3-甲基咪唑结构式Fig.1 Structural formula of 1-vinyl-3-methylimidazolium iodide
1 试验部分
1.1 仪器与试剂
紫外可见分光光度计(UV-2550,日本岛津);傅立叶变换红外光谱仪(is5,美国赛默飞尼高力公司);电子分析天平(BS-214D,北京赛多利斯仪器系统有限公司);酸度计(pH 700,新加坡优特公司).
牛血红蛋白购自上海源叶生物科技有限公司;碘化-1-乙烯基-3-甲基咪唑购自上海成捷化学有限公司;四甲基乙二胺购自上海谱振生物科技有限公司;磷酸二氢钾、磷酸氢二钾、十二烷基硫酸钠和丙烯酰胺购自天津市福晨化学试剂厂;N,N’-亚甲基双丙烯酰胺购自国药集团化学试剂有限公司. 所用试剂未注明的均为分析纯,试验用水为去离子水.
1.2 牛血红蛋白分子印迹、非印迹聚合物的制备
印迹材料(MIPs)的制备:量取7 mL的磷酸盐缓冲液(PBS,pH 7.0)于50 mL烧杯中,称取0.188 8 g 碘化1-乙烯基-3-甲基咪唑离子液体和0.57 g AAM,混合均匀. 然后加入0.03 g的交联剂MBA于上述反应体系中,再加入2 mL BHb,置于25 ℃水浴加热,磁力搅拌1 h. 然后加入0.02 g过硫酸钾和20 μL TEMED,于25 ℃反应24 h. 将聚合物过筛(孔径250 μm)后,用含有10%(V/V)乙酸的10%(W/V)十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液重复洗脱多次,再用亚沸水清洗后真空干燥,研磨待用.
非印迹材料(NIPs)的制备:除了不加蛋白质分子BHb外,所有聚合和洗脱方法与上述MIPs的制备方法相同.
2 结果与讨论
2.1 牛血红蛋白标准曲线的绘制
在410 nm处测定质量浓度分别为0.00、0.02、0.06、0.10、0.15、0.20 mg/mL的BHb标准溶液的吸光度. 然后以BHb的质量浓度为横坐标,与之相对的吸光度为纵坐标,绘制标准曲线,如图2所示.

图2 BHb溶液标准曲线Fig.2 Standard curves of BHb
根据图2可见,BHb的质量浓度与对应的吸光度值呈良好的线性关系,线性回归方程为A=2.274×CBHb(mg/mL)+0.006 1,相关系数R为0.999 6.
2.2 MIPs 的红外光谱表征
采用傅立叶变换红外光谱对MIPs、NIPs材料进行官能团结构分析,其红外光谱对比图如图3所示.

图3 印迹聚合物的FT-IR图Fig.3 FT-lR spectra of imprinted polymers(1) MIPs, (2) NIPs
由图3可见, MIPs同NIPs存在相似的吸收峰,二者在3 450 cm-1左右处都有吸收峰,对应的是离子液体咪唑环上C-H和N-H的伸缩振动;红外谱图中的2 958、2 920、2 849 cm-1处的特征吸收峰对应的是咪唑环侧链上的CH3-和-CH2-的伸缩振动;在2 260 cm-1处,NIPs有明显的吸收峰,对应的咪唑上的C=N伸缩振动峰,而MIPs在此处几乎没有吸收峰,说明了咪唑环上的C=N消失了,离子液体成功与丙烯酰胺进行交联. 曲线(1)同(2)相比,在1 125 cm-1左右处的吸收峰比较不明显,可能是表面印迹的BHb蛋白干扰了这部分的红外吸收[14-15].
2.3 离子液体对吸附量的影响
考察了离子液体加入量对分子印迹聚合物性能的影响,结果如图4所示.
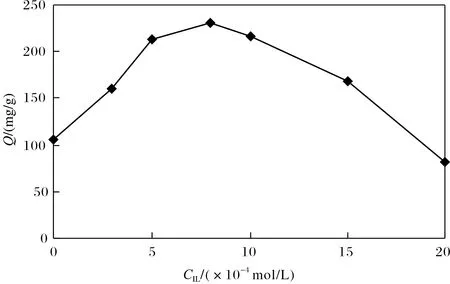
图4 离子液体用量的影响Fig.4 Effect of amount of IL
由图4可见,未加入离子液体时,聚合物对BHb的吸附量较低. 随着离子液体的加入,吸附量显著上升. 但当离子液体用量超过8×10-4mol/L后,吸附量开始下降,这估计是由于离子液体用量过大,导致聚合物成胶率下降所致. 由试验结果可见,离子液体的加入有利于提高分子印迹材料对BHb的识别能力.
2.4 吸附过程pH对吸附量的影响
印迹材料在吸附蛋白时,溶液的酸碱性是影响吸附量的一个重要的因素. 不同的酸碱条件下,蛋白质的活度不同,印迹分子对目标蛋白的吸附量也不同,因此要与目标蛋白吸附,必须找到适宜的酸碱条件. 结果如图5所示.

图5 pH对吸附量的影响Fig.5 Effect of pH on adsorption amount of BHb
根据图5可知,pH值从5到6时,印迹材料对目标蛋白的吸附量迅速增大,当pH值为6时吸附量达到222 mg/g. 随着pH值的提高,吸附量总体呈下降趋势,这是由于BHb的等电点为6.5,随着pH值的不同,印迹材料中蛋白质的带电性也随着不同,从而使得目标蛋白与印迹材料之间的作用发生变化. 当pH值在小于6.5的范围时,BHb中大部分的碱性氨基在外围显现,能够与丙烯酰胺的酰胺键联结氢键,同时具备正电结构的蛋白质分子也能够和离子液体的碘离子发生静电作用. 当pH值在大于6.5的范围时,蛋白质里的极性基团难以伸展开来,聚合物与蛋白质之间作用力不够,达不到识别位点. 结合印迹材料对蛋白质的特异选择性和吸附容量以及吸附环境的温和性,选择吸附过程中pH值控制于6.
2.5 吸附时间和洗脱时间的选择
吸附时间会明显影响分子印迹材料检测的灵敏度. 如果吸附时间过短,MIPs上的空穴还未被BHb蛋白分子填满,吸附量未达饱和吸附量. 如果吸附时间过长,MIPs上的空穴早已被BHb蛋白分子填满,已达到饱和,则降低工作效率. 将印迹材料置于0.5 mg/mL BHb溶液中进行孵化,吸附量随孵化时间变化的曲线如图6所示.

图6 吸附和洗脱时间曲线(1) 吸附, (2) 洗脱Fig.6 Time curvers of adsorption and washing(1) adsorption, (2) washing
从图6可看出,随着吸附时间的增加,吸附量先呈现明显的增加,在60 min后达到一个平台,此时吸附量达到饱和,吸附过程达到平衡. 因此,确定吸附时间为60 min. MIPs对BHb的印迹形式可能有如下两种[16]:一种是表面印迹,另一种是埋在表面聚合物里面的印迹. 从动力学曲线的斜率也可以看出,在约60 min之内,曲线斜率较大,吸附容量变化明显,属于表面印迹,具有较低的传质阻力. 接着曲线斜率变小,吸附速率变慢,属于第二种印迹形式,BHb分子渗透到MIPs内部变得困难,传质阻力增大,80 min达到饱和吸附.
模板分子的洗脱是分子印迹技术中另一个关键因素,试验中考察了洗脱时间的影响,结果如图6中的曲线(2). 试验结果表明,洗脱时间为45 min时,印迹材料中的BHb几乎完全被洗脱.
2.6 MIPs的吸附等温线的绘制
吸附等温线可有效评价MIPs对模板蛋白的饱和吸附容量. 在pH环境优化和吸附时间优化的试验条件下,将MIPs和NIPs置于离心管中,并加入不同浓度的BHb蛋白溶液,在25 ℃下恒温振荡下吸附1 h,离心后测量上层清液的吸光度,以获得印迹材料对蛋白的吸附量.
蛋白质的吸附量按照以下公式计算[14]:
Q=(Ci-Cf)V/M
(1)
其中,Q,单位质量合成的聚合物吸附的蛋白量(mg/g);Ci,蛋白质的原始质量浓度(mg/mL);Cf,吸附后的蛋白质质量浓度(mg/mL);V,混合液的体积(mL);M,聚合物材料的质量(g). 吸附等温线如图7所示.
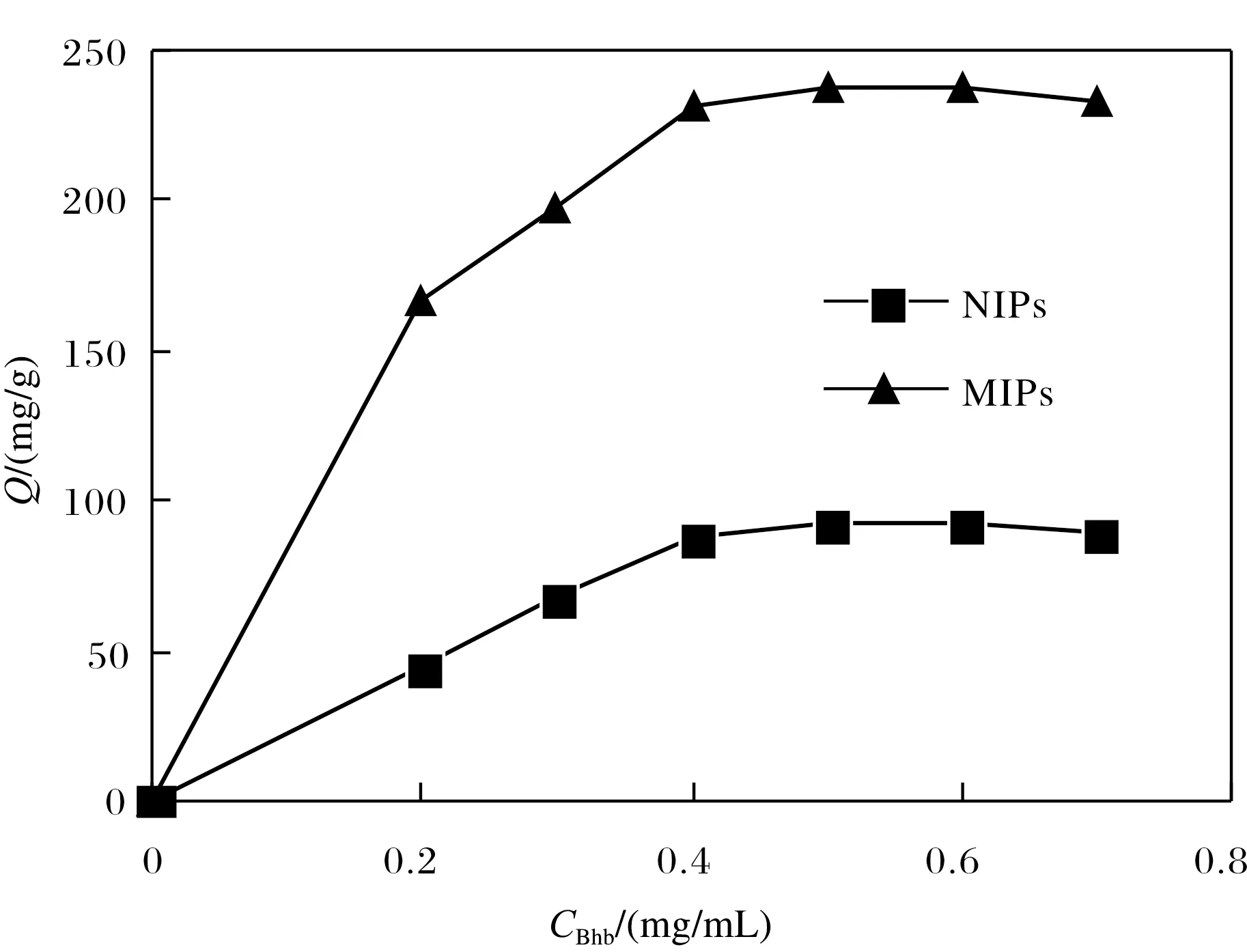
图7 印迹聚合物等温吸附曲线Fig.7 Isotermal adsorption curves of imprinted polymers
由图7能够看出,在低质量浓度范围区,MIPs和NIPs的吸附容量随BHb质量浓度的增加而快速增加. 当BHb的质量浓度增加到0.5 mg/mL时,MIPs吸附等温线趋于平坦,说明MIPs达到饱和吸附,这表明 MIPs上的结合位点已经被BHb蛋白分子填满. NIPs对应的吸附等温线与MIPs的变化趋势一致,在0.5 mg/mL时也达到饱和吸附,BHb在MIPs上的最大吸附容量为249 mg/g,而在NIPs上的最大吸附容量为184 mg/g. 对比二者的饱和吸附量,MIPs对模板分子的吸附量显示出较大的差距,这是因为印迹聚合物形成许多三维空穴和结合位点,因此MIPs对模板蛋白BHb具有特殊的吸附容量,从而达到特异性辩别BHb的目的. MIPs对BHb的识别作用,可归结为:第一,与BHb相匹配的印迹空穴;第二,蛋白质中的活性基团如氨基、羧基等与碘化1-乙烯基-3-甲基咪唑离子液体上的乙烯基、甲基等产生氢键与静电相互作用. 因此NIPs虽对BHb具备一定的吸附能力,但吸附容量低于MIPs,表现出非特异性吸附作用.
2.7 选择性测试
选择性测试是通过考察MIPs及NIPs对模板蛋白和干扰蛋白的吸附容量来评价所合成的印迹材料对模板蛋白的识别能力的一种测试方法. 选择了4种蛋白(BSA、BHb、Cyt C、OVA)作对比试验,结果如图8所示. 从图8中可以直观地看出,MIPs对BHb的吸附量明显高于其它非印迹蛋白,证明印迹过程中产生的印迹洞穴与BHb分子相匹配.
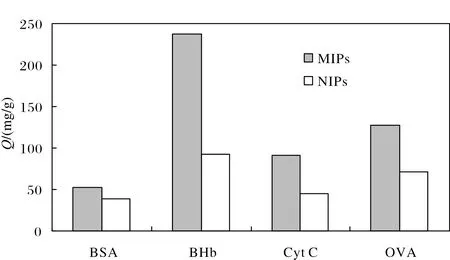
图8 印迹聚合物对不同蛋白选择性吸附能力比较Fig.8 Comparison of adsorption capacity of different proteins on imprinted polymers
2.8 重复利用性
取离子液体分子印迹聚合物对BHb进行了3次吸附-解吸-再吸附试验,3次吸附量无明显变化. 3次吸附后仍保持了首次吸附量的76.5%,说明合成的印迹聚合物的再生性能良好. 吸附量略有减小可能是由于洗脱液不能将血红蛋白洗脱充分,造成再吸附的时候,结合血红蛋白的印迹位点减少.
3 结论
用本体聚合法合成蛋白质分子印迹聚合物. 试验以丙烯酰胺和碘化1-乙烯基-3-甲基咪唑离子液体为功能单体,交联剂选择MBA,KPS为引发剂,TEMED为加速剂,合成了离子液体参与的对目标蛋白具有特异性辩别能力的分子印迹材料. 试验结果表明,该印迹材料对模板蛋白BHb具有较大的吸附容量以及较好的选择效果和稳定性. 所合成的印迹材料有望用于分离目标蛋白,且可为其它蛋白印迹的研究提供参考.
参考文献:
[1] 马大鹏.分子印迹技术及其研究新进展[J].赤峰学院学报:自然科学版,2012,28(3):22-24.[MA Da-peng. Molecular imprinting technology and its new progress in research[J]. Journal of Chifeng University(Natural Science Edition), 2012, 28(3): 22-24.]
[2] 李彩侠,马宇亮,黄微薇.分子印迹技术的基本原理及其发展方向[J].高师理科学刊,2016,36(2):44.[LI Cai-xia, MA Yu-liang, HUANG Wei-wei. The basic principle and development direction of molecular imprinting technology[J]. Journal of Science of Teachers’ College and University, 2016, 36(2): 44.]
[3] 孙寅静,罗文卿,潘俊.蛋白质分子印迹技术的研究进展及应用前景[J].药学学报,2011,46(2):132-137.[SUN Yin-jing, LUO Wen-qing, PAN Jun. Recent advances and perspective in the study of the molecular imprinting of proteins[J]. Acta Pharmaceutica Sinica, 2011, 46 (2): 132-137.]
[4] 谭天伟.分子印迹技术及应用[M].北京:化学工业出版社,2010. [TANG Tian-wei. Molecular imprinting technology and its applications[M].Beijing:Chemical Industry Press, 2010.]
[5] Tai Dar-fu, Lin Chung-yin, WU Tzong-zeng, et al. Recognition of dengue virus protein using epitope-mediated molecularly imprinted film [J].Analytical Chemistry, 2005, 77 (16): 5140-5143.
[6] WULFF Günter. Enzyme-like catalysis by molecularly imprinted polymers[J]. Chemical Reviews, 2002, 102(1): 1-27.
[7] 韩霜.分子印迹技术及其研究进展[D].东北石油大学,2014.[HAN Shuang. Molecule imprinting technology and its research progress[D]. Northeast Petroleum University, 2014.]
[8] 马源,王腾飞,何志鹏,等.吡唑类离子液体的合成及应用研究进展[J].河南大学学报,2016,46(3):307-313.[MA Yuan, WANG Teng-fei, HE Zhi-peng, et al. Progress in synthesis and application of pyrazole ionic liquid[J]. Journal of Henan University(Natural Science), 2016, 46(3): 307-313.]
[9] 张锁江,姚晓倩,刘晓敏,等.离子液体构效关系及应用[J].化学进展,2009,21(11):2465-2473.[ZHANG Suo-jiang, YAO Xiao-qian, LIU Xiao-min, et al. Structure-property relationships and applications of ionic liquids[J]. Progress in Chemistry, 2009, 21(11): 2465-2473.]
[10] 肖忠华.烷基咪唑类离子液体在分子印迹聚合物中的应用[J].中国现代应用药学.2016,33(4):513-516.[XIAO Zhong-hua. Application of alkylimidazolium-based ionic liquids on molecularly imprinted polymers[J]. Chinese Journal of Modern Applied Pharmacy, 2016, 33(4): 513-516.]
[11] 王慧,陈斌,周元臻,等.离子液体在蛋白质电化学中的应用研究[J].应用化工,2011,40(2):324-326.[WANG Hui, CHEN Bin, ZHOU Yuan-zhen, et al. Application of ionic liquids in proteins electrochemistry[J]. Applied Chemical Industry, 2011, 40(2): 324-326.]
[12] 冯小黎,金业涛,苏志国.分离纯化中蛋白质的不稳定性及其对策[J].生物工程进展,2000,20(3):67-71.[FENG Xiao-li, JIN Ye-tao, SU Zhi-guo. Instability of proteins during bioseparation and the strategy for anti-denaturation[J]. Progress in Biotechnology, 2000, 20(3): 67-71.]
[13] CHENG De-hong, CHEN Xu-wei, SHU Yang, et al. Selective extraction/isolation of hemoglobin with ionic liquid 1-butyl-3-trimethylsilylimidazolium hexafluorophosphate (BtmsimPF6) [J]. Talanta, 2008, 75(5): 1270-1278.
[14] 陈旭伟,毛全兴,王建华.离子液体在蛋白质萃取分离中的应用[J].化学进展,2013,25(5):661-668.[CHEN Xu-wei, MAO Quan-xing, WANG Jian-hua. Ionic liquids in extraction/separation of proteins[J]. Progress in Chemistry, 2013, 25(5): 661-668.]
[15] 王攀,熊伟德,张迎庆.基于分子印迹的蛋白质识别研究进展[J].化学与生物工程,2008,25(9):1-4.[WANG Pan, XIONG Wei-de, ZHANG Ying-qing. Advance in the molecular imprinting based protein recognition[J]. Chemistry & Bioengineering, 2008,25(9): 1-4.]
[16] 高婷,郭敏杰,樊志,等.蛋白质分子印迹技术载体形式的研究进展[J].高分子通报,2010,(4):36-43.[GAO Ting, GUO Min-jie, FAN Zhi, et al. Progress of protein molecular imprinting in carrier materials form[J]. Polymer Bulletin, 2010, (4): 36-43.]

