丹参酮ⅡA抗乳腺癌细胞增殖的环氧合酶-2通路研究
赵俊云,杨晓敏,赵丕文
(北京中医药大学,北京 100029)
丹参酮ⅡA是从中药丹参(Salvia miltiorrhiza Bunge)及其同属植物中分离得到的一类脂溶性化合物,其在体内外都表现出较好的抗肿瘤活性,可抑制包括乳腺癌、肺癌、肝癌、白血病、胃癌、结肠癌、前列腺癌等在内的多种肿瘤细胞株的体外增殖[1-7]。本研究旨在探讨丹参酮ⅡA对乳腺癌细胞系T47D、MCF-7、MDA-MB-231细胞增殖的影响,并从环氧合酶-2(COX-2)的表达及其主要转录因子核因子-κB(NF-κB)、激活蛋白-1(AP-1)的活性探讨丹参酮ⅡA抑制乳腺癌细胞增殖的分子机制。
1 实验资料
1.1实验材料丹参酮ⅡA购自成都曼思特生物科技有限公司;塞来昔布(Celecoxib)购自Pfizer Pharmaceuticals LLC;乳腺癌细胞系T47D、MCF-7、MDA-MB-231、5种质粒(pCOX2-Luc、pNFκB-Luc 、pAP1-Luc、pRL-CMV、EGFP质粒)均为本实验室保存;Anti-human COX-2 antibody 购自Cell Signaling Technology;DMEM/High Glucose购自Hyclone;Fetal Bovine Serum、0.25%Trypsin-EDTA、Anti-anti、Lipofectamine 2000 Reagent均购自Invitrogen;MTT干粉购自Sigma;Dual-Luciferase Reporter Assay System购自Promega;LB液体培养基(干粉)、氨苄青霉素干粉、卡那霉素干粉均购自北京索莱宝科技有限公司;无内毒素质粒小提试剂盒购自北京康为世纪生物科技有限公司。
1.2主要仪器细胞培养箱(Binder生产,型号:XMTG-908),超净工作台(北京昌平长城空气净化工程公司生产),倒置显微镜(Olympus生产,型号:CKX41),酶标仪(Tecan生产,型号:Safire2),高速冷冻离心机(Eppendorf生产,型号:3K15),荧光显微镜(Nikon生产,型号:TE2000),发光检测仪(Promega生产,型号:Glomax Multi Detection System)。
1.3实验方法
1.3.1MTT实验常规培养T47D、MCF-7、MDA-MB-231,使用含EDTA的0.25%胰蛋白酶工作液消化细胞,制备细胞悬液,于96孔细胞培养板中每孔接种200 μL细胞悬液,每孔约含4×104个细胞,培养24 h。除对照组外,丹参酮ⅡA 1~5组分别加入丹参酮ⅡA至终浓度为10-6mol/L、5×10-6mol/L、10-5mol/L、5×10-5mol/L 、10-4mol/L,每组设5复孔。分别于培养24 h、48 h、72 h后加入终浓度为0.5 mg/mL的MTT,孵育4~6 h后,每孔吸弃上清液100 μL,每孔加入150 μL DMSO,避光混匀15 min,酶标仪检测OD570,计算抑制率。
1.3.2Westernblot检测常规培养T47D、MCF-7、MDA-MB-231,使用含EDTA的0.25%胰蛋白酶工作液消化细胞,制备细胞悬液,于6孔细胞培养板中每孔接种2 mL细胞悬液,每孔约含5×105个细胞,培养24 h。除对照组外,丹参酮ⅡA组分别加入丹参酮ⅡA至终浓度为5×10-5mol/L;于培养48 h后裂解细胞,提取总蛋白,定量后进行SDS-PAGE电泳,使用PVDF膜进行转移电泳,封闭后,加入稀释后的Anti-human COX-2 antibody孵育过夜,二抗孵育1 h后曝光显影。
1.3.3脂质体转染实验按照常规方法扩增质粒,pCOX2-Luc、pNFκB-Luc、pAP1-Luc、pRL-CMV使用含0.1 mg/mL氨苄青霉素的LB培养液,EGFP质粒使用含0.05 mg/mL卡那霉素的LB培养液。摇床培养菌液24 h后,按照无内毒素质粒小提试剂盒说明抽提质粒,使用紫外分光光度计测定各种质粒的纯度及浓度,-20 ℃保存备用。于96孔板中每孔接种200 μL细胞悬液,每孔约含8×104个细胞,培养24 h后,细胞密度达90%左右时进行转染。将EGFP质粒与适量转染试剂用无血清无抗生素DMEM混匀,室温孵育20 min后,按比例加入96孔板中,并设5孔未经转染的细胞作为对照组。培养36 h后于荧光显微镜下观察绿色荧光,估计细胞的转染效率。于48孔板中每孔接种250 μL细胞悬液,每孔约含2×105个细胞,培养24 h后,细胞密度达90%左右时进行转染。将pCOX2-Luc与pRL-CMV分别按10∶1,100∶1,1 000∶1比例混合,再用无血清无抗生素DMEM与适量转染试剂混匀,室温孵育20 min后,按比例加入48孔板中,并设5孔未经转染的细胞作为对照。同样方法进行pNFκB-Luc与pRL-CMV、pAP1-Luc与pRL-CMV双转染。
1.3.4双荧光素酶报告基因检测培养48 h后,按Dual-Luciferase Reporter Assay System说明处理细胞,在发光检测仪上分别读取萤火虫荧光素酶与海肾荧光素酶活性数值,计算比值。选取适当的质粒比例,再次进行细胞的双质粒转染,同时加入一定量的丹参酮ⅡA处理,培养48 h后,在发光检测仪上读取荧光素酶活性数值,计算比值。

2 结 果
2.1丹参酮ⅡA对乳腺癌细胞体外增殖的影响MTT实验结果显示,丹参酮ⅡA对T47D、MCF-7、MDA-MB-231的体外增殖有抑制作用,且抑制率与丹参酮ⅡA的浓度及作用时长呈正相关。见表1~3。综合考虑药效及细胞存活数量,选取抑制率接近50%的5×10-5mol/L作用48 h作为后续实验中丹参酮ⅡA的浓度与作用时长。

表1 丹参酮ⅡA对T47D增殖的影响

表2 丹参酮ⅡA对MCF-7增殖的影响

表3 丹参酮ⅡA对MDA-MB-231增殖的影响
2.2丹参酮ⅡA对乳腺癌细胞COX-2蛋白水平的影响使用终浓度为5×10-5mol/L的丹参酮ⅡA处理3种乳腺癌细胞48 h后,与对照组相比,3种细胞中COX-2的蛋白水平均明显降低。见图1。

图1 3种乳腺癌细胞中COX-2蛋白表达水平
2.3丹参酮ⅡA对乳腺癌细胞COX-2转录活性的影响使用终浓度为5×10-5mol/L的丹参酮ⅡA处理转染(pCOX2-Luc∶pRL-CMV=100∶1)后的3种乳腺癌细胞48 h后,与对照组相比,T47D和MCF-7细胞丹参酮ⅡA组的比值显著降低(P均<0.05)。见表4。
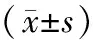
表4 丹参酮ⅡA对乳腺癌细胞COX-2转录活性的影响
注:①与对照组比较,P<0.05。
2.4丹参酮ⅡA对乳腺癌细胞NF-κB活性的影响使用终浓度为5×10-5mol/L的丹参酮ⅡA处理转染(pNFκB-Luc∶pRL-CMV=1 000∶1)后的3种乳腺癌细胞48 h后,与对照组相比,T47D和MCF-7细胞丹参酮ⅡA组的比值显著降低(P均<0.05)。见表5。
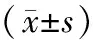
表5 丹参酮ⅡA对乳腺癌细胞NF-κB活性的影响
注:①与对照组比较,P<0.05。
2.5丹参酮ⅡA对乳腺癌细胞AP-1活性的影响使用终浓度为5×10-5mol/L的丹参酮ⅡA处理转染(pAP1-Luc∶pRL-CMV=1 000∶1)后的3种乳腺癌细胞48 h后,与对照组相比,3种细胞丹参酮ⅡA组的比值均显著降低(P均<0.05)。见表6。
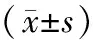
表6 丹参酮ⅡA对乳腺癌细胞AP-1活性的影响
注:①与对照组比较,P<0.05。
3 讨 论
丹参酮ⅡA是一种被证实具有抗肿瘤活性的中药小分子单体化合物,可通过抑制肿瘤细胞增殖、诱导肿瘤细胞分化、促进肿瘤细胞凋亡、抑制肿瘤细胞的侵袭和转移等多途径发挥抗肿瘤作用,其与某些化疗药物合用有减毒增效的作用[1-7]。本研究使用了3种乳腺癌细胞系,其中T47D和MCF-7是雌激素受体阳性细胞系,MDA-MB-231是三阴性细胞系,这3种乳腺癌细胞均有COX-2高表达的特性。丹参酮ⅡA等中药单体对乳腺癌细胞系的抑制作用与雌激素受体阳性与否并无明显关系。因此本文着重探讨丹参酮ⅡA对与肿瘤密切相关的炎症通路COX-2的抑制作用,进一步阐明丹参酮ⅡA的抗肿瘤机制。
乳腺癌是女性最为常见的恶性肿瘤之一,乳腺癌的预防、早期发现及治疗可有效降低群体发病率和提高患者生存质量。目前乳腺癌的治疗手段主要有手术治疗、放化疗、生物治疗等,对乳腺癌进行早期筛查诊断,并辅以抗肿瘤天然药物干预,可有效改善患者的生存质量。本研究结果显示丹参酮ⅡA可有效抑制乳腺癌细胞的体外增殖,且呈明显的量效关系和时间依赖性,其中终浓度5×10-6mol/L的丹参酮ⅡA处理乳腺癌细胞48 h后能达到近50%的抑制率,较低的浓度及其适当的起效时间显示了丹参酮ⅡA在肿瘤治疗中的应用前景。COX-2是COX家族的重要成员。COX主要有3种同工酶,其中COX-1是一种持续表达的结构酶,发挥看家作用,主要调节生理性前列腺素合成[8];COX-3是一种新型剪接异构体,与COX-1源于同一基因,主要在心、脑组织持续表达[9];COX-2又称诱导型环氧化酶,在正常生理状态下多数组织不表达或低表达,但在生长因子、内毒素及肿瘤促进因子的作用下呈诱导性表达,尤其是在肿瘤组织中,COX-2的表达普遍有增强趋势[8]。除此之外,COX-2还是重要的细胞凋亡抑制因子,与肿瘤细胞的命运密切相关。大量研究表明,COX-2可通过促进肿瘤细胞增殖、抑制肿瘤细胞凋亡、促进肿瘤血管形成以及增强肿瘤细胞的侵袭和转移能力,从而促进肿瘤的形成与发展[10-12]。相关临床资料也表明,COX-2 与肿癌的发生、发展及转移关系密切, 对于肿瘤的早期诊断及预后预测有重要意义, 是多种肿瘤治疗药物的重要靶点之一[13]。COX-2抑制剂目前已广泛应用于肿瘤的临床治疗。本研究发现,丹参酮ⅡA可显著降低乳腺癌细胞COX-2的蛋白水平,且在启动子水平有效抑制COX-2的转录,这显示了丹参酮ⅡA在抑制乳腺癌发展、转移以及预防中的应用前景。与T47D、MCF-7不同,MDA-MB-231在COX-2转录水平上的降低不显著,提示雌激素受体存在与否与丹参酮ⅡA对COX-2转录水平的影响有相关性。
COX-2基因的启动子序列上游除1个保守的启动子序列TATA盒以外,还包含一些早期应答相关的顺式作用元件,如转录因子NF-κB、AP-1的结合位点[8]。NF-κB可调控参与免疫反应早期和炎症反应各阶段的许多分子的调控,包括COX-2。AP-1是炎症、肿瘤等情况下调节COX-2表达的重要转录因子,主要以磷酸化c-jun/c-fos二聚体形式与AP-1位点结合进而增强COX-2的转录水平[14]。本研究中使用位点质粒pAP1-Luc和pNFκB-Luc,可以直观显示发挥转录增强作用的NF-κB、AP-1位点的活性。实验结果显示丹参酮ⅡA可有效降低乳腺癌细胞中该位点的活性。值得注意的是,丹参酮ⅡA主要对AP-1位点的活性有显著降低,对于MDA-MB-231中NF-κB位点的活性无明显改变,结合上述结果,可以推测丹参酮ⅡA作用于MDA-MB-231的机制不同于T47D、MCF-7,这是否与雌激素受体有无相关还有待验证。对于转录因子NF-κB、AP-1对乳腺癌细胞增殖的影响及丹参酮ⅡA对其的干预,还将在后续工作中进一步探讨。
[参考文献]
[1]Zhao PW,Niu JZ,Wang JF,et al. Research on the inhibitory effect tanshinone ⅡA on breast cancer cell proliferation[J]. Chin Pharmacol Bull, 2010, 26(7):903-906
[2]Dai ZK,Shi JS,Wu Q,et al. Apoptosis inducing effect of Tanshinone ⅡA on human lung adenocarcinoma A549 cells[J]. Chin Pharmacol Bull,2010,26(11):1505-1508
[3]Cheng CY,Su CC. Tanshinone ⅡA inhibits Hep-J5 cells by increasing calreticulin,caspase 12 and GADD153 protein expression[J]. Int J Mol Med,2010,26(3):379-385
[4]Liu C,Li J,Wang L,et al. Analysis of tanshinone ⅡA induced cellular apoptosis in leukemia cells by genome-wide expression profiling[J]. BMC Complement Altern Med,2012,12(1):5
[5]Chen J,Shi DY,Liu SL,et al. Tanshinone ⅡA induces growth inhibition and apoptosis in gastric cancer in vitro and in vivo[J]. Oncol Rep,2012,27(2):523-528
[6]Zhou LH,Hu Q,Sui H,et al. Tanshinone Ⅱ-a inhibits angiogenesis through down regulation of COX-2 in human colorectal cancer[J]. Asian Pac J Cancer Prev,2012,13(9):4453-4458
[7]Won SH,Lee HJ,Jeong SJ,et al. Tanshinone ⅡA induces mitochondria dependent apoptosis in prostate cancer cells in association with an inhibition of phosphoinositide 3-kinase/AKT pathway[J]. Biol Pharm Bull,2010,33(11):1828-1834
[8]Mauro A,Lipari L,Leone A,et al. Expression of cyclooxygenase-1 and cyclooxygenase-2 in normal and pathological human oral mucosa[J]. Folia Histochem Cytobiol,2010,48(4):555-563
[9]Chandrasekharan NV,Dai H,Roos KL,et al. COX-3,a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs:cloning, structure,and expression[J]. Proc Natl Acad Sci USA,2002,99(21):13926-13931
[10] Arun B,Goss P. The role of COX-2 inhibition in breast cancer treatment and prevention[J]. Semin Oncol,2004,31(Suppl7):22-29
[11] Edwards J,Mukherjee R,Munro AF,et al. HER2 and COX2 expression in human prostate cancer[J]. Eur J Cancer,2004,40(1):50-55
[12] Berasain C,Castillo J,Perugorria MJ,et al. Inflammation and liver cancer:new molecular links[J]. Ann N Y Acad Sci,2009,1155(1):206-221
[13] Singh B,Cook KR,Vincent L,et al. Role of COX-2 in tumorospheres derived from a breast cancer cell line[J]. J Surg Res,2011,168(1):39-49
[14] Caputto BL,Cardozo Gizzi AM,Gil GA. c-Fos:an AP-1 transcription factor with an additional cytoplasmic,non-genomic lipid synthesis activation capacity[J]. Biochim Biophys Acta,2014,1841(9):1241-1246

