姜黄素对人类子宫内膜异位症异位内膜组织中基质细胞衍生因子-1及间质细胞增殖和侵袭的影响
胡淑寒,曹保利,刘 霞,张 敏,谭桂兰
(1. 天津中医药大学,天津 300193;2. 天津市南开医院,天津 300100;3. 天津市妇女儿童保健中心,天津 300152)
子宫内膜异位症(EMS)是子宫内膜腺体和间质出现在子宫腔以外的部位而引起的进行性痛经、慢性盆腔疼痛、性交痛、月经失调、不孕等临床表现的疾病。流行病学调查显示,正常情况下有80%~90%的育龄妇女存在经血逆流现象,而仅有6%~8%罹患EMS[1]。大量研究表明EMS虽然是良性疾病,但其生物学表现与恶性肿瘤高度相似,即异位内膜的黏附、侵袭、血管生成“三步曲”(3A模式)及细胞的无限增殖和凋亡数量减少[2],因此抗黏附、抗侵袭、抗血管生成已成为EMS新的治疗策略。雌激素、局部环境的多种酶和细胞因子等都参与这一病理过程。西医除手术治疗外,西药治疗不良反应较多,复发率较高,给患者带来不便。临床实践表明中药在治疗EMS方面疗效确切,不良反应少。姜黄素是从姜科植物姜黄、郁金的块茎中提取的一种植物多酚,姜黄提取物中的黄色酚类物质分别是姜黄素、双脱甲氧基姜黄素(BDMC)、脱甲氧基姜黄素(DMC)的混合体,姜黄素是姜黄提取物中最重要的活性成分,其微溶于水,易溶于DMSO、乙醇、丙酮、氯仿等有机溶剂,见光易发生降解,具有抗炎、抗氧化、抑制血管新生及抗肿瘤活性作用[3]。近年来大量实验表明,姜黄素具有降低雌二醇的表达水平和抑制异位内膜的增殖与血管生成作用[4-8],其作为一种药剂治疗EMS 具有很好的优势和应用前景[9-11]。本实验期望通过测定不同浓度的姜黄素对人类EMS异位内膜细胞中基质细胞衍生因子-1(SDF-1) mRNA表达和间质细胞增殖、侵袭的影响,希望找到一种治疗EMS的新方法。
1 实验资料
1.1实验标本本实验所用在位子宫内膜组织均取自2015年10月—2017年1月天津市南开医院妇产科因腺肌症合并EMS接受子宫切除术的30例患者,患者均无内科合并症,术前3个月内未服用激素类药物。所有标本获得均经医院伦理委员会批准并取得患者知情同意。
1.2实验药品及试剂姜黄素(C1386-10G,Sigma公司提供);胎牛血清,DMEM培养液,青霉素,链霉素,胰酶粉,胶原蛋白酶IV粉,0.25%胰酶细胞消化液,PBS磷酸盐缓冲液(上海拜力生物科技有限公司提供);伊红、苏木素染色剂(南开医院提供);细胞RNA 提取试剂盒和逆转录试剂(天津生化科技北京有限公司提供);噻唑蓝(MTT),二甲基亚砜(DMSO,索来宝生物技术有限公司提供)。
1.3实验仪器实用单人净化操作台(型号:MSC-Advantage 1.2);恒温离心机(型号:CRH-100);高速冷冻离心机(型号:KUBTOA 3500);RT-PCR仪(型号:IQ5);Thermo微量定量移液器(型号:WDYIII-5);37 ℃恒温细胞培养箱(型号:DRP-9002);细胞培养瓶、培养板;血细胞计数板(型号:1103);酶联免疫检测仪(型号:HBS-1096B);0.22 μm无菌滤器(型号:SLGP033RB0);Transwell小室(型号:COSTAR-3413)。
1.4实验方法
1.4.1原代培养将子宫内膜标本用无菌盐水冲洗后,置入10 mL无菌冰冷PBS液(含有青霉素100 IU/mL、链霉素100 μg/mL)中,立即送实验室,进行细胞培养。本实验采用的是间质细胞的培养方法。 剪碎组织,700 r/min离心5 min,共2次,用于洗涤组织。分别加0.25%胰酶2 mL及0.1%胶原酶1 mL,放置于摇床孵育15 min,消化后细胞悬液含单个间质细胞和葡萄串状上皮细胞。消化完毕后加入含有15%胎牛血清的DMEM/F12完全培养液5 mL终止上清液的消化,用枪头反复轻轻吹打,80目过滤分离未消化组织,此时为腺上皮和间质细胞的混合培养。400目分离,1 000 r/min离心10 min,共2次,此时得到液体大部分为间质细胞。调整细胞密度为l×107mL-1,接种置于37 ℃ 5%CO2细胞培养箱中培养,每2~3 d换液1次。每天用倒置显微镜观察细胞的形态和生长状况,HE染色、免疫组织化学对子宫内膜细胞进行鉴定。
1.4.2传代培养倒置显微镜下观察,待原代细胞长满瓶壁约90%时进行传代。弃去培养液,加入0.25%胰蛋白酶消化,待一半细胞收缩变圆后终止消化,再倒入50 mL离心管中1 000 r/min离心5 min,加入培养液,置于37 ℃、含5%CO2的培养箱内培养;隔2 d换液1次,并在显微镜下观察; 细胞传代2次后经细胞化学染色方法进行鉴定、观察细胞情况、拍摄照片。
1.4.3分组及给药传代培养成功后,接种于24孔板进行PCR、transwell实验,接种于96孔板进行MTT实验。实验分为对照组(姜黄素浓度0 μmol/L)、姜黄素高剂量组(姜黄素浓度50 μmol/L)、姜黄素中剂量组(姜黄素浓度30 μmol/L)、姜黄素低剂量组(姜黄素浓度10 μmol/L)。以上用姜黄素根据文献[12]中方法用DMSO助溶,加入DMEM配置成100 μmol/L的储存液,0.22 μm微孔滤器过滤除菌分装,避光-20 ℃保存,2周内有效,使用时用含有2%胎牛血清DMEM培养液稀释至所需浓度(DMSO≤0.1%)
1.4.4SDF-1mRNA表达检测将0~50 μmol/L处理24 h的间质细胞消化离心,收集细胞,使用TRIzol(Invitrogene,美国)提取总RNA,按说明书操作,测定RNA的浓度和纯度符合要求后用AMV逆转录酶进行逆转录(逆转录试剂盒和RNA提取试剂购自天津生化科技北京有限公司),在经RNase Free处理过的EP管中建立反应体系:2.5×RealMasterMix 9 μL,正向引物0.5 μL,反向引物0.5 μL,DNA模板2 μL,超纯水8 μL,最终反应体系为20 μL。采用 RT-PCR法检测各组内膜组织中SDF-1 mRNA的表达;引物设计:SDF-1上游为5’-ATGCCCCTGCCGATTCTTTG-3’,下游为5’-TTGTTGCTTTTCAGCCTTGC-3’。反应条件:95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,共35个循环,最后72 ℃延伸8 min结束反应。
1.4.5细胞增殖抑制实验取处于对数生长期、状态良好的间质细胞,用0.25%胰蛋白酶消化,收集细胞调整细胞浓度为5×104mL-1,接种于96孔培养板,每孔体积200 μL,37 ℃、5%CO2条件下培养。培养24 h细胞完全贴壁后,将培养液更换为含不同浓度姜黄素的培养液,姜黄素质量浓度依次为50,30,10,0 μmol/L,置于37 ℃,5% CO2条件下继续孵育培养 24,48,72 h。每个处理组设6个复孔,每孔加入MTT溶液(5 mg/mL)20 μL,继续孵育4 h,终止培养,吸弃上清液,每孔加入150 μL DMSO,振荡使结晶物充分溶解。空白对照组只加培养基、MTT和DMSO的空白对照孔调零,于570 nm波长处在酶联免疫检测仪上测定各孔吸光值。每组实验重复 3 次。计算公式: 细胞抑制率(%)=(1-OD药物)/OD对照组×100%。
1.4.6细胞体外侵袭实验将人工基底膜(Matrigel)在4 ℃解冻,按1∶8比例加入无血清DMEM稀释,以每孔60 μ L包被24孔Transwell细胞培养板(COSTAR-3413)的上室,于37 ℃、5%CO2细胞培养箱中4 h成胶。用无血清DMEM饥饿处理细胞24 h,用含15%胎牛血清的DMEM配成单细胞悬液,取200 μL细胞悬液以1×105个/孔接种到上室,再分别加入姜黄素0 μmol/L、10 μmol/L、30 μmol/L、50 μmol/L,下室加入600 μL含15%胎牛血清的细胞培养基,并作空白对照。每组设6个复孔,4组,共24孔,置于37 ℃、5%CO2培养48 h,取出Transwell小室,PBS冲洗2遍,用棉球擦去上室表面细胞,下室面用95%乙醇固定10 min,常规苏木素-伊红(HE)染色,显微镜下计数侵入下室膜表面的细胞。随机计数5个视野下(×400)的细胞,取平均值。侵袭抑制率(%)=(1-实验组侵袭细胞数/对照组侵袭细胞数)×100%。
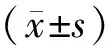
2 结 果
2.1各组间质细胞中SDF-1mRNA表达水平作用48 h后,对照组SDF-1mRNA表达水平为3.013±0.518,姜黄素低剂量组为2.831±0.241,姜黄素中剂量组为1.957±0.241,姜黄素高剂量组为0.965±0.198, 4组间比较差异有统计学意义(F=45.664,P<0.05),姜黄素各剂量组异位内膜间质细胞中SDF-1 mRNA 表达量均有不同程度的下降(P均<0.05),且随药物浓度的增加下降更明显(P<0.05)。
2.2各组间质细胞增殖与凋亡情况姜黄素作用间质细胞24 h、48 h、72 h后的OD值见图1。各浓度的姜黄素对细胞分别作用24 h、48 h、72 h后细胞抑制率比较差异有统计学意义(F=25.834,P<0.05),同时点姜黄素高、中、低剂量组细胞抑制率比较差异有统计学意义(F=614.698,P<0.05),姜黄素对异位内膜间质细胞的生长增殖抑制呈明显的剂量和时间效应关系。见表1。
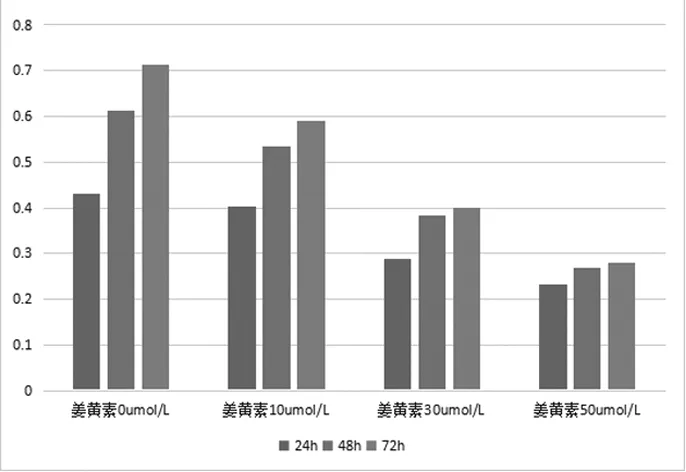
图1 姜黄素作用间质细胞24 h、48 h、72 h后的OD值
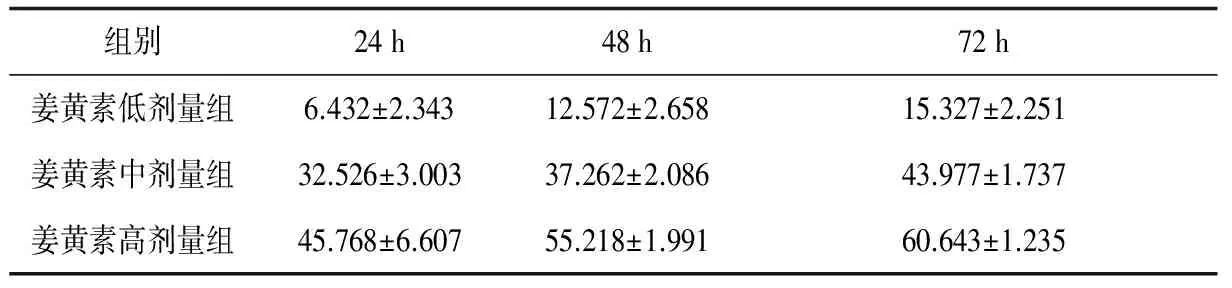
组别24h48h72h姜黄素低剂量组6.432±2.34312.572±2.65815.327±2.251姜黄素中剂量组32.526±3.00337.262±2.08643.977±1.737姜黄素高剂量组45.768±6.60755.218±1.99160.643±1.235
2.3各组间质细胞的侵袭抑制率作用48 h后,侵袭抑制率组间整体比较差异有统计学意义(F=122.674,P=0.000),随着姜黄素浓度的升高,间质细胞的侵袭数量减少,浓度越高,侵袭率越低。见表2。
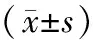
表2 各组间质细胞穿膜细胞数及侵袭抑制率比较
3 讨 论
原代细胞培养的形态学显示,原代腺上皮细胞在培养过程中1~2代仍可保持其原来特性,从第3代以后的细胞形态开始发生变化,不易存活。在体外培养模型中,分离培养的腺上皮细胞由于缺乏与间质细胞的物质交换及信号交流,腺上皮细胞得不到必需的营养物质和信号调控,导致生长缓慢甚至死亡。因此,可以推测在体外的子宫内膜细胞异位种植过程中,相对于腺上皮细胞,间质细胞对子宫内膜的异位种植起着决定性的作用。有国外文献报道, CXCR4基部基因水平在上皮细胞上高于间质细胞;相反,CXCL12(SDF-1)在间质细胞上高于上皮细胞[13]。所以本研究用SDF-1作为EMS间质细胞的标志。
SDF-1属CXC类趋化因子,是CXCR4唯一配体,SDF-1与其受体CXCR4结合后,可通过促进CXCR4二聚体形成、空间构象改变、内化以及激活与其相耦联的G蛋白等机制而激活多种信号转导通路[14]。SDF-1/CXCR4与EMS的关联很可能是通过SDF-1/CXCR4→PI3→MAPK→NF-κB信号传导通路,以及IACM-1、CD34+、MMP2、MMP9、VEGF等因子的作用来形成黏附、侵袭和血管生成“三步曲”及细胞的无限增殖。张敏等[15]研究报道大鼠异位内膜组织中 SDF-1、CXCR4m RNA 的表达明显高于大鼠在位内膜组织及正常在位内膜组织,说明SDF-1/CXCR4在大鼠EMS中起到一定作用。熊苗等[16]研究发现,EMS患者的在位内膜、病灶周围组织及异位病灶组织中均有SDF-1的表达,且异位病灶组织及在位内膜中的表达明显高于正常内膜组织,说明SDF-1/CXCR4参与了EMS的形成和发展。本实验通过RT-PCR技术测SDF-1mRNA表达情况,结果显示姜黄素各剂量组异位内膜间质细胞中SDF-1 mRNA表达量均有不同程度的下降,且随药物浓度的增加下降更明显,说明SDF-1/CXCR4轴可能参与了EMS的发展过程,姜黄素可能通过某种通路抑制EMS的形成。
EMS是一种子宫内膜活性增高所致的内膜异常性基因疾病,与内膜细胞的异地黏附和侵袭性增强有关[17]。相关研究表明,通过调控NF-κB,下调PI3K、MAPK通路,可能会抑制MMP-2、MMP-9表达和活性,从而抑制子宫内膜中相关细胞的侵袭和迁移[18]。苏晓华等[19]研究发现EMS患者的子宫内膜间质细胞侵袭、转移能力强于非EMS患者,且在EMS发病中异位病灶子宫内膜间质细胞的侵袭、转移能力更强。Transwell小室是目前应用较广泛的细胞侵袭力研究模型。本实验发现姜黄素作用后异位内膜细胞侵袭力下降,且细胞侵袭力随着姜黄素浓度的增加而减弱,进一步说明侵袭是EMS形成的重要一步,姜黄素有抑制EMS侵袭性的作用。姜黄素可能通过降低细胞SDF-1mRNA的表达,抑制上游核转录因子κB(NF-κB)活性而下调MMP的表达,进而抑制人异位子宫内膜细胞的侵袭和转移。
研究表明,EMS组织区域内细胞的凋亡功能会造成不同程度的损害[20],所以通过凋亡可以有效清除子宫内膜细胞,达到维持月经周期内细胞内环境稳定的作用[21]。1976年Hopwood和Levison首次提出正常的子宫内膜有细胞凋亡的表达后,近年来越来越多的研究证明,凋亡通过清除异位子宫内膜细胞并维持月经周期中细胞内环境的稳定中起着重要作用[22]。Harada等[23]将EMS患者的在位和异位子宫内膜组织与正常子宫内膜组织进行凋亡敏感性比较,发现无论是在位还是异位内膜组织的凋亡性均降低,异位内膜组织为甚。MTT法是一种检测细胞存活和生长的常用方法,其吸光度OD值的大小可反映活细胞数目的增生或抑制程度[24]。本实验结果显示,姜黄素对异位内膜间质细胞的生长增殖抑制呈明显的剂量和时间效应关系。
姜黄素作为近年来具有潜在的抗癌作用的新药被美国国立肿瘤所(NCI)将其列为第3代防癌药物。EMS具有类癌生物学行为,异位内膜间质细胞凋亡、侵袭特性的改变可能是EMS发生、发展的重要机制,所以姜黄素有望成为治疗EMS的一种理想中药,其抑制增殖和侵袭的能力可能是通过SDF-1/CXCR4生物学轴,但这只是一种猜想,还需进一步证明。相信经过不断完善研究,能够进一步揭示姜黄素作用于异位子宫内膜细胞的具体作用机制,将姜黄素应用于EMS的临床治疗指日可待。
[参考文献]
[1]Leyendecker G,Wildt L,Mall G. The pathophysiology of endometriosis and adenomyosis:tissue injury and repair[J]. Arch Gynecol Obstet,2009,280(4):529-538
[2]郎景和. 子宫内膜异位症研究的任务与展望之一[J]. 中华妇产科杂志,2006,41(5):289-290
[3]张博, 叶丽红. 姜黄素抗癌机制研究进展[J]. 中医药学报,2013,41(1):121-123
[4]余峥. 姜黄素抑制子宫内膜异位症雌激素生成的实验研究[D]. 武汉:湖北中医药大学,2010
[5]方毅,张沁舒,王继东,等. 姜黄素对大鼠子宫内膜异位症影响的实验研究[J]. 中成药,2013,35(3):440-445
[6]王澍弘,徐鸿毅,董毅飞,等. 姜黄素对体外培养异位内膜细胞生长及凋亡的影响[J]. 中国中医急症,2009,18(5):784-786
[7]曹洪,李聪,裴晓梦,等. 姜黄素抑制子宫内膜细胞及对雌激素生成影响的实验研究[J]. 湖北医药学院学报,2014,33(6):533-537
[8]Zhang Y,Cao H,Hu YY,et al. Inhibitory effect of curcumin on angiogenesis in ectopic endometrium of rats with experimental endometriosis[J]. Int J Mol Med,2011,27(1):87-94
[9]Sankar P,Telang AG,Manimaran A. Curcumin protects against cypermethrin-induced genotoxicity in rats[J]. Environ Toxicol Pharmacol,2010,30(3):289-291
[10] Huang AC,Chang CL,Yu CS,et al. Induction of apoptosis by curcumin in murine myelomonocytic leukemia WEHI-3 cells is mediated via endoplasmic reticulum stress and mitochondria-dependent pathways[J]. Environ Toxicol,2013,28(5):255-266
[11] Mito S,Thandavarayan RA,Ma M,et al. Inhibition of cardiac oxidative and endoplasmic reticulum stress-me-diated apoptosis by curcumin treatment contributes to protection against acute myocarditis[J]. Free RadicRes,2011,45(10):1223-1231
[12] 郭立达,焦振霞,宋瑛,等. 姜黄素诱导结肠癌LoVo细胞凋亡的作用及机制研究[J]. 中国中药杂志,2013,38(13):2191-2196
[13] Ruiz A,Salvo VA,Ruiz LA,et al. Basal and steroid hormone-regulated expression of CXCR4 in human endometrium and endometriosis[J]. Reprod Sci,2010,17(10):894-903
[14] 杨志峰,杨清玲,陈昌杰. 趋化因子SDF-1与受体CXCR4的研究进展[J]. 分子诊断与治疗杂志,2011,3(1):58-61
[15] 张敏,宋殿荣,曹保利,等. 复方莪术散对大鼠子宫内膜异位症基质细胞衍生因子-1及其受体表达的影响[J]. 中国中西医结合外科杂志,2016,22(1):38-41
[16] 熊苗,屠菊红,赵爱民. 趋化因子及其受体与子宫内膜异位症的关系[J]. 中国妇幼健康研究,2006,17(6):516-518
[17] Kobayashi H,Higashiura Y,Shigetomi H,et al. Patho-genesis of endometriosis;the role of initial infection and subsequent sterile inflammation[J]. Mol Med Rep,2014,9(1):9-15
[18] Gonzralez-Ramos R,Van Langendonckt A,Defrlere S,et al. Involvement of the nuclear factor-κB pathway in the pathogenesis of endometriosis[J]. Fertil Steril,2010,94(8):1985-1994
[19] 苏晓华,宋殿荣,张崴,等. 子宫内膜异位症中子宫内膜间质细胞侵袭、转移能力的研究[J]. 天津医药,2014,42(12):1163-1167;1259
[20] Qiang S,Zhuo S,Zheng YZ,et al. Protection against pseudonmonas aeruginosa pneumonia and sepsis-induced lung injury by overexpression of beta defensin-2 in rats[J]. Shock,2006,26(4):365-371
[21] Liu KX,Chen SQ,Zhang H,et al. Intestinal ischemia reperfusion upregulates β-defensin-2 expression and causes acute lung injury in the rat [J]. Injury,2009,40(5):950-955
[22] Kaponis A,Izawa M,Kiyama T,et al. Apoptosis and endometriosis[J]. Front Biosci (Elite Ed),2011,1(3):648-662
[23] Harada T,Kaponis A,Iwabe T,et al. Apoptosis in human endometrium and endometriosis[J]. Hum Reprod Update,2004,10(1):29-38
[24] 刘玉琴. 细胞培养实验手册[M]. 北京:人民军医出版社,2009:3-5

