顺气化痰方对慢性阻塞性肺疾病大鼠炎症因子及基质金属蛋白酶的影响
郭 媛,耿立梅
(1. 石家庄大德中医门诊部,河北 石家庄 050000;2. 河北省中医院,河北 石家庄 050011)
慢性阻塞性肺疾病(COPD)以不完全可逆性及持续进展性气流受限为特征。目前认为COPD的发病机制主要为炎性因子相关机制[1],气道黏膜发生炎性反应,释放炎性递质,气道黏膜的结构发生改变,导致气道的反复损伤和修复[2]。顺气化痰方为临床治疗COPD的有效方剂,本实验旨在进一步探讨该方的治疗机制。
1 实验资料
1.1实验动物Wistar清洁雄性大鼠32只,体质量240~260 g,购自河北医科大学实验动物中心,生产许可证号:SCXK(冀)2013-1-003。
1.2实验试剂脂多糖(LPS,美国Sigma公司,批号:L2880-10,10 mg/瓶);戊巴比妥钠(上海阳光生物技术有限公司);新石家庄牌香烟(石家庄卷烟厂,焦油量12 mg,烟气烟碱量1.0 mg,烟气一氧化碳量13 mg);生理盐水(石家庄四药);中性树脂(上海化学试剂公司);肿瘤坏死因子-α(TNF-α)放射免疫分析药盒(北京华埠力特生物技术研究所);白细胞介素-8(IL-8)放射免疫分析药盒(北京普尔伟业生物科技有限公司)。
1.3实验仪器自制熏烟箱(80 cm×60 cm×50 cm有机玻璃箱);导烟装置(Longer-Pump);大鼠解剖台(张家港市青松生物医学仪器有限公司);IX-70倒置相差显微镜(日本Olympus);FJ-2021型γ-放射免疫计数器(西安二六二厂);756MC型紫外-可见分光光度计(上海精密科学仪器有限公司);PE9600型PCR扩增仪(美国PE公司);紫外透射仪(北京鼎国),数码显微镜 DP73(日本Olympus);电冰箱(BCD 青岛海尔);石蜡包埋机(德国LEICA公司)。
1.4实验药物顺气化痰方,由蜜麻黄、杏仁、石膏、白前、前胡、浙贝母、紫菀、冬花、炙杷叶、甘草组成。大鼠用药量按成人日服量换算,依据大鼠与人体表面积计算给药量。
1.5动物分组及处理雄性Wistar大鼠于实验室给予普通饲料喂养,自由饮水1周后,随机将大鼠分为正常组、模型组、顺气化痰方高剂量组、顺气化痰方低剂量组,每组8只。除正常组外,其余组大鼠参照文献[3]中烟熏联合气道滴入LPS法制备COPD模型。造模第1天和第14天,各造模组气管内滴入浓度为1 g/L的LPS 200 μL,正常组气管内滴入生理盐水200 μL。第2—13天和第15—30天,将造模组大鼠放入自制熏烟箱内,经导烟装置按每次15只香烟,每次20 min,间隔4 h,每日2次熏烟,每次熏烟浓度在5%左右。造模结束后,顺气化痰方高、低剂量组分别灌胃顺气化痰方13.5 g/kg、0.9 g/kg,正常组、模型组灌胃纯净水,均1次/d,连续30 d。
1.6观察指标
1.6.1血清IL-8、TNF-α水平灌胃结束后第2天,10%水合氯醛麻醉大鼠,股动脉取血5 mL,4 ℃ 3 000 r/min离心10 min,分离血清,应用γ-放射免疫计数器测定各组大鼠血清IL-8、TNF-α水平。
1.6.2肺组织形态学处死各组大鼠后,切取右下肺组织,放于4%甲醛溶液内固定24 h,石蜡包埋,切片HE染色,数码显微镜下拍照,观察肺组织形态学变化。
1.6.3MMP-2、MMP-8mRNA表达情况
1.6.3.1总RNA的提取取少许溶解的RNA,用TE Buffer稀释后于紫外分光光度计260 nm和280 nm处读取A值,总RNA浓度= A260×稀释倍数×0.04 μg/μL,用前调整为1 μg/μL。
1.6.3.2反转录反应取总RNA 2 μg,加入RT反应体系(含AMV Buffer,dNTPs,Oligo dT Primer,AMV,Rnase Inhibitor等)管中,于PCR仪42 ℃ 30 min(cDNA合成),99 ℃ 5 min( 逆转录酶失活),5 ℃ 5 min。 -20 ℃保存备用。PCR扩增条件:94 ℃变性3 min;94 ℃变性40 s,退火50 s,72 ℃ 90 s,30个循环;72 ℃延伸10 min。RT-PCR反应引物:MMP-2上游引物序列为5’-ACGATGATGACCGGAAGTGG-3’,下游为5’-GTGC TGGCAGAA TAGACCCA-3’;MMP-8上游引物序列为5’-TCCAGGTTACCCCACTAGCA-3’,下游为5’-TGCAACTCTAGTGACTCTGCG-3’;GAPDH上游引物序列为5’-GCAACTCCCATTCTTCCACC-3’,下游为5’-TGGTATTCGAGAGAAGGGAGGG-3’。

2 结 果
2.14组血清IL-8、TNF-α水平比较模型组血清IL-8、TNF-α水平均明显高于正常组(P均<0.05);顺气化痰方高、低剂量组血清IL-8、TNF-α水平均明显低于模型组(P均<0.05),且高剂量组明显低于低剂量组(P均<0.05)。见表1。

表1 4组血清IL-8、TNF-α水平比较
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05;③与顺气化痰方高剂量组比较,P<0.05。
2.24组肺组织病理学表现正常组大鼠肺组织无明显炎性细胞浸润,支气管黏膜无增厚,支气管上皮纤毛排列整齐无脱落,肺泡壁无变薄破裂,未见肺大泡形成(见图1)。模型组大鼠肺组织可见慢性炎症细胞浸润,主要为巨噬细胞、淋巴细胞和单核细胞,可见支气管壁增厚,纤毛脱落,气道内可见黏液栓形成及慢性炎细胞肺浸润,可见肺泡壁破裂形成肺大泡,血管壁亦可见增厚,主要为小叶中心型肺气肿改变(见图2)。顺气化痰方高、低剂量组较模型组炎细胞浸润程度轻,肺气肿小叶破坏较少,且高剂量组较低剂量组轻(见图3及图4)。

图1 正常组肺组织病理改变(HE×200)
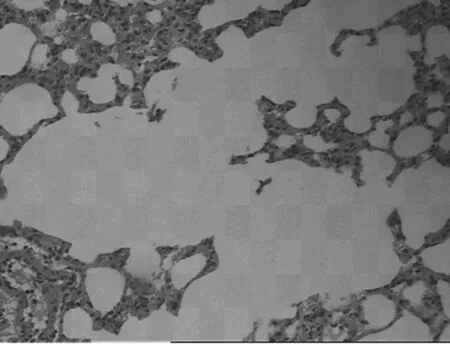
图2 模型组肺组织病理改变(HE×200)
2.34组大鼠肺组织中MMP-2、 MMP-8mRNA表达情况模型组MMP-2、 MMP-8 mRNA表达量均明显高于正常组(P均<0.05);顺气化痰方高、低剂量组MMP-2、 MMP-8 mRNA表达量均明显低于模型组(P均<0.05),且高剂量组明显低于低剂量组(P均<0.05)。见表2。
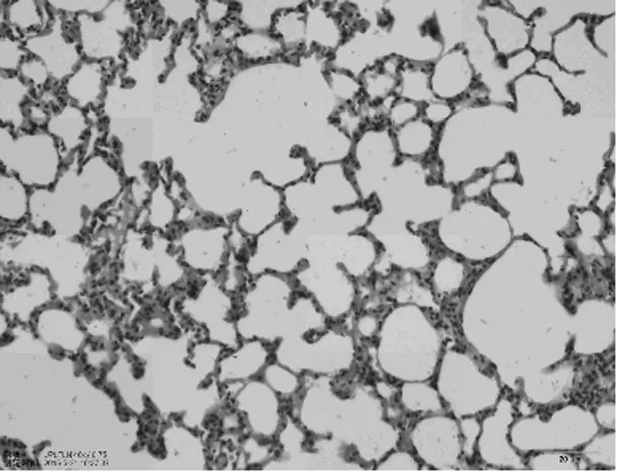
图3 顺气化痰方高剂量组肺组织病理改变(HE×200)
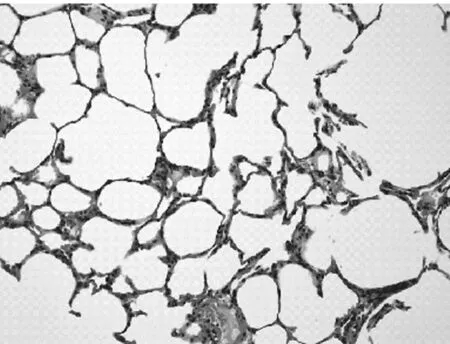
图4 顺气化痰方低剂量组肺组织病理改变(HE×200)
表2 4组大鼠肺组织中MMP-2、 MMP-8mRNA表达情况
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05;③与顺气化痰方高剂量组比较,P<0.05。
3 讨 论
关于COPD的发病机制学说,目前主要有慢性气道和肺部炎症形成、蛋白酶/抗蛋白酶失衡以及氧化剂/抗氧化剂失衡等。吸烟是引起气道慢性炎症和气道重塑发生发展的主要因素[4],多种炎症细胞及细胞因子参与COPD炎症的形成[5],导致气道壁受损和肺气肿发生,其中IL-8和TNF-α最具代表性[6]。IL-8是中性粒细胞和T淋巴细胞强效趋化因子及化学激活剂[7],在COPD气道炎症中起着直接的介导作用,可引起中性粒细胞向呼吸道迁移、活化,其水平升高可能是COPD病情迁延不愈的重要原因[8]。TNF-α可诱导气道上皮细胞和中性粒细胞表达并分泌IL-8,同时促进激活的中性粒细胞分泌IL-8、TNF-α,在COPD气道炎症的持续和放大中起到重要作用[9]。MMP在肺气肿、肺泡壁细胞外质破坏中起着重要作用。MMP是由中性粒细胞、肺泡巨噬细胞和气道上皮细胞所产生,MMP增多使气道结构组织失去支撑作用,而且还促进炎性细胞趋化、迁移、聚集及释放炎症因子和生长因子等,参与气道壁的炎症反应[10]。MMP-2、MMP-8分别属于明胶酶和胶原酶,MMP-2具有降解肺组织弹力纤维的作用,参与气道重塑,在肺气肿的发生发展中起着重要作用[11-12]。研究显示,肺组织中MMP-2表达越高,COPD患者肺功能下降越严重,气道阻塞越明显[13]。MMP-8在COPD患者的痰液、支气管肺泡灌洗液和肺组织中表达[14],与支气管肺泡灌洗液中的中性粒细胞数目成正相关[15]。
中医认为COPD患者多有痰浊阻肺,邪留肺络,宿根积久,肺气升降失常,而气逆多为痰,故治宜降气顺肺,气降则痰自清。顺气化痰方中麻黄宣散外邪,石膏辛寒清热,前胡、白前降气化痰、止咳平喘,杏仁祛痰止咳、平喘,浙贝母清热化痰、降气止咳,紫菀润肺下气、消痰止咳,冬花润肺养阴、化痰止咳,炙杷叶清肺和胃,降气化痰,甘草清热解毒、祛痰止咳。诸药合用,具有降气化痰、止咳平喘作用。本实验结果显示,顺气化痰方高、低剂量组血清IL-8、TNF-α水平和肺组织中MMP-2 mRNA、MMP-8 mRNA表达水平均明显低于模型组,且顺气化痰方高剂量组各指标水平均明显低于顺气化痰方低剂量组;HE染色显示顺气化痰方高、低剂量组肺气肿情况明显轻于模型组。提示顺气化痰方可减轻COPD大鼠肺组织病理改变,可能与减轻气道炎症有关。
[参考文献]
[1]Katdare M,Osborne MP,Telang NT. Inhibitionof aberrant proliferation and induction of apoptosis inpre-neoplastic human mammary epithelial cells by natural phytochemicals[J]. Oncol Rep,1998,5(2):311
[2]Hogg JC. Pathophysilolgy of airflow limitation in chronic obstructive pulmonary disease[J]. Lancet,2004,9435(364):709-721
[3]宋一平,崔德健,茅培英. 慢性阻塞性肺疾病大鼠模型气道重塑及生长因子的研究[J]. 中华结核和呼吸杂志,2001,24(5):283-287
[4]Churg A,Tai H,Couthard T,et al. Cigarette smoke drives small airway remodeling by induction of growth factors in the airway wall[J]. Am J Respir Crit Care Med,2006,174(12):1327-1334
[5]Vosdoganes P,Hodges RJ,Lim R,et al. Human amnion epithelial cells as a treatment for inflammation-induced fetal lung injury in sheep[J]. Am J Obstet Gynecol,2011,205(2):156
[6]Chung KF. Cytokine in chronic obstructive pulmonary disease[J]. Eur Respir J,2001,34:50s-59s
[7]SmithWB,Gamble JR,Clark-Lewis I,et al. Interleukin-8 induces neutrophil transendothelial migration[J]. Immunology,1991,72(1):65-72
[8]DeBoer WI. Cytokines and therapy in COPD:a promising combination?[J]. Chest,2002,121(3):209S-218S
[9]姚海燕,吴大玮. 慢性阻塞性肺疾病患者诱导痰IL-8、TNF-α水平和炎症细胞的分布[J]. 中国老年学杂志,2007,27(14):1366-1369
[10] 安立,张洪玉,庞宝森,等. 基质金属蛋白酶在阻塞性肺气肿大鼠模型中的表达及部分细胞因子的水平[J]. 中华内科杂志,2003,42(3):181-185
[11] 王小莉,石莺,龚兴牡. MMP-2在实验性大鼠慢性阻塞性肺疾病的表达及意义[J]. 临床肺科杂志,2010,15(5):608
[12] Baraldo S,Bazzan E,Zanin ME,et al. Matrix metalloproteinase-2 protein in lung periphery is related to COPD progression[J]. Chest,2007,132(6):1733-1740
[13] Segura-Valdez L,Pardo A,Gaxiola M,et al. Upregulation of gelatinases A and B,collagenases 1 and 2,and increased parenchymal cell death in COPD[J]. Chest,2000,117(3):684-694
[14] Zheng L,Lam WK,Tipoe GL,et al. Overexpression of matrix metalloproteinase-8 and-9 in bronchiectatic airways in vivo[J]. Eur Respir J,2002,20(1):170-176
[15] Yoshikawa T,Dent G,Ward J ,et al. Impaired neutrophil chemotaxis in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med,2007,175(5):473-479

