A型肉毒毒素单克隆抗体的制备和鉴定
吕孙慧,刘凌志,霍江,李磊,汪建华,游松,熊向华,张惟材
1.沈阳药科大学,辽宁 沈阳 110016;2.军事科学院 军事医学研究院 生物工程研究所,北京100071;3.解放军第307医院 麻醉科,北京 100071;4.哈尔滨商业大学,黑龙江 哈尔滨 150076
肉毒毒素(botulinum neurotoxin,BoNT)是由肉毒梭菌(Clostridium botulinum)产生的一种毒性极强的蛋白类神经毒素,有A~F共7种血清型,其中引起人类肉毒中毒的有A、B、E、F型,A型毒性最强且最为常见[1]。成熟的A型肉毒毒素由一条重链和一条轻链通过一对二硫键连接而成,重链C端与神经肌肉接头处神经细胞膜上的受体结合,是理想的保护性抗原,重链N端则负责将轻链转运至神经细胞[2];轻链是依赖Zn2+的蛋白酶[3],切割SNARE复合物中的SNAP25蛋白,使突触小泡与细胞膜无法融合,从而导致神经递质不能释放到神经肌肉接头的细胞缝隙,引起肌肉麻痹[4]。
目前治疗A型肉毒中毒没有有效的小分子化学药物,临床上使用马血清,但马血清存在病毒污染、过敏反应等风险,以及制备成本高、生产期长、稳定性差等问题。单克隆抗体是取代马血清的更理想的临床药物,而现有研究结果表明单个抗体难以起到理想的中和效果,多个抗体联用的效果远大于单个抗体效果的加和[5]。我们以A型肉毒毒素重链C端(heavy chain carboxy terminal of BoNT serotype A,BoNT/AHc)为抗原免疫小鼠,通过杂交瘤技术得到3株亲和力高、特异性强的单抗,为A型肉毒毒素的抗体药物研发,以及建立快速有效的肉毒毒素检测方法奠定了基础。
1 材料与方法
1.1 材料
BALB/c小鼠(军事医学研究院实验动物中心);Sp2/0骨髓瘤细胞(陈薇研究员实验室惠赠);完全弗氏佐剂、不完全弗氏佐剂(Sigma公司);抗体分型试剂盒(北京博奥龙免疫技术公司);Protein-G亲和层析柱(GE公司);HRP标记的羊抗鼠IgG(Thermo公司);96孔酶标板(NEST公司);PVDF膜(Millipore公司);SDS-PAGE样品缓冲液(生工技术公司)。
1.2 小鼠免疫
选取雌性BALB/c小鼠(6~8周龄),将50 μg抗原BoNT-AHc与完全弗氏佐剂混匀,采用皮下多点注射的方式进行首次免疫;第21 d以相同剂量的BoNT-AHc与不完全弗氏佐剂混匀,以相同注射方式进行第2次免疫;第42 d不加佐剂,用相同剂量进行腹腔注射完成第3次免疫;第56 d以500 μg采用腹腔注射进行强化免疫;第59 d取脾脏进行融合。
1.3 细胞融合
强化免疫后3 d,将小鼠断颈处死,用75%酒精消毒,在无菌状态下将分离脾细胞的和Sp2/0骨髓瘤细胞按5∶1混合,采用PEG法[6]进行细胞融合,用含20%小牛血清的HAT选择培养液重悬细胞浓度为1×106/mL,每孔100 μL加至96孔细胞培养板中,置37℃、5%CO2培养箱中培养。
1.4 筛选阳性克隆及克隆化培养
选用HAT培养基培养融合细胞,7~10 d后换成HT培养液,培养2周后改用一般培养液。当杂交瘤细胞布满孔底1/10面积时,即可用ELISA法检测特异性抗体,筛选出所需杂交瘤细胞系。在选择培养期间,一般每2~3 d换一半培养液。
采用有限稀释法将阳性孔进行克隆化培养,在克隆前1 d制备饲养细胞层。将筛选出的杂交瘤细胞计数,用培养液重悬细胞至3~10/mL,每孔100 μL加入提前制备的饲养细胞层培养板中,置37℃、5%CO2培养箱中培养,第7 d开始换液,以后每2~3 d换一次液,8~9 d可见细胞克隆形成,检测细胞上清中抗体活性,将筛选出的阳性克隆株移至24孔板中扩大培养后冻存,同时测定细胞上清的效价。
1.5 抗体制备
每只小鼠腹腔注射0.5 mL液体石蜡,2周后取1×106杂交瘤细胞腹腔注射,接种细胞10 d后收集腹水,经饱和硫酸铵盐析后用Protein-G亲和层析柱纯化。
1.6 抗体分型
取纯化的抗体稀释至1/1000,用抗体分型试剂盒鉴定鼠单抗亚类。
1.7 抗体纯度测定
采用SDS-PAGE测定抗体的纯度,取5 μg单抗加入2 μL上样缓冲液和5 μL 1 mol/L的DTT,室温放置30 min后煮沸5 min,进行胶浓度为12.5%的SDS-PAGE,扫描后用软件Gelpro32分析计算抗体的纯度。
1.8 抗体特异性结合鉴定
采用Western印迹。取5 μL BoNT/AHc抗原,进行胶浓度为12.5%的SDS-PAGE,半干法将蛋白转移到PVDF膜,用5%脱脂奶粉室温封闭2 h,加入鼠单抗室温孵育1 h,用PBST洗3次,每次5 min,加入HRP标记的羊抗鼠IgG室温孵育1 h,加入化学发光试剂,于化学发光分析仪中显影并记录。
1.9 抗体亲和力常数测定
采用非竞争ELISA法测定抗原抗体结合的亲和力常数。分别测定4个BoNT/AHc抗原浓度(20、10、5、2.5 μg/mL)与抗体的结合反应曲线,抗体取12个浓度(80、40、20、10、5、2.5、1.25、0.625、0.3125、0.1562、0.7812、0.039 μg/mL)。用SPSS软件进行曲线拟合后得出每个抗原浓度对应的最大D450nm值的一半时抗体的浓度。采用赵巧林报道的方法[7]计算抗体1B1、1B2、1C6的亲和力常数。
1.10 单抗与抗原识别位点分析
采用叠加ELISA法计算抗体两两之间的叠加率AI。1 μg/mL的BoNT/AHc抗原于96孔酶标板中4℃包被过夜,阴性对照孔包被1 μg/mL牛血清白蛋白(BSA),空白对照孔不包被底物。用5%脱脂奶粉于37℃封闭2 h,加入单抗1,37℃孵育1 h,加入单抗2,37℃孵育1 h,PBST洗5次后加入稀释至1/2000的HRP标记的羊抗鼠IgG,37℃孵育1 h,PBST洗5次后加入TMB显色液显色10 min,每孔加50 μL 2 mol/L的浓硫酸终止显色,酶标仪测定D450nm值。用下式计算叠加率AI:
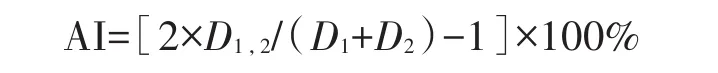
式中D1、D2、D1,2分别为单抗1、单抗2、单抗1叠加单抗2的D450nm值。若AI大于40%,即可认为这2株单抗识别位点不同;若AI小于40%,则可认为这2株单抗识别位点相同或相近。
2 结果
2.1 单克隆抗体筛选
BALB/c小鼠经免疫后,取脾细胞和Sp2/0骨髓瘤细胞融合,通过有限稀释法进行2次克隆化,得到3株稳定表达抗体的阳性单克隆细胞株1B1、1B2、1C6,培养上清效价分别为1.2×105、4.1× 106和1.2×105。
2.2 抗体的制备
筛选到的3株阳性单克隆细胞株1B1、1B2、1C6经培养后注射到小鼠腹腔中制备腹水,通过硫酸铵盐析和Protein-G亲和层析纯化,纯化抗体经SDS-PAGE后采用Gelpro32软件计算纯度,分别为93.6%、98.4%、94.2%。
2.3 抗体分型
取纯化后的抗体稀释至1/1000,用试剂盒进行亚型鉴定,结果表明3株抗体重链均为IgG1,轻链均为κ型,是鼠源抗体重链和轻链最为常见的亚型。
2.4 抗体特异性结合鉴定
以BoNT/AHc为抗原,抗体1B1、1B2、1C6为一抗,HRP标记的羊抗鼠IgG为二抗进行Western印迹,结果显示单抗1B1、1B2、1C6与BoNT/AHc抗原均有特异性结合,表明3株抗体与抗原结合表位均为线性表位。
2.5 抗体亲和力常数
通过非竞争ELISA法测定4个浓度的BoNTAHc抗原与抗体的结合反应曲线,经SPSS软件拟合后计算出1B1、1B2、1C6的亲和力常数分别为1.43×108、2.31×108和1.44×109L/mol。3株抗体与抗原结合的亲和力常数均高达108L/mol以上,可见3株抗体与抗原都有很强的结合能力。
2.6 单抗与抗原识别位点分析
采用叠加ELISA法计算抗体两两之间的叠加率AI,结果显示3株抗体两两配对的AI值均小于40%,说明这3株单抗识别的位点相同或相近。

图1 SDS-PAGE分析抗体纯度M:蛋白marker;1:纯化后的抗体1B1;2:纯化后的抗体1B2;3:纯化后的抗体1C6

图2 Western印迹检测鼠单抗与BoNT/AHc的特异性结合

表1 3株鼠单抗抗体分组结果
3 讨论
相对全长肉毒毒素而言,BoNT/AHc是肉毒毒素与受体结合的区域,免疫动物后可以产生保护性免疫反应,且没有轻链的内切酶活性带来的毒性,是更理想的保护性抗原。文献报道也显示以BoNT/AHc作为抗原免疫小鼠获得具有中和活性的抗体的可能性高于以类毒素作为抗原的传统方法[8]。通过杂交瘤技术得到的鼠源单克隆抗体亲和力高、特异性强、性质均一、易于大量生产,在医学实践及生命科学研究中应用广泛。因而本次研究采用BoNT/AHc为抗原,通过杂交瘤单克隆抗体技术制备抗体,最终获得了亲和力高、特异性强的3株鼠单抗。后续研究一方面将测定3株抗体的中和活性以探讨其成为A型肉毒中毒治疗药物的可能性,另一方面尝试建立基于这3株抗体的A型肉毒毒素检测方法(夹心ELISA或胶体金等)。
本研究得到的3株抗体与抗原结合表位相同或相近,而之前实验室制备得到的4株抗BoNT/ AHc单抗与抗原也有相同或相近的结合表位[9],Onda等报道同样显示其筛选得到针对PE的60株鼠单抗抗原识别位点仅分布在7个表位组中[10],由此可见通过杂交瘤技术制备鼠单抗时存在抗原优势表位。若其优势表位同时也是抗原与受体结合的关键表位,则有利于中和抗体制备;若优势表位和抗原与受体结合的关键表位不一致,则会加大中和抗体的筛选难度。如果是前者,可以考虑将筛选得到的针对不同表位的中和抗体联合使用以增强中和活性。Hayashi等研究表明,将BoNT/AHc作为抗原得到的针对不同表位的3株单抗联用,抗体效价能达到传统抗血清的500倍[11],可见抗体联用可以很好地增强中和活性。
[1] 赵鹏,胡颖,安佳佳,等.A型肉毒神经毒素轻链人源性抗体的筛选、表达与检测[J].军事医学,2016,40(5): 396-400.
[2] Wang H,Li T,Shi J,et al.A new neutralizing anti⁃bodyagainstbotulinum neurotoxin B recognizesthe protein receptorbinding sites forsynaptotagmins II [J].Microbes Infect,2010,12(12-13):1012-1018.
[3] Gray S A,Barr J R,Kalb S R,et al.Synergistic cap⁃ture of Clostridium botulinum type A neurotoxin by scFv antibodies to novel epitopes[J].Biotechnol Bio⁃eng,2011,108(10):2456-2467.
[4] 刘志佳,李永明,宋朝君,等.一种检测A型肉毒毒素的高灵敏度酶联免疫吸附法[J].细胞与分子免疫学杂志,2012,28(5):546-548.
[5] Shone C,Agostini H J.Bivalent recombinant vaccine for botulinum neurotoxin types A and B based on a polypeptide comprising their effector and translocation domains that is protective against the predominant A and B subtypes.[J].InfectImmun,2009,77(7):2795-2801.
[6] Bigbee W L,Vanderlaan M,Fong S S N,et al.Mono⁃clonal antibodies specific for the M-and N-forms of human glycophorin A[J].Mol Immunol,1983,20(12): 1353-1362.
[7] 赵巧林.A型肉毒毒素抗原表位及抗体研究[D].北京:军事医学科学院,2016.
[8] Baldwin M R,Tepp W H,Przedpelski A,et al.Sub⁃unit vaccine against the seven serotypes of Botulism [J].Infect Immun,2008,76(3):1314-1318.
[9] 赵巧林,陆璐,毕波,等.抗A型肉毒毒素鼠源性单克隆抗体的制备和鉴定[J].军事医学,2016,40(4):322-325.
[10]Onda M,Beers R,Xiang L,et al.Recombinant immu⁃notoxin against B-cell malignancies with no immunoge⁃nicity in mice by removal of B-cell epitopes[J].Proc Natl Acad Sci USA,2011,108(14):5742-5747.
[11]HayashiK,Kojima C.Efficientprotein production method for NMR using soluble protein tags with cold shock expression vector[J].J Biomol NMR,2010,48(3): 147-155.

