补气益精生血法治疗β地中海贫血的疗效及对红系反式作用因子的影响*
★张春红 卢焯明 杜广亮(.广州市中医医院 广州 5030;.广州爱博恩妇产医院 广州 5030)
地中海贫血是一种遗传性溶血性贫血,由于珠蛋白基因的缺陷,使一种或几种珠蛋白肽链合成减少或缺乏,导致血红蛋白的构成成分改变。地中海贫血在我国南方各省比较常见,严重威胁儿童、青少年健康。其治疗主要包括输血、铁螯合剂、造血干细胞移以及基因治疗等。但是前两种治疗手段存在着内皮损伤、传染病暴露等毒副作用,造血干细胞移植因干细胞来源的稀缺及费用问题,难以广泛开展。目前,珠蛋白基因诱导成为β地中海贫血的可行治疗手段,以羟基脲为代表的各种诱导西药有一定疗效,但由于该方法存在着骨髓抑制、免疫抑制等风险,使其不能在临床上广泛使用。本课题组既往的研究采用补气益精生血中药方治疗β地贫,取得了良好疗效[1-2],但具体分子机制仍在探讨中。目前认为,基因治疗可激活γ珠蛋白基因,增加γ珠蛋白的表达,其靶点可能是关键红系反式作用因子BCL11A及其它相关红系转录因子[3]。本研究运用补气益精生血法治疗β地贫患儿,检测血液学指标以观察疗效,并与羟基脲进行随机双盲对照,对用药后体内红系反式作用因子BCL11A及其它相关红系转录因子如SOX6等的蛋白水平进行分析,从而探讨中药起效的分子机制。
1 资料与方法
1.1研究对象 本研究得到医院伦理委员会批准,纳入2016年1月—2017年6月在广州市中医医院就诊的β地贫患儿38例。患者本人或监护人知情同意。
诊断标准:根据《血液病诊断及疗效标准》(科学出版社2007年版)中对β-珠蛋白生成障碍性贫血(β地中海贫血)的诊断标准,选择中间型地贫患者。中医辨证参照《中医诊断学》《中医证候鉴别诊断学》和《中药新药临床研究指导原则》,证属肾精亏虚、气血不足者。
纳入标准:(1)年龄:2~18岁;(2)基因检查已确诊β地中海贫血,符合上述中间型β地贫诊断标准以及中医辨证标准;(3)Hb≥60g/L;
排除标准:(1)有免疫缺陷,心脏疾病、内分泌系统及血液系统其它疾病者;(2)患者12周内有输血或服用其他抗贫血中西药物者;(3)既往有多种药物过敏者;(4)既往对药物治疗依从性差者。
纳入研究的患儿使用SPSS随机数字生成器按1∶1分别进入中药观察组及西药对照组。其中中药组19例、对照组19例(研究过程中对照组脱落1例)。两组患儿年龄、性别及 Hb水平无明显差异(P>0.05),见表1。
表1 两组一般资料比较(,n=19)例
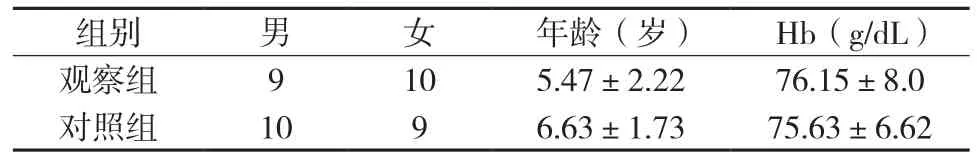
表1 两组一般资料比较(,n=19)例
注:表中两组年龄的比较,t=1.79,P>0.05。Hb的比较,t=0.21,P>0.05。
组别男女年龄(岁)Hb(g/dL)观察组9105.47±2.2276.15±8.0对照组1096.63±1.7375.63±6.62
1.2研究方法
1.2.1本研究采用双盲双模拟法 观察组予补气益精生血方口服,方药组成:黄芪、龟板、党参、当归,采用中药配方颗粒剂型(广东一方制药有限公司生产,许可证号:粵20110214),1袋均相当于各自饮片10g的水提取物。用法与用量:2~6岁患儿以上四种颗粒每次各1袋,6~12岁患儿每次各2袋,12~18岁患儿每次各3袋,均每日1次,混合后冲服,连续每日用药。同时加用西药安慰剂,用法参照西药对照组中羟基脲片的用法。
西药对照组采用口服羟基脲治疗,齐鲁制药有限公司生产(国药准字H37021289),用法用量:10mg/kg/d,每周连用4d,停药3d。同时加用中药安慰剂,用法用量参照中药观察组。两组药物使用的外包装相同,疗程12周。
1.2.2中止和撤出研究标准 (1)研究期间出现Hb<50g/L者;(2)不能坚持治疗,或者研究期间使用其它可能影响血液系统的药物者;(3)出现严重不良事件或不良反应者或者安全性指标明显超出参考值范围者,或者出现严重地贫并发症者;(4)对治疗药物过敏者。对于以上(1)者予以输血,其他情况者给予相应处理。
1.3观察指标
1.3.1血液学指标 治疗前及治疗开始后的第4周、8周、12周,分别取患儿末梢血以检测血常规,观察血红蛋白(Hb)、红细胞总数(RBC)、红细胞平均体积(MCV)、平均血红蛋白含量(MCH);治疗前及治疗12周后分别取患儿静脉血以手工计数法进行网织红细胞计数(Ret);采用碱性血红蛋白电泳法检测HbF比例。
1.3.2安全性指标 同上检测血常规方法,观察白细胞总数(WBC)、中性粒细胞总数(NEU)、血小板总数(PLT);治疗前及治疗12周后分别取患儿静脉血进行肝、肾功能测定,观察血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、谷氨酸酰基转移酶(GGT)、血清尿素氮(BUN)、肌酐(Cr)。
1.3.3反式作用因子蛋白水平 以Western Blot检测BCL11A、SOX6、Myb、KLF1蛋白水平:在治疗前及治疗满12周后,两组参与研究的患儿各抽取外周血4ml,采用不连续密度梯度离心法分离包含有核红细胞在内的单个核细胞(mononuclearcells,MNCs)。以PBS洗涤,提取MNCs细胞总蛋白并以BCA法定量。SDS-PAGE分离蛋白,蛋白质转膜,各蛋白的单克隆抗体一抗、二抗分别先后与蛋白质杂交,以β-actin为内参照,使用超敏ECL化学发光试剂盒发光并曝光,通过图像分析软件分析目的蛋白条带的与内参照条带的积分光密度值(integrated optical density,IOD)比值。
1.4统计学处理 数据录入 SPSS 13.0 软件进行统计,计量资料属正态分布以表示,同组治疗前后差异采用重复测量数据方差分析及配对t检验,组间差异采用成组t检验及协方差分析。
2 结果
2.1两组血常规指标变化的比较 两组在不同治疗时点Hb的变化,均有统计学意义,两组治疗后Hb相比,没有明显差异。观察组在不同治疗时点RBC的变化,有统计学意义。见表2。
2.2两组治疗前后HbF比例、Ret变化的比较 治疗前后自身比较,两组HbF变化均有统计学意义。观察组治疗后Ret明显上升,对照组治疗后Ret明显下降。见表3。
表2 两组治疗前后血常规指标变化的比较()例
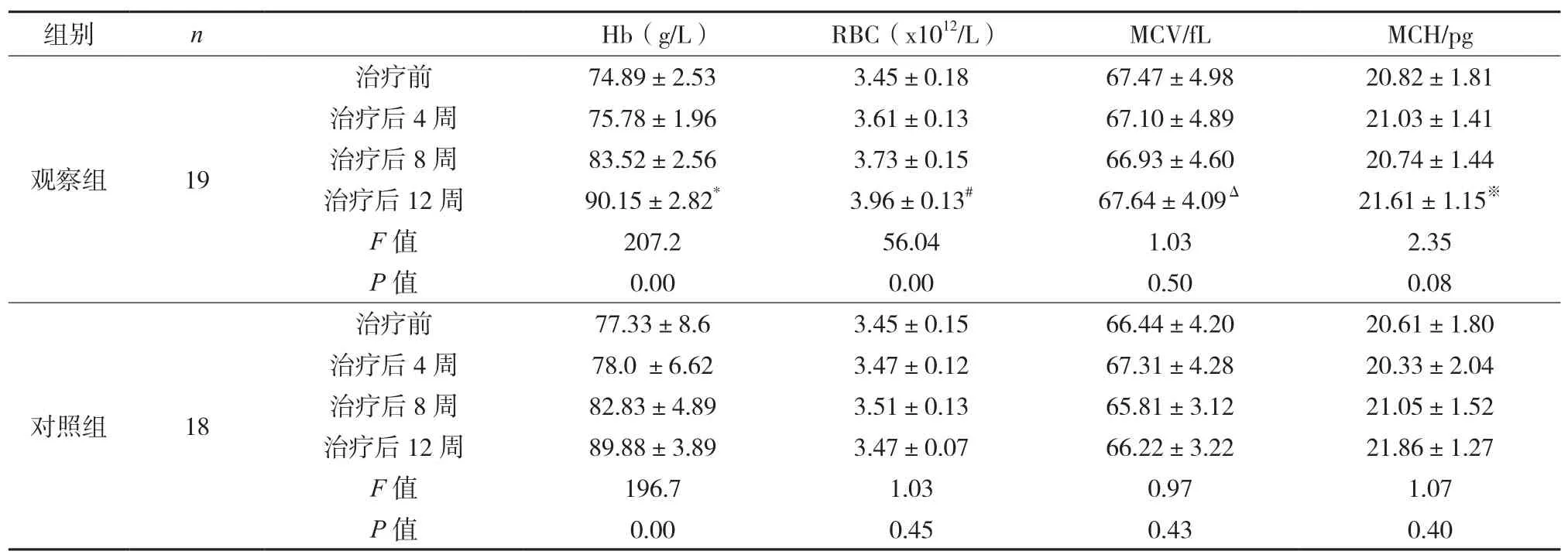
表2 两组治疗前后血常规指标变化的比较()例
注:治疗12周后,两组RBC的比较,t=14.37,#P<0.05;两组 Hb的比较,t=0.25,*P>0.05;两组MCV的比较,t=0.79,ΔP>0.05;两组MCH的比较,t=0.53,※P>0.05。
组别nHb(g/L)RBC(x1012/L)MCV/fLMCH/pg观察组19治疗前74.89±2.533.45±0.1867.47±4.9820.82±1.81治疗后4周75.78±1.963.61±0.1367.10±4.8921.03±1.41治疗后8周83.52±2.563.73±0.1566.93±4.6020.74±1.44治疗后12周90.15±2.82*3.96±0.13#67.64±4.09Δ21.61±1.15※F值207.256.041.032.35 P值0.000.000.500.08治疗前77.33±8.63.45±0.1566.44±4.2020.61±1.80治疗后4周78.0 ±6.623.47±0.1267.31±4.2820.33±2.04治疗后8周82.83±4.893.51±0.1365.81±3.1221.05±1.52治疗后12周89.88±3.893.47±0.0766.22±3.2221.86±1.27 F值196.71.030.971.07 P值0.000.450.430.40对照组18
表3 两组治疗前后HbF比例、Ret变化的比较()例
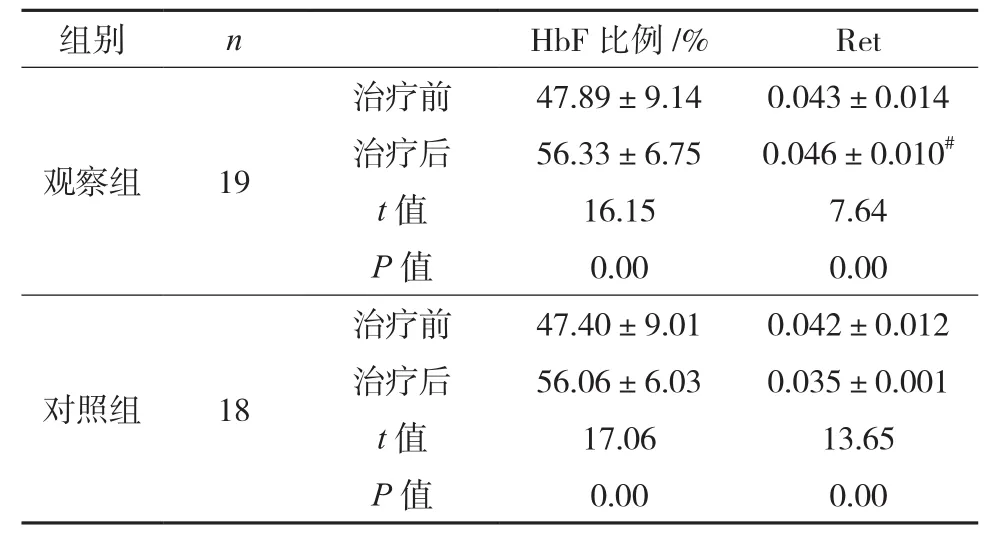
表3 两组治疗前后HbF比例、Ret变化的比较()例
注:治疗前,两组HbF比例、Ret的比较,无统计学意义,P>0.05;治疗后两组HbF比例的比较,t=0.12,P>0.05,治疗后两组Ret的比较,t=4.76,#P<0.05。
治疗前47.40±9.010.042±0.012治疗后56.06±6.030.035±0.001 t值17.0613.65 P值0.000.00对照组18
2.3两组治疗前后WBC、NEU、PLT变化比较 观察组治疗前后 WBC、NEU、PLT均无明显变化,对照组治疗后WBC、NEU明显降低,差异有统计学意义。见表4。
表4 两组治疗前后WBC、NEU、PLT变化比较()109/L 例

表4 两组治疗前后WBC、NEU、PLT变化比较()109/L 例
注:治疗前,两组WBC、NEU、PLT的比较,差异无统计学意义,P>0.05;与治疗前相比,观察组治疗前后WBC、NEU、PLT均无明显变化,P>0.05;对照组WBC、NEU明显降低,差异有统计学意义,*P<0.05;治疗后,两组WBC的比较,t=7.12,#P<0.05;两组NEU的比较,t=13.03,#P<0.05,两组PLT的比较,t=0.41,P>0.05。
组别nWBC NEUPLT观察组19治疗前7.97±0.583.85±0.62251.33±65.07治疗后7.92±0.74#3.71±0.49#250.66±46.26 t值0.180.440.32 P值0.850.650.74治疗前7.85±0.843.70±0.63254.31±31.06治疗后5.54±1.22*1.91±0.33*255.36±17.65 t值19.0020.120.12 P值0.000.000.90对照组18
2.4两组红系反式作用因子蛋白水平变化比较 治疗后,观察组BCL11A、SOX6、 Myb水平明显下降,KLF1无变化。对照组治疗前后BCL11A、SOX6、Myb、KLF1水平均无变化。见表5。
表5 两组红系反式作用因子蛋白水平变化比较()
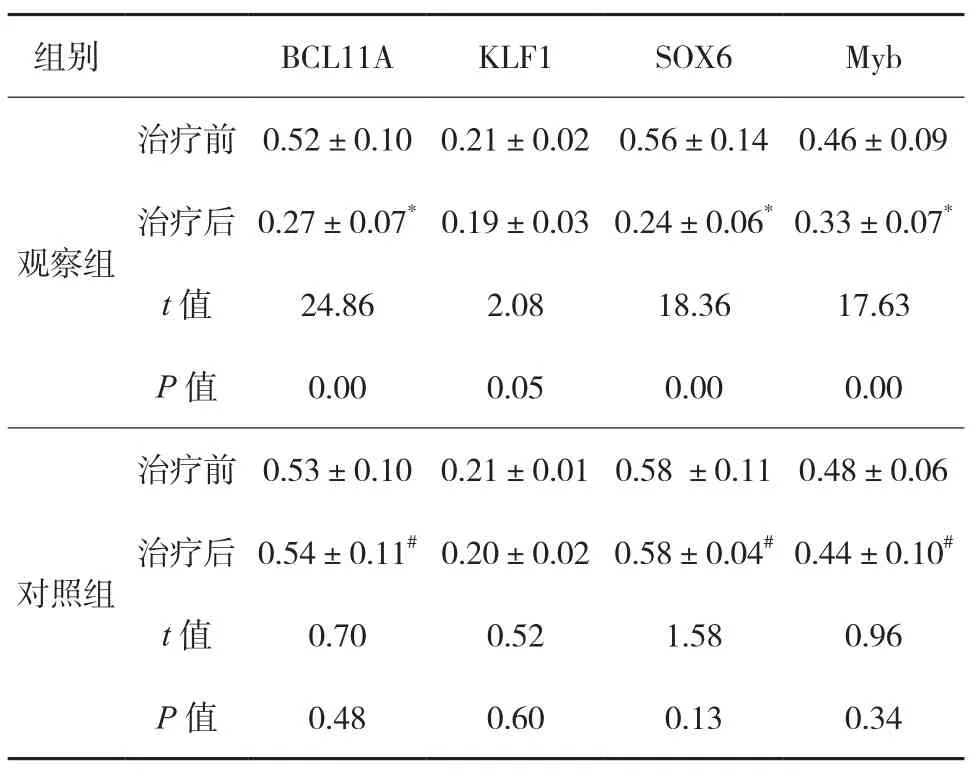
表5 两组红系反式作用因子蛋白水平变化比较()
注:治疗前,两组BCL11A、 KLF1 、SOX6、Myb的比较,差异无统计学意义,P>0.05;与治疗前相比,观察组治疗后的BCL11A、SOX6、Myb明显下降,差异有统计学意义,*P<0.05;KLF1无明显变化,P>0.05;对照组治疗前后BCL11A、SOX6、Myb、KLF1水平均无明显变化,P>0.05;治疗后,两组BCL11A的比较,t=8.95,#P<0.05;SOX6的比较,t=20.16,#P<0.05;Myb的比较,t=3.89,#P<0.05,KLF1的比较,t=1.18,P>0.05。
组别BCL11AKLF1SOX6Myb观察组治疗前0.52±0.100.21±0.020.56±0.140.46±0.09治疗后0.27±0.07*0.19±0.03 0.24±0.06*0.33±0.07*t值24.862.0818.3617.63 P值0.000.050.000.00治疗前0.53±0.100.21±0.01 0.58 ±0.110.48±0.06治疗后0.54±0.11#0.20±0.02 0.58±0.04#0.44±0.10#t值0.700.521.580.96 P值0.480.600.130.34对照组
2.5两组治疗前后肝肾功能(AST、ALT、GGT、BUN、Cr)的比较 见表6。
表6 两组治疗前后肝肾功能变化的比较()例

表6 两组治疗前后肝肾功能变化的比较()例
注:两组肝肾功能未见异常,治疗前后两组肝肾功能的比较,差异无统计学意义,P>0.05。
组别nAST(U/L)ALT(U/L)GGT(U/L)BUN(mmol/L)Cr(umol/L)观察组19治疗前31.89±2.1530.42±12.3625.78±12.015.32±1.6442.50±10.44治疗后30.35±3.4631.65±11.6326.74±10.366.28±1.3844.64±9.06对照组18治疗前31.44±2.4730.55±10.9828.33±12.264.93±1.5243.31±9.76治疗后31.56±2.8731.49±11.4327.62±11.235.86±1.3245.76±11.32
3 讨论
地中海贫血是一种基因遗传病,在中医典籍中无明确记载,本课题组通过对其中医证候规律的研究,拟定了补气益精生血法为地中海贫血的主要中医治法。既往临床研究[1]证明,采用补气益精生血法治疗小儿β地贫,观察组患儿的Hb及HbF水平有显著提高,同时可以改善其他血液学指标及中医临床症状,疗效优于对照组且较安全。国内多个研究[4-5]也将黄芪、党参、当归、山茱萸、何首乌等补肾、益气、生血的中药作为治疗小儿β地贫的主要药物,能显著提高β地贫患儿Hb及HbF水平,改善贫血症状。本研究采用补气益精生血治法与西药羟基脲进行对照,疗程3个月,对比了治疗前后患儿的血液学指标。结果发现,治疗后两组患儿的Hb及HbF显著上升,两组相比无明显差异,观察组RBC、Ret水平显著上升,而对照组RBC水平无明显变化,Ret水平下降,这可能与羟基脲片本身的骨髓抑制有关。安全性方面,观察组治疗前后的WBC、NEU、PLT水平无明显变化,对照组治疗后WBC、NEU显著降低,提示中药观察组在减轻免疫抑制方面有优势。两组患儿治疗前后肝肾功能均未见异常。
珠蛋白基因诱导是近年来治疗β地贫的新方向,正常情况下,γ珠蛋白基因在出生后近乎关闭,但可以通过药物进行诱导,使其重新激活表达,以增加胎儿血红蛋白(fetal hemoglobin,HbF)含量,HbF含量的增加可以在功能上代偿正常血红蛋白的不足,改善组织供氧、缓解临床症状。有研究发现[6],通过小干扰技术使BCL11A 基因表达沉默后,细胞内γ珠蛋白基因的mRNA水平较未沉默细胞明显升高,提示BCL11A 基因对γ珠蛋白基因表达可能存在负调控作用。聂伟业等[7]采用siRNA阻断BCL11A基因,结果显示可以诱导β地贫患者红系细胞γ珠蛋白基因的表达,显著增加HbF含量。其原理可能是BCL11A 基因可以特异性地直接调控γ珠蛋白基因表达,对HbF成具有直接作用,同时不影响其他红系转录因子如GATA -1、NF-E2和EKLF的表达[8-9]。其他红系转录因子,如AKT、SOX6、Myb等,相关动物试验也提示与HbF的表达高度相关[10]。Myb是一种原癌基因,可以通过调控靶基因的转录实现自身功能,对造血细胞的分化、增殖和凋亡均有重要作用。对地中海贫血患者的研究发现,在HbF含量增多的同时,出现了HBS1L和cMyb两种基因表达减少,体外实验也表明,cMyb可以影响γ-球蛋白基因表达,低表达的Myb能加速红细胞成熟[11]。目前一些研究[12-13]提示,在β-地贫和一些血红蛋白病的治疗中,某些特异性的miRs通过调控KLF1、BCL11A和Myb等HbF相关的转录因子,能激活γ珠蛋白基因,诱导重新表达,从而在转录后水平上对患者的血红蛋白种类和含量进行调节。因此,珠蛋白基因诱导的原理可能是通过减少BCL11A及相关转录因子的基因表达或抑制其蛋白活性,实现激活γ珠蛋白表达,增加HbF含量的目的。
本研究采用补气益精生血法治疗β地贫,初步探讨了中药诱导γ珠蛋白基因表达合成HbF的分子机制。笔者采用west-ern blot方法,检测用药前后患儿BCL11A、KLF1、SOX6、Myb蛋白水平,结果提示中药可显著抑制BCL11A、SOX6、Myb蛋白水平。据此推测,中药治疗β地贫的分子机制是通过抑制红系反式作用因子BCL11A及相关红系转录因子SOX6、Myb的蛋白表达水平,激活γ-珠蛋白基因表达,从而增加HbF含量。中药组对KLF1蛋白水平无明显影响。KLF1与红系分化过程密切相关,它通过结合β-珠蛋白启动因子,促进β-珠蛋白的表达以及γ-向β-珠蛋白基因的转换和红系分化。其作用机制与直接激活β珠蛋白基因、间接抑制γ珠蛋白基因表达有关[14],而β地贫患儿由于β珠蛋白基因缺陷,对KLF1无法产生应答,因此,在珠蛋白诱导治疗中,KLF1蛋白水平无明显变化。本次研究中,对照组对红系反式作用因子的蛋白水平无显著影响,还需后期加大样本量进行深入研究。
通过本次研究,笔者进一步证实了补气益精生血法治疗β地贫,能够显著提高患儿Hb及HbF水平,改善贫血症状,达到与对照组羟基脲相近的效果,且副作用较少,对于我国南方等地贫高发区具有较大的实用价值及广阔的应用前景。通过检测红系反式作用因子的蛋白表达水平,初步探讨了中药诱导γ珠蛋白基因表达合成HbF的分子机制,随着临床应用的开展,后续将在分子生物学机制上进行更加深入的研究。
[1]卢焯明,钱新华,陈致雯,等.黄芪及其复方中药治疗小儿β地中海贫血的前瞻性临床研究[J].中国当代儿科杂志, 2012, 14(5):344-349.
[2]卢焯明,钱新华,张春红,等.补气益精生血方药治疗儿童β地中海贫血随机对照研究[J].中国中医药信息杂志, 2015, 22(12):9-13.
[3]Peralta R, Low A, Kim A, et al. Targeting BCL11A and KLF1 for the treatment of sickle cell disease and β-Thalassemia in vitro using antisense oligonucleotides[J]. Blood, 2013, 122(21):1 022.
[4]刘咏梅,吴志奎,柴立民,等.中药益髓生血颗粒对地中海贫血患者骨髓血红蛋白稳定蛋白及红系转录因子GATA 1基因表达的影响[J].中西医结合学报, 2006, 4(3):247-250.
[5]王卉.补肾益髓法治疗β-珠蛋白生成障碍性贫血患儿的效果及对抗氧化基因表达的影响[J].临床和实验医学杂志, 2016, 15(4):352-356.
[6]孙顺昌,周指明,涂传清,等. BCL11A基因对γ-珠蛋白基因转录的影响[J].中国实验血液学杂志, 2013, 21(3):628-632.
[7]聂伟业,林万华,罗瑞贵,等. siRNA 抑制 BCL11A 表达对重型地中海贫血患者红系细胞γ-珠蛋白表达的影响[J].华南国防医学杂志, 2014, 24(8):6-9.
[8]SANKA R AN V G, XU J, BY R ON R, et al. A functional element necessary for fetal hemoglobin silencing[J]. N Engl J Med, 2011, 365(9):807-814.
[9]SANKA R AN V G, MENE T F, XU J, et al. Human fetal hemo-globin expressionis regulated by the developmental stage -specific repressor BCL11A[J]. Science, 2008, 322 (5909):1 839-1 842.
[10]Rahim F, Allahmoradi H, Salari F, et al. Evaluation of Signaling Pathways Involved in γ-Globin Gene Induction Using Fetal Hemoglo-bin Inducer Drugs[J]. IntJ Hematol Oncol Stem Cell Res, 2013, 7(3):41-46.
[11]Jiang J, Best S, Menzel S, et al. cMYB is involved in the regulation of fetal hemoglobin production in adults[J]. Blood, 2006, 108(3):1 077-1 083.
[12]Guda S, Brendel C, Renella R, et al.miRNA-embedded shRNAs for lineage-specific BCL11A knockdown and he-moglobin F induction[J].Mol Ther, 2015, 23(9):1 465-1 474.
[13]Pule GD, Mowla S, Novitzky, et al. Hydroxyurea down-regulates BCL11A, KLF-1and MYB through miRNA-mediated actions to induce γ-globin expression:implications for new therapeutic approaches of sickle cell disease[J]. Clin Transl Med, 2016, 5(1):15.
[14]ZHOU D, LIU K, SUN C W, et al. KLF1 regulates BCL11A ex-pression and gamma-to beta-globin gene switching[J]. Nat Genet, 2010,42(9):742-744.

