沙利度胺对重型β地中海贫血患者红系细胞γ珠蛋白基因表达及分化的作用研究*
黄婉雪,杨 阳,汪晓辉,赖永榕
(广西医科大学第一附属医院,南宁 530021)
地中海贫血(地贫) 是由于遗传基因缺失或突变所致的慢性溶血性贫血。我国的广西、广东、海南、贵州、云南等省是地贫高发区[1]。正常情况下,成人的Hb 基本成分血红蛋白A(HbA)由两条α 珠蛋白与两条β珠蛋白链组成。在β地贫中,由于β珠蛋白链合成减少或缺失,过量的α 珠蛋白链沉淀在红细胞中,导致红细胞机械和氧化损伤。临床上表现为溶血性贫血、铁过载及氧化应激[2]。减少红细胞中过量的α 珠蛋白链可以改善其过量带来的影响。研究发现,诱导γ 珠蛋白生产可使其结合过多的α珠蛋白[3],形成胎儿血红蛋白(HbF),可以减轻β地贫的临床症状[3-4]。最初,研究人员发现5-氮胞苷[5-6]、羟基脲[7]等药物可以提升人体内HbF 水平,但其毒副作用限制了临床使用[8]。近年来研究发现,沙利度胺能提升HbF 从而有效改善中间型或重型β地贫患者的贫血情况[9-11]。临床研究发现,沙利度胺可以减轻β 地贫输血依赖患者的输血量要求,提升非输血依赖患者的血红蛋白水平[9]。同时,可以减轻脾功能亢进引起的血小板减少带来的临床症状[12]。赖永榕课题组在研究中发现,沙利度胺可以诱导正常成人体外培养的红系细胞γ 珠蛋白的升高,转录因子BCL11A、KFL1 可能参与其中的调控[13]。然而,关于沙利度胺提升重型β 地贫患者红系细胞γ珠蛋白的研究较少。本研究探索沙利度胺对体外培养的重型β 地中海贫血患者人红系细胞γ珠蛋白基因(HBG)的诱导作用、患者红系细胞分化及参与调控的BCL11A、KFL1等转录因子的表达情况。
1 材料与方法
1.1 主要试剂与材料 CD34+磁珠(Miltenyi Biotec公司,批号:130-046-702);羟基脲(Sigma 公司,批号:MKBR1926 V);沙利度胺(TCI公司,批号:NQ4XL-PJ);逆转录试剂盒(TaKaRa 公司,批号:AI40713A);FastStart Univernal SYBR Green Master(ROX) (Roche 公司,批号:31598800) ;Trizol 试剂(LIFE 公司,批号:162905);RIPA 裂解液(碧云天,批号:P0013B);PMSF(索莱宝,批号:20170614);BSA[生工生物工程(上海)有限公司,批号:C500036]。无血清造血细胞培养和扩增培养基(SFEM;Stem Cell Technologies 公司,批号:18F91500);干细胞生长因子(stem cell factor,SCF;peprotech 公司,批号:AF-300-07);促红细胞生成素(erythropoietin,EPO;peprotech 公司,100-64);白介素-3(IL-3;peprotech公司,AF-200-03);5%人血清(Gemini 公司,货号100-318);CCK-8 试剂盒(beyotime,批号:C0038);珠蛋白单克隆抗体(CST 公司,批号:393865);BCL11A 单克隆抗体(CST 公司,批号75432S)和GAPDH 单克隆抗体(CST 公司,批号:2118S);抗兔IgG 二抗(CST 公司,批号:7074S);HbF-PE (BD 公司;批号:560041);HbA-FITC (biorbyt 公司;批号:orb15725);CD71(PE-Mouse Anti-Human)(BD 公司批 号:555537);CD235a(FITC-Mouse Anti-Human)(BD公司,批号:90249040)。
1.2 细胞收集与培养 细胞来源于广西医科大学第一附属血液内科确诊重型地中海贫血住院患者骨髓液。在广西医科大学第一附属医院伦理委员会的批准及征得患者的知情同意后,采用骨髓穿刺术采集其骨髓液。使用CD34+磁珠分选单个核细胞悬液获得的CD34+细胞。细胞通过两相液体培养模型向红系分化。在最初14 d(第一阶段),SFEM、SCF (50 ng/mL)、EPO (3 000 ng/mL)、IL-3(50 ng/mL)、1%双抗、5%人血清培养;扩大CD34+细胞数量。在接下来的7 d(第二阶段),EPO(3 000 ng/mL)、1%双抗、5%人血清扩增细胞并使其向红系分化。沙利度胺溶解于DMSO。等量DMSO 溶剂为DMSO 组,100 μmol/L 羟基脲为阳性对照组,100 μmol/L、200 μmol/L、300 μmol/L 沙利度胺为实验组。
1.3 实时荧光定量PCR (qPCR)检测γ 珠蛋白与参与调控的转录因子的转录水平
检测HBG、α 珠蛋白基因(HBA)、β 珠蛋白基因(HBB)及相关转录因子BCL11A、ATF4、HRI、KLF1、KLF2、GATA1、SOX6、TAL1表达。提取各组细胞总RNA,测定浓度和纯度。根据逆转录试剂盒说明书将RNA 反转录为cDNA。HBG 及转录因子基因转录水平在CFX96 TM Read Time System(BIO-ROD)PCR 仪器上进行检测。PCR 反应条件:94 ℃预变性5 min,94 ℃变性45 s,60 ℃退火45 s,72℃延伸30 s,共45个循环。采用2-△△CT法进行计算基因表达水平,实验重复3 次。引物均由上海擎科生物科技有限公司合成,引物序列见表1。
1.4 蛋白免疫印迹法(Western blotting,WB)检测γ珠蛋白与转录因子BCL11A翻译水平 收集处理不同分化时间的后各组细胞,RIPA裂解细胞提取总蛋白。BCA 法进行蛋白定量,分别取20 pg 总蛋白上样,湿法转至PVDF 膜,5%的BSA 封闭,一抗γ 珠蛋白、BCL11A、GAPDH(1∶1 000)4 ℃冰箱孵育过夜,加入抗兔IgG 二抗(1∶1 000)。使用ECL 显色,X 线胶片曝光后,凝胶成像分析系统进行图像采集。GAPDH为内参标记抗体。
1.5 流式细胞术 选取最适浓度与检测红系分化免疫荧光染色:PBS 洗涤3 遍,2%多聚甲醛固定,使用破膜剂增加细胞膜透性,HbF-PE 和HbA-FITC 流式抗体染色。细胞的表型特征检测:利用流式细胞仪分析红细胞在不同分化时期细胞表面抗原的表达。使用CD71-PE;CD235a-FITC 标记的单克隆抗体对细胞进行双染色(30 min),采用BD 公司和FlowJo流式细胞仪软件进行分析。

表1 引物序列
1.6 CCK-8 实验 将不同浓度沙利度胺作用不同时间的细胞以104个细胞/孔密度接种到96 孔板中,每组设置3 个副孔。将10 μL CCK-8 溶液添加至每孔中。37 ℃孵育4 h 后,在酶标仪中选择450 nm 波长检测细胞活性。
1.7 统计学方法 采用SPSS 17.0 软件对数据进行统计学分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 沙利度胺诱导重型β 地中海贫血患者红系γ珠蛋白提升的最适浓度与时间 利用CCK8检测不同药物浓度与作用时间对于重型β地贫患者红系细胞生长抑制的情况(图1A)。结果显示,200 μmol/L沙利度胺作用72 h 时抑制率达56.92%。利用qPCR检测不同药物浓度与作用时间对HBG mRNA 表达的影响(图1B)。200 μmol/L、300 μmol/L 沙利度胺作用72 h 后,γ 珠蛋白转录水平比DMSO 组升高2倍(P<0.05),与阳性对照组比较,差异无统计学意义(P>0.05)。随后,利用流式细胞仪检测不同浓度作用72 h 下,HbA 与HbF 的表达(图1C~图1E)。流式结果显示,在200 μmol/L 沙利度胺作用72 h后,HbF 较DMSO 组明显升高。根据结果选择200 μmol/L沙利度胺作用72 h为最适条件。
2.2 沙利度胺对重型β 地贫患者红系的珠蛋白表达的影响 在200 μmol/L 沙利度胺作用重型β 地贫患者红系72 h 下,采用qPCR 检测HBG mRNA 在不同分化时间段表达情况(图2A)。HBG mRNA 在分化第7天开始升高,在红系细胞分化第14天表达量高于对照组3 倍(P<0.05)。相同作用时间和浓度下,沙利度胺对于HBA 与HBB 在分化过程中的表达无明显影响(P>0.05,图2B~图2C)。最后,利用WB 检测重型β 地贫患者红系γ 珠蛋白在分化阶段的表达情况(图2D),200 μmol/L 沙利度胺组γ 珠蛋白在分化第14 天高表达,与qPCR 结果显示一致。结果显示,沙利度胺可以在分化中不影响红系HBA、HBB 转录水平的情况下,提升γ 珠蛋白的转录和翻译水平,并且在分化第14天时提升最明显。
2.3 沙利度胺对重型β 地中海贫血患者红系分化的影响 200 μmol/L 沙利度胺作用β 地贫患者红系72 h 后,利用流式细胞仪检测细胞表面CD71、CD235a 在各个分化时间段表达(图3A~图3C)。随着分化时间的增加,两组红系表面分化标记物CD71、CD235a 逐渐增高。但200 μmol/L 沙利度胺组红系表面分化标记物较DMSO 组在分化后期有所降低(P<0.05),提示沙利度胺对红系分化产生抑制效果。
2.4 参与重型β 地中海贫血患者红系γ 珠蛋白与分化调控基因的表达情况 200 μmol/L沙利度胺作用β 地贫患者红系72 h 后,利用WB 检测BCL11A的表达情况。200 μmol/L 沙利度胺组BCL11A 的转录及翻译水平较DMSO 组减少(P<0.05,图4A~图4B)。利用qPCR 检测β 地贫患者参与红系调控的转录因子在不同分化时间段的表达(图4C~图4I),结果显示,与DMSO 组相比,200 μmol/L 沙利度胺组ATF4 在分化第21 天表达下降(P<0.05);HRI 在分化第14、第21 天表达下降(P<0.05);KLF1 在分化第7、第21 天表达下降(P<0.05);KLF2 在分化中的表达与DMSO 组比较,差异无统计学意义(P>0.05);GATA1 表达量在分化第7、第21 天下降(P<0.05);SOX6 在分化第14、第21 天表达下降(P<0.05);TAL1在分化第21天表达下降(P<0.05)。使用沙利度胺后,红系细胞内BCL11A 下降,同时HRI、ATF4 均为下降趋势,提示沙利度胺可能通过HRI、ATF4 通 路 下 调BCL11A。KLF1、GATA1、SOX6、TAL1 的下调变化可能在沙利度胺提升红系细胞内γ珠蛋白的过程中发挥作用。
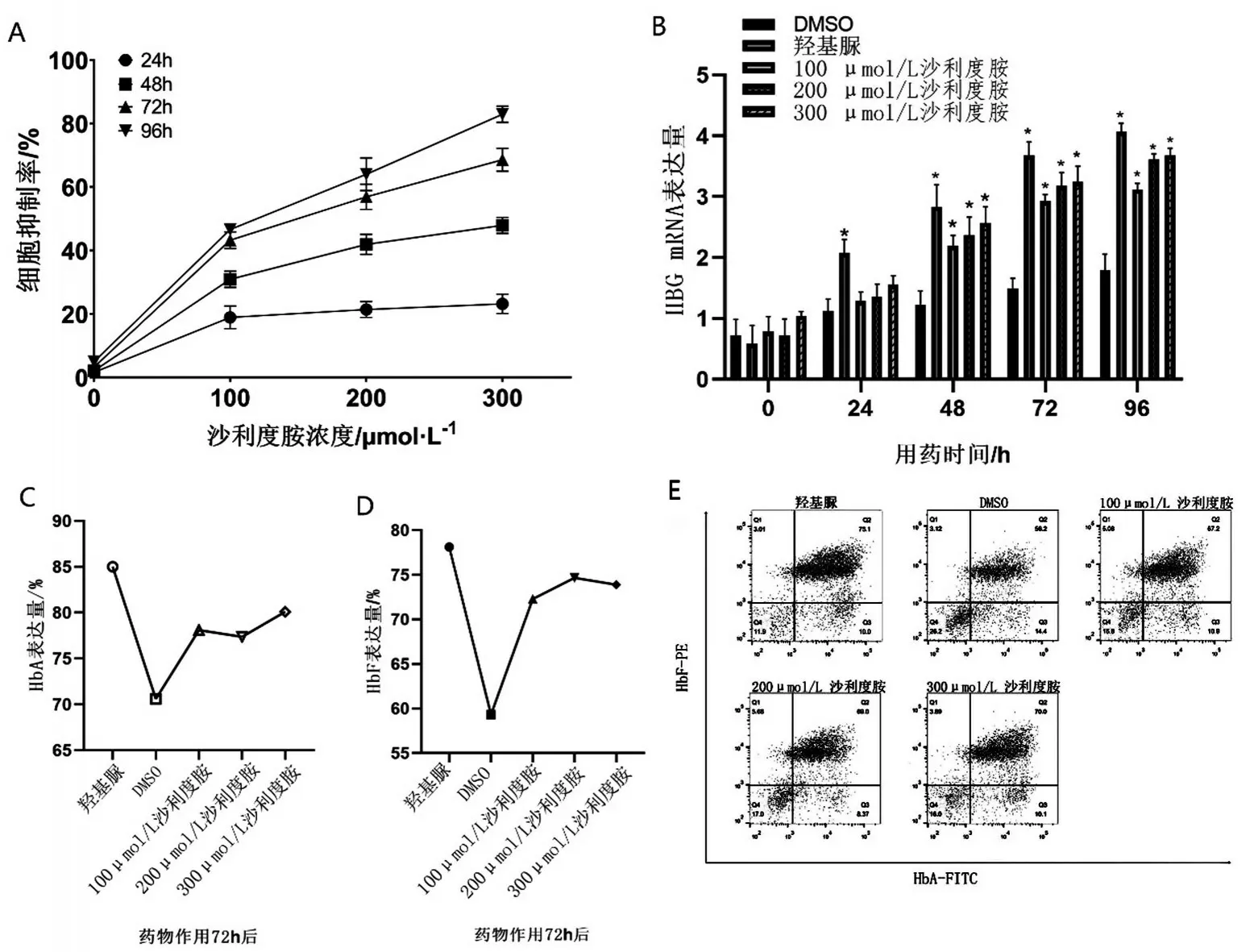
图1 药物浓度与作用时间对于提升β地中海贫血患者红系γ珠蛋白的比较
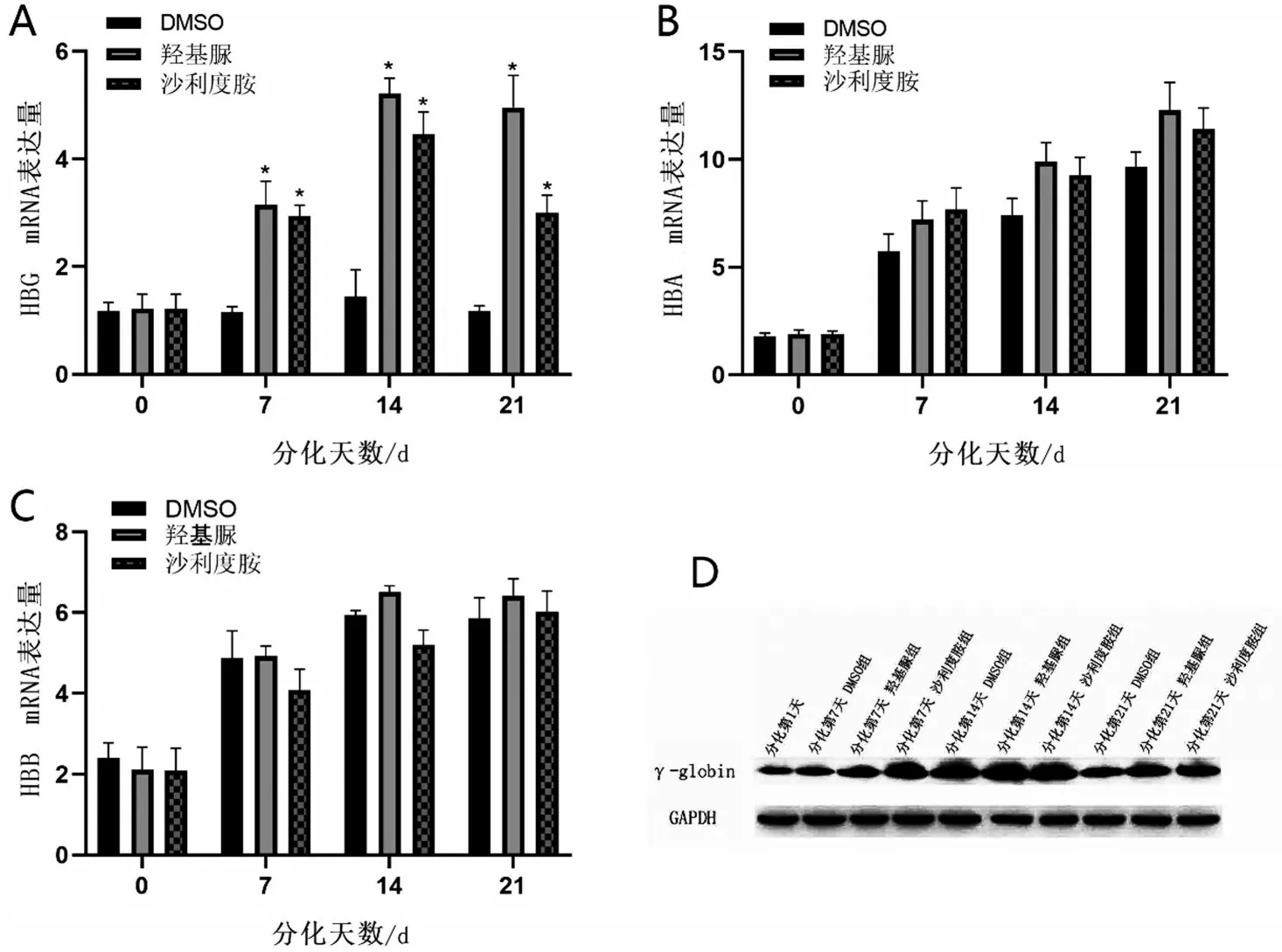
图2 沙利度胺对于β地中海贫血患者红系的γ珠蛋白的影响
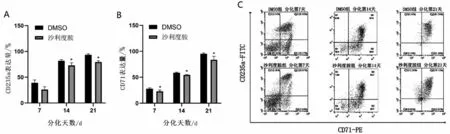
图3 沙利度胺对β地中海贫血患者红系分化的影响
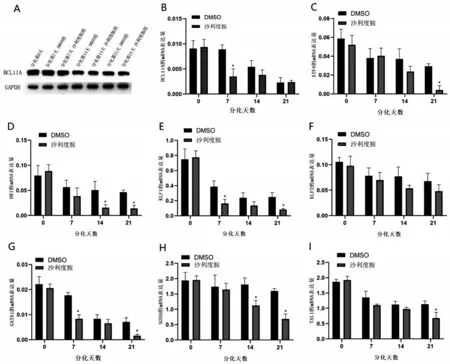
图4 参与调控β地中海贫血患者红系γ珠蛋白的转录因子基因在分化过程中的表达情况
3 讨论
本研究发现,沙利度胺可以在不影响α 珠蛋白与β 珠蛋白的转录水平下,提升体外培养的重型β地贫红系细胞内γ 珠蛋白转录和翻译水平。与DMSO 组相比,γ 珠蛋白转录和翻译水平随着分化时间推移而增加且在第14天达到最高。其次,在沙利度胺的作用下,红系细胞的表面分化标记物表达较对照组下降(P<0.05),提示沙利度胺影响了红系分化。另外,与对照组相比,转录因子BCL11A的表达在分化第7 天降低;KLF1、GATA1 在分化第7、第21 天表达下降;HRI、SOX6 在分化第14、第21 天表达下降;ATF4、TAL1 在分化第21 天表达下降(P<0.05)。上述转录因子可能在沙利度胺提升重型β地贫红系细胞内γ珠蛋白的过程中发挥作用。
CD71 为转铁蛋白受体,在红系分化早期高表达[14]。CD235a 为红系成熟表面标记物[15],随着红系的成熟而表达增加。在分化过程中,沙利度胺组CD235a较DMSO组降低(P<0.05)。提示沙利度胺可能通过减缓体外培养的重型β地贫红系细胞的分化和成熟。研究表明,HRI 可以通过ATF4 调控BCL11A[16]。本研究中,HRI、ATF4 在分化过程中表达降低,提示沙利度胺可能通过HRI、ATF4 通路下调BCL11A。又有研究表明,在珠蛋白基因簇转化的过程中,KLF1、GATA1 参与抑制γ 珠蛋白表达的过程[17];KLF1 与GATA1 在分化第7、第21 天下调可能与其参与沙利度胺诱导红系HBG 表达的过程有关。SOX6 与TAL1 不仅可以抑制γ 珠蛋白的表达,同时在红系分化中参与红系增殖与成熟,调控分化[18-19];在本实验中SOX6 与TAL1 在分化末期第21天均下降,SOX6与TAL1可能也参与沙利度胺诱导红系HBG表达、影响红系分化过程。
目前,一些研究已注意到沙利度胺能提升重型β地贫患者体内γ珠蛋白[20-21]。但少有研究探索沙利度胺提升γ珠蛋白涉及的机制。本研究采用二阶段培养体系体外培养重型β 地贫患者红系细胞,此体系模拟体内环境,结果更具可靠性。结果证实了沙利度胺能诱导体外培养重型β 地贫患者红系细胞γ珠蛋白转录、翻译水平升高。同时发现,沙利度胺可能通过减缓红系细胞的分化成熟,增加未成熟红细胞的增殖,从而有效诱导HbF 产生。在诱导过程中,转录因子BCLl1A、KLF1、GATA1 的下调可能是沙利度胺诱导HBG表达的作用机制之一;并且沙利度胺有可能在分化末期通过影响转录因子SOX6与TAL1,从而减缓红系的分化,调节珠蛋白转录,从而有效诱导γ珠蛋白。

